- •4 Билет
- •5 Билет
- •1Химическое равновесие.
- •6 Билет
- •7 Билет
- •2Электролиз
- •1Изомерия. Виды изомерии, структурная и пространственная изомерия
- •10 Билет
- •11Билет
- •12Билет
- •Вопрос 1.
- •1. Водородные соединения неметаллов. Закономерности в изменении их свойств в связи с положением элементов в периодической системе д.И.Менделеева.
- •13Билет
- •14Билет
- •15Билет
- •16Билет
- •Химические свойства
- •17Билет
- •18Билет
- •19Билет
- •1. Алюминий: положение элемента в периодической системе, строение атома, физические и химические свойства, его роль в современной технике. Где этот металл применяется в вашей профессии.
- •Номенклатура
- •Получение многоатомных спиртов
- •I. Получение двухатомных спиртов в промышленности
- •1. Каталитическая гидратация оксида этилена (получение этиленгликоля):
- •II. Получение трёхатомных спиртов (глицерина)
- •20Билет
- •Волокна растений
10 Билет
1
|
Неметаллы,
их положение в периодической системе
химических элементов Д. И. Менделеева,
строение их атомов. Окислительно-восстановительные
свойства неметаллов на примере
элементов подгруппы кислорода.
|
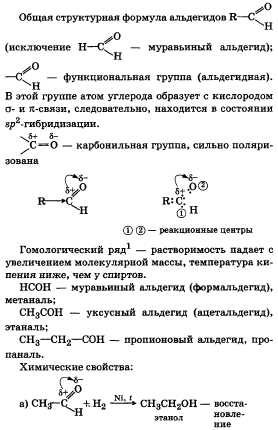
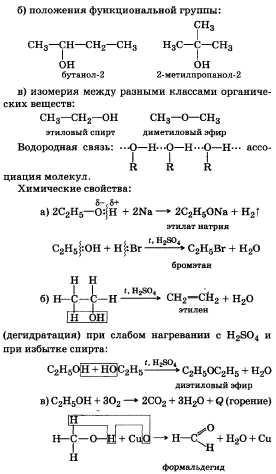
2Предельные одноатомные
спирты, их строение, физические и
химические свойства. Получение и
применение этилового спирта.
![]()


![]()
11Билет
. Вопрос 1.
1. Электрохимический ряд металлов. Практическое применение электрохимического ряда. Коррозия металлов. Способы защиты металлов от коррозии.
Общим свойством всех металлов является их способность окисляться (терять свои валентные электроны), т.е. атомы всех металлов выступают в реакциях в качестве восстановителей.
По своим восстановительным способностям металлы располагаются в ряд, называемый рядом активности металлов или электрохимическим рядом. Он был составлен еще в XIX веке известным русским химиком Н.Н. Бекетовым.
В этом ряду слева находятся металлы, которые имеют сильные восстановительные свойства (Li; K; Ca). Эти металлы легко вступают в реакции, образуя ионы. Правее находятся металлы, являющиеся более слабыми восстановителями (Cu; Ag; Au). Эти металлы с трудом вступают в реакции, окисляясь до ионов
Металлы, стоящие в электрохимическом ряду левее, вытесняют (восстанавливают) из растворов солей металлы, стоящие правее. Иначе говоря, ионы менее активных металлов выступают в качестве окислителей более активных металлов:
Fe + CuSO4 = Cu + FeSO4
Согласно этому правилу ведут себя также ионы водорода H+ (вспомните действие кислот на металлы, стоящие в этом ряду левее водорода)
Zn + 2HCl = ZnCl2 + H2↑
На металлы, стоящие правее водорода, водные растворы кислот не действуют, например, на благородные металлы – серебро или золото.
Под воздействием окружающей среды происходит разрушение металла— Коррозия металлов. Это всегда окислительно-восстановительный процесс. Коррозия бывает двух типов: химическая и электрохимическая.
Химическая коррозия — взаимодействие металла с химически активными веществами среды (вода, воздух, агрессивные жидкие и газовые среды и т.д.) без возникновения в системе электрического тока. При этом окисляется поверхность металла. Многие металлы при комнатной температуре имеют защитную оксидную пленку на поверхности (Al, Cr, Be, Zn, Cu, Ni и др.). При нарушении этой пленки, наличии дефектов или при повышении температуры окисление металла ускоряется. Например, железо во влажном воздухе покрывается бурыми хлопьями ржавчины Fe(OH)3:
4Fe + 3О2 + 6Н2О= 4Fe(OH)3
Электрохимическая коррозия — разрушение металла в среде электролита с возникновением внутри системы электрического тока. Этот вид коррозии происходит при контакте между металлами различной активности. При электрохимической коррозии более активный металл разрушается, а менее активный – нет.
Например, из железа, покрытого слоем цинка (оцинкованного железа) изготавливают многие бытовые изделия. Т.к. цинк более активный металл в паре Fe-Zn, то при контакте с окружающей средой будет разрушаться цинк. Железо — менее активный металл - будет защищенным до тех пор, пока не разрушится весь цинк.
Таков же принцип действия электрохимической коррозии на железо, покрытое хромом (хромированное железо). Покрытие хромом защищает поверхность железа также и за счет образования прочной оксидной пленки на Сг (пассивация).
Основные методы защиты металлов от коррозии базируются на следующих принципах:
· Защита поверхности металла (краска, лак, покрытия
другими металлами, пассивация) от воздействия окружающей среды.
· Пассивация — создание или упрочнение оксидной пленки на поверхности металла.
Многие стали, легированные Cr, Ni, Co, Си обладают повышенной склонностью к пассивации. Другой пример: в таре из пассивированных металлов алюминия или железа транспортируют концентрированную азотную кислоту.
· Электрохимическая (протекторная) защита.
Вместо покрытия поверхности более активным металлом к защищаемому металлу присоединяют анод - протектор (кусок более активного металла, например, цинк, магниевый сплав и т.п.). Протектор в агрессивной среде разрушается, но за счет контакта с защищаемым металлом создается гальваническая пара и катод защищен.
· Изменение состава агрессивной среды введением в электролит ингибиторов (замедлителей) коррозии.
2