- •4 Билет
- •5 Билет
- •1Химическое равновесие.
- •6 Билет
- •7 Билет
- •2Электролиз
- •1Изомерия. Виды изомерии, структурная и пространственная изомерия
- •10 Билет
- •11Билет
- •12Билет
- •Вопрос 1.
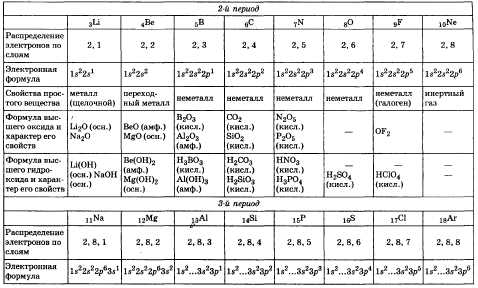
- •1. Водородные соединения неметаллов. Закономерности в изменении их свойств в связи с положением элементов в периодической системе д.И.Менделеева.
- •13Билет
- •14Билет
- •15Билет
- •16Билет
- •Химические свойства
- •17Билет
- •18Билет
- •19Билет
- •1. Алюминий: положение элемента в периодической системе, строение атома, физические и химические свойства, его роль в современной технике. Где этот металл применяется в вашей профессии.
- •Номенклатура
- •Получение многоатомных спиртов
- •I. Получение двухатомных спиртов в промышленности
- •1. Каталитическая гидратация оксида этилена (получение этиленгликоля):
- •II. Получение трёхатомных спиртов (глицерина)
- •20Билет
- •Волокна растений
1билет
1
|
Периодический
закон и периодическая система химических
элементов Д. И. Менделеева на основе
представлений о строении атомов.
Значение периодического закона для
развития науки.
|
2
|
|
2билет
1
|
Строение
атомов химических элементов и
закономерности в изменении их свойств
на примере: а) элементов одного периода;
б) элементов одной главной подгруппы.
|
2
|
Непредельные
углеводороды ряда этилена, общая
формула и химическое строение. Свойства
и применение этилена.
|
3вдруг совпадет
2Na + 2H2O = 2NaOH + H2 2NaOH + CO2 = Na2CO3 + H2O Na2CO3 + 2HCl = 2NaCl + H2O + CO2 NaCl + AgNO3 = NaNO3 + AgCl Fe + 2HCl = FeCl2 + H2 FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl Fe(OH)2 + H2SO4 = FeSO4 + 2H2O FeSO4 + BaCl2 = FeCl2 + BaSO4
3билет
1
|
Виды
химической связи: ионная, металлическая,
ковалентная (полярная и неполярная);
простые и кратные связи в органических
соединениях.
|
2Аминокислоты, их
состав и химические свойства: взаимодействие
с соляной кислотой, щелочами, друг с
другом. Биологическая роль аминокислот
и их применение.



4 Билет
1Классификация
химических реакций в неорганической и
органической химии.





2
|
Крахмал.
Нахождение в природе, практическое
значение, гидролиз крахмала.
|
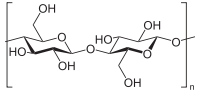
Целлюло́за (фр. cellulose от лат. cellula — «клетка, клетушка») — углевод, полимер с формулой (C6H10O5)n[1], белое твёрдое вещество, нерастворимое в воде, молекула имеет линейное (полимерное) строение, структурная единица — остаток β-глюкозы [С6Н7О2(OH)3]n. Полисахарид, главная составная часть клеточных оболочек всех высших растений.
Целлюлоза |
|
|
|
|
|
|
|
Общие |
|
Химическая формула |
(C6H10O5)n |
Физические свойства |
|
Состояние (ст. усл.) |
белый порошок |
Молярная масса |
324.3 г/моль |
Плотность |
~ 1.5 г/см³ |
Термические свойства |
|
Классификация |
|
Рег. номер CAS |
9004-34-6 |
Регистрационный номер EC |
232-674-9 |
|
|
Целлюлоза представляет собой длинные нити, содержащие 300—10 000 остатков глюкозы, без боковых ответвлений. Эти нити соединены между собой множеством водородных связей, что придает целлюлозе большую механическую прочность, при сохранении эластичности.
Зарегистрирована в качестве пищевой добавки E460.
Химические свойства
Целлюлоза состоит из остатков молекул глюкозы, которая и образуется при гидролизе целлюлозы:
(C6H10O5)n
+ nH2O
![]() nC6H12O6
nC6H12O6
Серная кислота с йодом, благодаря гидролизу, окрашивают целлюлозу в синий цвет. Один же йод — только в коричневый.[источник не указан 692 дня]
При реакции с азотной кислотой образуется нитроцеллюлоза (тринитрат целлюлозы):
5 Билет
1Химическое равновесие.
Химические реакции заключаются во взаимодействии реагентов с образованием продуктов реакциию. Не следует, однако, полагать, что направление химической реакции только одно. В действительности, химические реакции протекают и в прямом, и в обратном направлениях:
Реагенты |
Все химические реакции, в принципе, обратимы. Это означает, что в реакционной смеси протекает как взаимодействие реагентов, так и взаимодействие продуктов. В этом смысле различие между реагентами и продуктами условное. Направление протекания химической реакции определяется условиями ее проведения (температурой, давлением,концентрацией веществ). Многие реакции имеют одно преимущественное направление и для проведения таких реакций в противоположном направлении требуются экстремальные условия. В подобных реакциях происходит почти полное превращение реагентов в продукты. Пример. Железо и сера при умеренном нагревании реагируют между собой с образованием сульфида железа (II), FeS при таких условиях устойчив и практически не разлагается на железо и серу:
Fe + S FeS |
Пример. Реакция синтеза аммиака является обратимой:
N2 + 3H2 2NH3 |
При 200 атм и 400 0С достигается максимальное и равное 36% (по объему) содержание NH3 в реакционной смеси. При дальнейшем повышении температуры вследствие усиленного протекания обратной реакции объемная доля аммиака в смеси уменьшается. Прямая и обратная реакции протекают одновременно в противоположных направлениях.
Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока обе скорости не станут равными и не установится состояние равновесия. |
2
|
Непредельные углеводороды ряда этилена, общая формула и химическое строение. Свойства и применение этилена. |