
- •1.Строение кристаллических тел (по типу связей, по симметрии кристаллов, элементарная кристаллическая ячейка, кристаллографические плоскости и направления). Дефекты строения кристаллических тел.
- •2. Диффузия в металлах и сплавах.
- •4. Механизм кристаллизации. Связь между величиной зерна, скоростью зарождения и роста кристаллов, степенью переохлаждения. Строение слитка. Ликвация.
- •6. Механические свойства материалов (σв, σ0,2 ,σ 0,01, σпц, φ,ε ,ν , е, закон Гука).
- •3. Энергетические условия кристаллизации (первый закон термодинамики, равновесная температура кристаллизации, самопроизвольная и гетерогенная кристаллизация). Полиморфные превращения.
- •5. Упругая и пластическая деформации. Разрушение материалов, влияние концентраторов напряжения. Виды разрушения твердых тел.
- •7. Твёрдость. Определение твёрдости по Бринеллю
- •8. Определение твёрдости по Роквеллу и Виккерсу
- •9. Определение ударной вязкости и предела выносливости.
- •10. Кристаллизация металлических сплавов. Фазы в сплавах.
- •11. Диаграмма состояния сплавов и принципы её построения. Правило фаз и правило отрезков.
- •12. Диаграмма состояния сплавов с неограниченной растворимостью
- •14. Диаграмма состояния сплавов с ограниченной растворимостью и
- •15.Диаграмма состояния сплавов, компоненты которых образуют устойчивые химические соединения
- •17. Связь между свойствами сплавов и диаграм состояния
- •2 2. Структурные превращения в стали при нагреве (наследственно мелкозернистые и крупнозернистые стали).Ферит растворяется в аустените
- •23. Структурные превращения в стали при охлаждении (диаграммы изотермического распада аустенита, образующиеся структуры, их особенности, твердость).
- •27. Термомеханическая обработка сталей (втмо, нтмо, особенности техпроцессов, влияние на свойства сталей).
- •24. Отжиг (виды, технологические режимы, область их применения). Нормализация.
- •26. Отпуск закаленных сталей. Структурные превращения, температурные диапазоны и виды отпуска, образующиеся структуры, области применения. Улучшение.
- •25. Закалка. Критическая скорость закалки. Прокаливаемость. Виды закалки и их применение. Дефекты закалки, методы их устранения и предотвращения.
- •28.Цементация сталей (цель, цементуемые стали, виды цементации, рабочая среда и
- •29.Азотирование сталей (азотируемые стали, глубина слоя, технологические режи-
11. Диаграмма состояния сплавов и принципы её построения. Правило фаз и правило отрезков.
Диаграмма состояния – графическое изображение зависимости фазового состава от химического состава и температуры. Диаграмма содержит изображение состояния равновесия, подчиняется закону существования устойчивых фаз – закону Гиббса.
C=k-f+n – закон Гиббса. Где С – число степеней свободы, k – число компонентов, f – число фаз, истемы ( давление, тем)n – число внешних факторов, оказывающих влияние на состояние системы ( давление, температуры).
Обычно для металлов, при постоянном атмосферном давлении n=1. Тогда: C=k-f+1
Принцип построения диаграммы:
Необходимо приготовить несколько состояний с разной концентрацией компонентов А(100%), В(100%).
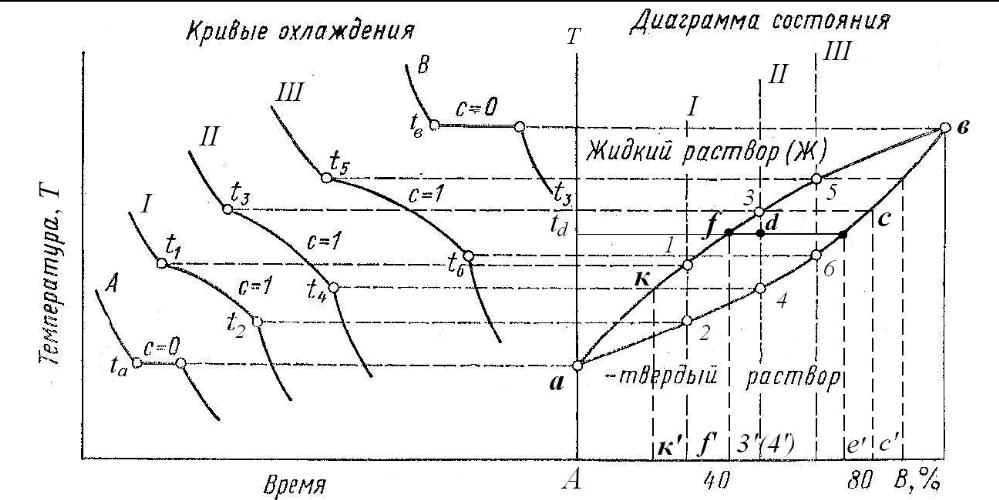
Снять кривые охлаждения сплавов, найти характерные точки изменения кривой охлаждения и нанести их на координате соответствующих концентраций в системе координат «температура – химический состав» 1-ы точки на кривых охлаждения соответствующие температуре начала кристаллизации. 2-е точки – окончанию кристаллизации. Необходимо соединить 1-е и 2-ые точки. Линия начала называется ликвидус. Выше данной линии – жидкость. Линия окончания кристаллизации – солидус. Ниже данной линии вся система находится в твердом состоянии.
Такого вида диаграмма характерна для двухкомпонентных сплавов полной растворимостью друг в друге компонентов А и В в твердом состоянии.
Правила отрезков:
1 Для того чтобы определить концентрации компонентов в фазах, через
данную точку в двухфазной области проводят горизонтальную линию (коноду) до пересечения с линиями, ограничивающими данную область: проекции точек пересечения на ось концентрации показывают составы фаз.
2 правило рычага. нужно провести коноду и представить ее как рычаг с точкой опоры в исследуемой точке. Отрезки этой линии (плечи рычага) между заданной точкой и точками,определяющими составы фаз, обратно пропорциональны количествам этих фаз.
т.k’ – состав фазы L в точке s.
т.p’ – состав фазы А в точке s.
Количество L=(ps/pk)*100%
Количество A=(sk/pk)*100%
___________________________________________________
12. Диаграмма состояния сплавов с неограниченной растворимостью
Характерным является то, что компоненты кристаллизуются в чистом виде.
авс – ликвидус
dве – солидус
На линии ав начинается кристаллизация компонента А, а на линии вс – компонента В.
В точке в одновременно кристаллизуются компоненты Аи В и образуется механич. смесь, назыв. эвтектикой (ж↔А+В).
Фазовое превращение, при кот.из жидкой фазы обр-ся две тв. фазы наз. эвтектическим (dве).
Эвтектика не явл. фазой, это структурная составляющая.
________________________________________________________
14. Диаграмма состояния сплавов с ограниченной растворимостью и
претерпевающих перитектическое превращение

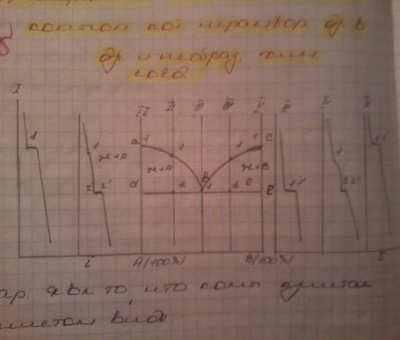
Линия abc - ликвидус, а линия adec – солидус. Точка d характеризует максимальную растворимость компонента В в А, а точка e предельную растворимость А в В. В сплавах, содержащих компоненты в количествах меньше точки f и больше точки k, образуются однофазные твердые растворы соответственно α или β. Линия bde называется линией перитектических превращений. Перитектическое превращение отличается тем, что кристаллизуется только 1 фаза. Сплав II назыв. перитектическим.
ж+β↔α
Правило
отрезков: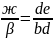
-----------------------------------------------------------------------------------------------
