
- •1. Загальна характеристика неметалічних елементів. Неметали як прості речовини (лекція-бесіда).
- •1. Загальні хімічні властивості
- •1. Розчинність
- •2. Хімічні властивості
- •3. Поширення в природі
- •Хімічні властивості [ред.]
- •1. Фізичні властивості
- •2. Хімічні властивості
- •Алюміній: будова атома, поширення в природі. Фізичні і хімічні властивості алюмінію. Застосування алюмінію
- •Алюміній оксид (глинозем)
- •Алюміній гідроксид
- •Гомологи метану
- •Ненасичені вуглеводні (алкени, алкіни)
- •Ізомерія алкенів і алкінів
- •Етилен й ацетилен
- •Властивості природного газу [ред.]
- •Фізичні властивості [ред.]
- •Отруйні властивості природного газу [ред.]
- •Застосування [ред.]
- •Застосування[ред.]
- •Оксигеновмісні органічні сполуки Насичені одноатомні спирти
- •Застосування спиртів.
- •Багатоатомні спирти
- •Добування фенолу.
- •Хімічні властивості фенолу.
- •Застосування альдегідів.
- •Насичені одноосновні карбонові кислоти
- •Фізичні властивості карбонових кислот.
- •Біологічна дія.
- •Добування карбонових кислот.
- •Хімічні властивості карбонових кислот (на прикладі оцтової кислоти).
- •Застосування карбонових кислот.
- •Естери. Реакція естерифікації Естери
- •Вуглеводи
- •Глюкоза
- •Крохмаль і целюлоза
- •Нітрогеновмісні органічні сполуки Амінокислоти
Алюміній оксид (глинозем)
Біла
тверда речовина, тугоплавка, з дуже
високою твердістю. У природі зустрічається
у вигляді корунду та його
різновидів.
Добування.
—
У промисловості з мінералів: бокситів
або нефелінів.
—
У лабораторії:
1)
спалювання алюмінію:
![]() 2)
прожарювання алюміній гідроксиду:
2)
прожарювання алюміній гідроксиду:
![]() Хімічні
властивості.
Алюміній
оксид виявляє амфотерні властивості,
тобто реагує як з кислотами, так і з
основами (див. таблицю).
Хімічні
властивості алюміній оксиду
Хімічні
властивості.
Алюміній
оксид виявляє амфотерні властивості,
тобто реагує як з кислотами, так і з
основами (див. таблицю).
Хімічні
властивості алюміній оксиду
Реагент |
Рівняння реакції |
Продукти реакції |
Умови перебігу реакції |
Хлоридна кислота |
|
Алюміній хлорид і вода |
Нагрівання |
Твердий натрій гідроксид |
|
Натрій метаалюмінат і вода |
Нагрівання, сплавлення |
Розчин натрій гідроксиду |
|
Натрій тетрагідроксо-алюмінат |
Нагрівання |
Застосування: — у лазерах; — як абразивний матеріал; — ювелірні прикраси, годинники; — як тугоплавкий матеріал.
Алюміній гідроксид
Біла
тверда речовина, практично нерозчинна
у воді.
Добування.
Дія розчинів лугів на солі алюмінію:
![]() Хімічні
властивості. Типовий амфотерний гідроксид
(див. таблицю).
Хімічні
властивості алюміній гідроксиду
Хімічні
властивості. Типовий амфотерний гідроксид
(див. таблицю).
Хімічні
властивості алюміній гідроксиду
Реагент |
Рівняння реакції |
Продукти реакції |
Умови перебігу реакції |
Хлоридна кислота |
|
Алюміній хлорид і вода |
Нагрівання |
Твердий натрій гідроксид |
|
Натрій метаалюмінат |
Нагрівання, сплавлення |
Розчин натрій гідроксиду |
|
Натрій тетрагідроксоалюмінат |
Звичайні умови |
Ферум – металічний елемент побічної підгрупи VІІІ групи 4 періоду періодичної системи хімічних елементів. Він є представником d-елементів. На зовнішньому енергетичному рівні атома Феруму знаходиться два s-електрони, а на передзовнішньому енергетичному рівні відбувається заповнення d-підрівня. У своїх сполуках Ферум здатен проявляти ступені окиснення +2 та +3.
Масова частка Феруму в земній корі становить 5 %. Він займає четверте місце по розповсюдженості в природі. Найважливішими залізними рудами є: магнетит Fе3О4, гематит Fe2О3, лімоніт — Fe2O3 · nH2O, сидерит FеСО3, пірит FеS2.
Ферум є біологічно важливим елементом. Він міститься в організмах усіх тварин і в рослинах. Ферум входить до складу цитоплазми рослин, бере участь у процесі фотосинтезу. В організмі дорослої людини міститься десь 4 г Феруму. Він накопичується здебільшого в печінці, кістковому мозку, селезінці. Але основна частина Феруму входить до складу гемоглобіну – червоного пігменту крові, який виконує функцію переносу кисню від легень до тканин, а в зворотному напрямку — вуглекислого газу. Нестача Феруму призводить до небезпечної хвороби — недокрів’я. Тому обов’язково треба вживати харчові продукти, багаті на Ферум: петрушку, печінку, телятину, гречку, курагу тощо.
Ферум(ii) оксид FeO
Чорний
порошок, який легко окиснюється. У воді
практично нерозчинний.
Добування: ![]() Хімічні
властивості. Основний оксид, характерна
взаємодія з кислотами:
Хімічні
властивості. Основний оксид, характерна
взаємодія з кислотами:
![]() .
.
Ферум(iii) оксид
Найстійкіша
природна оксигеновмісна сполука Феруму.
У воді практично нерозчинний.
Добування.
Розкладання ферум(III) гідроксиду під
час нагрівання:
![]() Хімічні
властивості. Слабко амфотерний оксид.
Хімічні
властивості. Слабко амфотерний оксид.
Ферум(ii) гідроксид
Осад
білого кольору. На повітрі окиснюється
до ферум(III) гідроксиду, забарвлення
стає зеленуватим, а потім бурим:
![]() Добування.
Дія розчинів лугів на розчини солей
феруму(II):
Добування.
Дія розчинів лугів на розчини солей
феруму(II):
![]() Хімічні
властивості. Слабкий амфотерний
гідроксид. Характерна взаємодія з
кислотами:
Хімічні
властивості. Слабкий амфотерний
гідроксид. Характерна взаємодія з
кислотами:
![]()
Ферум(iii) гідроксид
Осад
червоно-бурого кольору.
Добування.
Дія розчинів лугів на розчини солей
феруму(III):
![]() Хімічні
властивості. Основний гідроксид.
Характерна взаємодія з кислотами:
Хімічні
властивості. Основний гідроксид.
Характерна взаємодія з кислотами:
![]()
Металу́ргія (рос. металлургия, англ. metallurgy, нім. Metallurgie f, Hüttenwesen n, Hüttenkunde f) — наука, техніка і галузь промисловості, пов'язана з одержанням металів з руд або металовмісних речовин з наданням їм необхідних властивостей. У прикладному плані — сукупність зв'язаних між собою галузей і стадій виробничого процесу від видобутку сировини до випуску готової продукції — чорних і кольорових металів і їх сплавів (стопів).
До чорних металів відносять залізо, марганець і хром. Решта — кольорові. За фізичними властивостями і призначенню кольорові метали умовно ділять на важкі (мідь, свинець, цинк, олово, нікель) і легкі (алюміній, титан, магній).
Властивості металів та методи їхньої модифікації вивчає металознавство.
Сплав (стоп[1]) — тверда або рідка однорідна речовина, утворена сплавленням (стопленням) кількох металів або металів з неметалами.[2]
Однорідні стопи (сплави) утворюються в тих випадках, коли атоми одного металу можуть заміщатися атомами іншого металу у вузла кристалічних ґраток. За такого заміщення творяться кристали зі структурою, що схожа на структуру вихідних металів, проте з атомами різного ґатунку, чим і зумовлена однорідність стопу (сплаву). Такі стопи звуть твердими розчинами. Тверді розчини утворює Аурум з Арґентумом, Нікол з Купрумом, тощо.
Неоднорідні сплави є механічною сумішшю кристалітів металів. До того ж кожний з металів зберігає свою кристалічну ґратку. Наприклад, структура стопів Стануму з Плюмбумом, які використовують як м'які припої, складається з кристалітів чистого Стануму та кристалітів чистого Плюмбуму.
У вільному стані в природі зустрічаються тільки неактивні метали. Так у вигляді самородків зустрічаються золото й платина, іноді – срібло й мідь. Добування цих металів пов’язане лише з механічним відокремленням їх від домішок. Більшість металічних елементів легко окиснюються й існують в природі тільки у сполуках: оксидах (Fe3O4, Cr2O3), сульфідах (FeS2, ZnS), солях (NaCl, CaCO3). Саме з таких природних сполук і добувають метали шляхом їх хімічної переробки.
Природні мінеральні сполуки, з яких економічно доцільно видобувати метал у виробничих умовах називають рудами. Найважливішими рудами є оксиди, сульфіди і карбонати металічних елементів. Першим етапом переробки руд є видалення пустої породи — збагачення руди. Добування металів із руд ґрунтується на їх відновленні різними способами.
Найважливіший спосіб одержання металів із руд — відновлення оксидів відповідних металічних елементів вугіллям (коксом) при нагріванні:
SnO2 + C = Sn + CO2.
Досить часто оксидні руди відновлюють карбон(ІІ) оксидом, а інколи — воднем:
Fe2O3 + 3CO = 2Fe + 3CO2
WO3 + 3H2 = W + 3H2O.
Сульфідні руди спочатку випалюють, а потім відновлюють одержаний оксид:
2PbS + 3O2 = 2PbO + 2SO2
PbO + C = Pb + CO.
Важливим методом добування металів є відновлення менш активних металів активнішими металами і деякими неметалами при нагріванні. Відновлення алюмінієм називають алюмінотермією, відновлення магнієм — магнієтермією, силіцієм — силікотермією:
Fe2O3 + 2Al = 2Fe + Al2O3.
Органі́чні сполу́ки — клас сполук, в склад яких входить сполука Карбон (за винятком карбідів, карбонатної кислоти, карбонатів, оксидів Карбону і ціанідів). Окрім Карбону, вони майже завжди містять Гідроген, досить часто — Оксиген, Нітроген та галогени, рідше Фосфор, Сульфур та інші елементи. В органічних сполуках Карбон завжди виявляє валентність IV.
До органічних сполук належать не тільки природні речовини, які отримуються при розвитку рослин, або в результаті життєдіяльності тварин, але і багато штучно отриманих в лабораторії речовин. До складу органічних молекул органічних речовин поруч з вуглецем входять деякі хімічні елементи. Це насамперед водень, кисень, азот, сірка, галогени і фосфор. Інші елементи рідко зустрічаються в органічних сполуках; органічні речовини, які містять благородні гази, невідомі. Не дивлячись на значну кількість елементів, які входять до складу неорганічних сполук, кількість органічних сполук набагато переважає кількість неорганічних. Сьогодні відомо понад сім мільйонів органічних речовин. Однією з важливих особливостей органічних сполук, яка накладає відбиток на всю хімічну поведінку, є характер зв’язків між атомами в їх молекулах. У переважній більшості випадків ці зв’язки мають яскраво виражений ковалентний характер. Тому органічні сполуки, як правило, не дисоціюють на іони і порівняно повільно взаємодіють один з одним. Тоді як реакції між електролітами в розчинах протікають майже миттєво, час, необхідний для завершення тієї або іншої реакції між органічними речовинами, звичайно вимірюється годинами, а іноді і днями. От чому в органічній хімії велике значення має застосування різних каталізаторів. Інша характерна риса органічних сполук полягає в їхній схильності піддаватися при нагріванні без доступу повітря глибоким змінам, в результаті котрих утворюються нові речовини, які мають абсолютно інші властивості. Якщо ж вести нагрівання при доступі повітря або у присутності окисників, то органічні речовини згорають, причому вуглець і водень що входять до їх складу цілком перетворюються на двоокис вуглецю і воду, а азот звичайно виділяється у вільному стані. На цьому заснований елементний аналіз органічних речовин: вміст вуглецю і водню в згорілій речовині визначають за кількістю двоокису вуглецю і води, які утворилися, азот, що виділився, вимірюють безпосередньо, а вміст кисню встановлюють за різницею між вагою згорілої речовини і вагою решти елементів, що містилися в ньому. Дані аналізу і визначення молекулярної ваги дозволяють вивести молекулярну формулу органічної речовини. Проте на відміну від неорганічних сполук молекулярна формула органічної речовини ще не дає уявлення ні про його характер, ні про його властивості. Річ у тому, що відомо дуже багато органічних сполук, які мають однаковий склад і однакову молекулярною вагу, але абсолютно різні фізичні і навіть хімічні властивості. Це явище, широко поширене серед органічних сполук, одержало назву ізомерії, а речовини, що відповідають одній і тій же молекулярній формулі, але відрізняються за своїми властивостями, називаються ізомерами. Пояснення різних випадків ізомерії дає теорія будови органічних сполук, створена в шестидесятих роках позаминулого сторіччя Бутлеровим, згідно з якою властивості речовин визначаються не тільки їх якісним і кількісним складом, як вважали раніше, але і внутрішньою будовою молекул, певним порядком з’єднаних між собою атомів, утворюючих молекулу. Цей внутрішній устрій Бутлеров назвав «хімічною будовою». Особливо важливою була ідея Бутлерова про те, що атоми, з’єднуючись хімічно в певній послідовності відповідно до їх валентності, взаємно впливають один на одного таким чином, що частково змінюється їх власна природа, їх «хімічний зміст». Вчення Бутлерова про хімічну будову молекул складають теоретичну основу органічної хімії.
Теорія хімічної будови. Поняття «хімічна будова» вперше ввів О. М. Бутлеров у 1861 р. Він зауважував, що властивості речовин визначаються не тільки їхнім складом (якісним і кількісним), як вважалося раніше, а й внутрішньою структурою молекул, тобто порядком з'єднання атомів один з одним, які входять до складу молекули. Цей порядок і є хімічною будовою молекули. У поняття «хімічна будова» О. М. Бутлеров включав також характер зв'язку атомів, їхній взаємний вплив один на одного. Наприклад, водень і кисень, утворивши воду, настільки змінилися від взаємного впливу, що вода вже не має властивостей ні водню, ні кисню, хоча й містить Гідроген і Оксиген, що входили до складу відповідно водню і кисню. У молекулі фенолу С6Н5ОН бензольне ядро впливає на властивості гідроксильної групи, посилюючи її кислотність (аналогія зі спиртами):
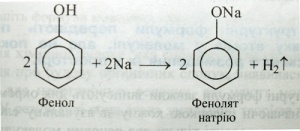
Гідроксильна група, у свою чергу, впливає на властивості бензольного ядра і полегшує заміщення в ньому атомів Гідрогену:
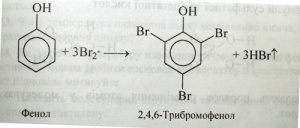
Так, на прикладах з неорганічної та органічної хімії ми спостерігаємо взаємний вплив атомів. Хімічну будову молекул виражають за допомогою структурних формул.
Багатоманітність органічних сполук, їх класифікація.
Щодня кількість добутих і описаних хіміками органічних речовин зростає майже на тисячу. Нині їх відомо близько 20 мільйонів(неорганічних сполук існує в десятки разів менше).
Причиною розмаїття органічних сполук є унікальність атомівКарбону, а саме:
-досить висока валентність - 4;
-можливість утворення простих, подвійних і потрійних ковалентних зв'язків;
-здатність сполучатися один з одним;
-можливість утворення лінійних ланцюгів, розгалужених, а також замкнених, які називають циклами.
Серед органічних речовин найбільше сполук Карбону з Гідрогеном; їх називають вуглеводнями. Ця назва походить від старих наз елементів - "вуглець" і "водень".
Класифікація органічних сполук.
Сучасна класифікація органічних сполук базується на теорії хімічної будови. В основу класифікації покладено особливості будови вуглецевого ланцюга вуглеводнів, оскільки вони прості за складом і в більшості відомих органічних речовин вуглеводневі радикали становлять основну частину молекули.
Залежно від будови вуглецевого ланцюга органічні сполуки поділяються на дві великі групи: ациклічні і циклічні. Ациклічні сполуки називають ще сполуками жирного ряду, або аліфатичними. До них належать всі вуглеводні та їх похідні, в молекулах яких немає кілець або циклів, а є тільки так звані «відкриті ланцюги» вуглецевих атомів. Ациклічні сполуки поділяються на насичені вуглеводні гомологічного ряду метану і ненасичені сполуки, в молекулах яких між вуглецевими атомами є кратні (подвійні або потрійні) зв'язки.
Циклічні сполуки поділяють на карбоциклічні (цикли складаються тільки з атомів вуглецю) та гетероциклічні (в цикли, крім атомів вуглецю, входять інші атоми, найчастіше азоту, сірки, кисню). Карбоциклічні органічні сполуки, в свою чергу, поділяються на аліциклічні і ароматичні. До аліциклічних сполук належать всі карбоциклічні вуглеводні крім ароматичних сполук, до ароматичних — бензол, нафталін, антрацен тощо та їх похідні. Органічні сполуки залежно від складу і будови поділяють на класи. Заміщенням атомів водню у молекулах вуглеводнів на інші атоми або групи атомів (функціональні групи) можна добути інші класи органічних сполук даного ряду. Функціональні групи, окремі атоми-замісники, на які заміщено атом водню в молекулі органічної сполуки, визначають типові хімічні властивості цих сполук.
Вивчення органічної хімії, як правило, починають з вивчення найпростішого класу органічних сполук — вуглеводнів.
Ізомерія — це явище існування речовин з однаковим якісним і кількісним складом, але різною хімічною будовою, а тому й різними властивостями.
Вуглеводні бувають
Насичені вуглеводні Ненасичені вуглеводні Ароматичні (алкани, циклоалкани) | | вуглеводні
Алкени Алкіни Дієнові вуглеводні
Алкани є найпростішими вуглеводнями. Всі атоми вуглецю в молекулах алканів сполучені один з одним простими, одинарними зв'язками. Алкани називають також парафінами, насиченими вуглеводнями.
Метан. Найпростіший алкан - метан СН4, молекула якого складається з одного атома вуглецю і чотирьох атомів водню.
Як уже зазначалось,атом вуглецю, що утворює чотири ковалентних зв'язки, знаходиться у збудженому стані (1s22s12p3). В утворенні чотирьох ковалентних зв'язків беруть участь одна s - і три р - орбіталі (рх, ру, рz) зовнішнього енергетичного рівня одного атома вуглецю. Всі чотири ковалентних зв'язки,які утворює вуглець у молекулі СН4, рівноцінні: мають однакову довжину, енергію зв'язку та інші властивості.
Рівноцінність хімічних зв'язків у метані можна пояснити, використовуючи поняття про гібридизацію орбіталей. Гібридизацією називається зміна форми і енергії різних орбіталей одного атома, яка приводить до утворення однакових (гібридизованих ) орбіталей.
Наприклад, при утворенні молекули метану гібридизації зазнають орбіталі атома вуглецю: одна s - і три р - орбіталі. Вид і число орбіталей, які беруть участь у гібридизації,визначають ії тип. Так, у метані виявляється sр3- гібридизація.
