
- •1. Загальна характеристика неметалічних елементів. Неметали як прості речовини (лекція-бесіда).
- •1. Загальні хімічні властивості
- •1. Розчинність
- •2. Хімічні властивості
- •3. Поширення в природі
- •Хімічні властивості [ред.]
- •1. Фізичні властивості
- •2. Хімічні властивості
- •Алюміній: будова атома, поширення в природі. Фізичні і хімічні властивості алюмінію. Застосування алюмінію
- •Алюміній оксид (глинозем)
- •Алюміній гідроксид
- •Гомологи метану
- •Ненасичені вуглеводні (алкени, алкіни)
- •Ізомерія алкенів і алкінів
- •Етилен й ацетилен
- •Властивості природного газу [ред.]
- •Фізичні властивості [ред.]
- •Отруйні властивості природного газу [ред.]
- •Застосування [ред.]
- •Застосування[ред.]
- •Оксигеновмісні органічні сполуки Насичені одноатомні спирти
- •Застосування спиртів.
- •Багатоатомні спирти
- •Добування фенолу.
- •Хімічні властивості фенолу.
- •Застосування альдегідів.
- •Насичені одноосновні карбонові кислоти
- •Фізичні властивості карбонових кислот.
- •Біологічна дія.
- •Добування карбонових кислот.
- •Хімічні властивості карбонових кислот (на прикладі оцтової кислоти).
- •Застосування карбонових кислот.
- •Естери. Реакція естерифікації Естери
- •Вуглеводи
- •Глюкоза
- •Крохмаль і целюлоза
- •Нітрогеновмісні органічні сполуки Амінокислоти
1. Загальна характеристика неметалічних елементів. Неметали як прості речовини (лекція-бесіда).
Учні в ході лекції-бесіди, з допомогою вчителя, записують основні тези.
Елементи-неметали розміщенні в правій верхній частині періодичної системи хімічних елементів.
Неметали – переважно р-елементи, що містять на останньому електронному шарі велику кількість електронів, а саме від 4 до 7, які міцно з’єднані з ядром.
Прості речовини утворені атомами неметалів мають молекулярну кристалічну гратку – це водень, кисень, хлор, бром; атомну – бор, алмаз.
За агрегатним станом речовини з молекулярною кристалічною граткою гази (водень, кисень, хлор), рідини(бром), легкоплавкі тверді речовини (фосфор,йод,сірка).
За агрегатним станом речовини з атомною кристалічною граткою тверді, тугоплавкі (алмаз, бор).
Існують прості речовини молекули яких складаються з великої кількості атомів: О3-озон, Р4 – білий фосфор, S 8– ромбічна сірка
§ 9. ПОНЯТТЯ ПРО АЛОТРОПІЮ. Хімічні елементи у вільному стані існують у формі простих речовин. Так, елемент Оксиген утворює дві прості речовини - кисень О2 та озон О3. Озон. Якщо на кисень подіяти електричним розрядом, то з'являється характерний запах свіжості -утворюється газуватий озон: 3O2 2O3 Кисень поглинає енергію і перетворюється на озон, а озон самовільно розкладається, утворюючи кисень. Обидві прості речовини -кисень O2 і озон О3 -утворені одним і тим самим хімічним елементом - Оксигеном, а властивості у них різні (табл. 1). Явище існування хімічного елемента у вигляді двох або кількох простих речовин, різних за властивостями і будовою, називається алотропією, а самі прості речовини- алотропними формами/ Кисень O2 і озон О3 -алотропні форми елемента кисню. Оксигену. Таблиця 1. Властивості кисню й озону Властивості простих речовин Прості речовини Кисень озон Агрегатний стан за звичайних умов Газ Газ Колір Безбарвний Синій Запах Без запаху Різкий, своєрідний Розчинність (у 100 об'ємах Н2О при 200С) 3 об'єми 49 об'ємів Густина газу за н.у. 1,43 г/л 2,14 г/л Температура кипіння -9310С -1120С Температура плавлення -2190С -1920С Фізіологічна дія Неотруйний Дуже отруйний Хімічні властивості Окисник Дуже сильний окисник Реакційна здатність Висока Жуже висока Підвищена окисна здатність озону (порівняно з киснем) пояснюється низькою енергією відриву атома Оксигену від молекули озону Оз, і в реакціях окиснення беруть участь саме ці атоми Оксигену. Застосування озону зумовлене його винятковими окисними властивостями. Озон використовується для озонування питної води, що значно ефективніше, ніж хлорування; для знешкодження промислових стічних вод; вибілювання тканин, мінеральних масел; як дезінфікуючий засіб у медицині; як окисник ракетного палива. Зверніть увагу на фізіологічну дію озону: він отруйний для людини, тварин і рослин. Невеликі концентрації озону в повітрі створюють відчуття свіжості, але вдихання повітря навіть із зовсім малою концентрацією озону викликає подразнення дихальних шляхів, кашель, блювоту, запаморо-чення, стомленість. Проте озон може бути не лише шкідливим, а й корисним. Роль озону в збереженні життя на Землі. Біля поверхні Землі озону мало. Його концентрація у повітрі коливається (вночі менша, вдень більша). Влітку і навесні його в повітрі у 3,5 раза більше, ніж узимку і восени. Над полярними частинами Землі вміст озону в повітрі вищий, ніж над екватором, в атмосфері міст -вищий, ніж у сільській місцевості. З віддаленням від поверхні Землі концентрація озону збільшується і досягає максимуму на висоті 20-25 км. Там утворюється так званий озоновий шар. Озоновий шар відіграє значну роль у збереженні життя на нашій планеті. Він затримує найбільш згубну для людини, тварин і рослин частину ультрафіолетової радіації Сонця, яка спричинює онкологічні (ракові) захворювання шкіри. Окрім того, озоновий шар разом з вуглекислим газом СО2, поглинає інфрачервоне випромінювання Землі і тим самим запобігає її охолодженню. Так озоновий шар забезпечує збереження життя на Землі. Виникає запитання, звідки ж береться озон в атмосфері і як саме він захищає нас. Озон утворюється у верхніх шарах атмосфери внаслідок поглинання киснем ультрафіолетового випромінювання Сонця: O2 + hv O + O O + O2 O3 Крім того, поглинаючи променисту енергію Сонця (фотони), молекули кисню переходять у збуджений стан (помічено зірочкою) і під час дальшої взаємодії зі звичайним киснем також утворюють озон: O2 + hv O2 O2 + O2 O3 + O O + O2 O3 Озон, що утворився, огортає Землю з усіх боків. Але молекули озону існують недовго. Відбувається зворотна реакція фотохімічного розкладу озону, яка, власне, являє собою поглинання озоном фотонів: O3 + hv O2 +O Отже, в атмосфері існує цикл озону-збалансоване утворення і розклад його. Результатом існування цього циклу є перетворення ультрафіолетового випромінювання Сонця на теплову енергію. Але для нас головна "заслуга" озону полягає в тому, що він, "жертвуючи собою", поглинає ультрафіолетове випромінювання і тим самим не допускає високоенергетичні фотони Сонця до Землі. Озоновий шар не є стабільним. Він може самовільно то збільшуватись, то зменшуватись над певною місцевістю по кілька разів на рік. Під впливом природних факторів (фотохімічного розкладу, виверження вулканів, значного переміщення великих повітряних мас), а більшою мірою під впливом забруднення навколишнього середовища він зазнає руйнування, внаслідок чого утворюються так звані "озонові дірки", які збільшують ультрафіолетове навантаження на все живе на Землі. Причиною техногенного руйнування озонового шару є забруднення атмосфери оксидами нітрогену, наявність яких у 20 разів збільшує токсичність озону. Так, масове викидання в атмосферу вихлопних газів реактивних літаків, що містять оксиди нітрогену, руйнує озоновий шар. Окрім того, використання хлоро- і флуоровмісних речовин (фреонів) у холодильних машинах також спричинює руйнування озонового шару. Адже фреони, якщо потрапляють в атмосферу, реагують лише з озоном, бо відносно інших речовин вони інертні. Внаслідок цього над місцевістю може утворитися "озонова дірка". Над Україною (окрім південної частини) загальний вміст озону за останні 20 років зменшився на 6 %, і утворилася аномальна зона. Вам про це слід пам'ятати! Особливо небезпечна "озонова дірка" влітку. У цей період дуже потерпають очі, тому треба користуватися сонцезахисними окулярами. Варто утримуватися і від загару, щоб не зашкодити шкірі. Алотропія кисню й озону зумовлена різною кількістю атомів Оксигену в молекулах речовин -О2 і О3. Проте буває й інша причина алотропії -різна структура кристалів.
Алотропні модифікації Карбону. Додатковий матеріал до уроку з хімії для 10 класу |
09.09.11 14:03 |
|
1. Алотропні модифікації Карбону Хімічний елемент Карбон утворює кілька простих речовин. Для них існує загальна хімічна назва вуглець. Явище існування хімічного елемента у вигляді двох або кількох простих речовин, різних за властивостями і будовою, називається алотропією, а самі прості речовини – алотропними формами (модифікаціями). Вуглець утворює декілька алотропних видозмін: природні: o алмаз o графіт o фулурен o вуглецеві нанотрубки
o карбін, o графен o аморфний вуглець у вигляді сажі і деревного вугілля 1.1 Алмаз Поширеними природними алотропними видозмінами Карбону є алмаз і графіт. Ці речовини відрізняються між собою розміщенням атомів у вузлах кристалічних ґраток. В алмазі щодо будь-якого атома Карбону чотири сусідніх атоми розташовані в кутах правильного тетраедра. Завдяки такому розташуванню атомів Карбону всі зв’язки рівноцінні (прості ковалентні), а відстані між атомами — однакові.
Така будова кристалічної ґратки алмазу забезпечує його високу твердість, він є найтвердішою природною речовиною. Алмаз прозорий, безбарвний, не проводить електричного струму, дуже добре заломлює світло. Алмази використовують для різання скла, буріння гірських порід (алмазні різці,свердла, шліфувальні круги), для різання і шліфування металів. Спеціально оброблений алмаз називають діамантом, він високо цінується серед ювелірних прикрас.
1.2 Графіт У кристалічній ґратці графіту атоми Карбону розташовані окремими шарами. Зв’язки між атомами реалізуються лише в шарі, який нагадує бджолиний стільник. Кожний атом Карбону сполучений із трьома іншими атомами простими ковалентними зв’язками за рахунок трьох валентних електронів. Четвертий електрон переходить від одного атома до іншого в шарі. Такі електрони зумовлюють електропровідність графіту. Завдяки шаруватій будові графіт досить м’який. Коли ми пишемо олівцем, шари атомів легко відокремлюються один від одного і залишаються на папері. У межах одного шару атоми Карбону об’єднані в шестиатомні кільця. Зв’язки в межах одного шару набагато сильніші, аніж з атомами сусіднього шару, до того ж відстань між шарами майже в 2,5 раза більша порівняно з відстанями між атомами в межах одного шару. Графіт непрозорий, сірого кольору, з металічним блиском, масний на дотик і досить м’який. На відміну від алмазу він проводить електричний струм і тепло. Як м’яку речовину, графітовий порошок використовують для змащування рухомих частин машин і механізмів, щоб зменшити силу тертя. Завдяки електропровідності його використовують у хімічній промисловості як матеріал для електродів, а завдяки теплопровідності — у теплообмінниках. Отже, через різну будову кристалічних ґраток алмаз і графіт проявляють відмінні фізичні властивості. У природі вільний Карбон трапляється здебільшого у вигляді графіту й дуже рідко — у вигляді окремих кристалів алмазу. Нині налагоджено промислове виробництво синтетичних алмазів. Так званий аморфний вуглець (сажа, деревне вугілля) не належить до самостійних алотропних видозмін Карбону, а є дуже дрібними різнозорієнтованими кристаликами графіту.
1.3 Карбін Ще одну алотропну видозміну Карбону карбін спочатку добули синтетичним способом, а потім виявили в природі у вигляді прожилок і вкраплень у графіті. Атоми Карбону в карбіні сполучені в прямолінійні карбон-карбонові ланцюги =С=С=С= або –С_С–С_С–, розташовані паралельно один до одного. Це біла тверда речовина з надзвичайно довгими молекулами. Карбін має напівпровідникові властивості, які посилюються під дією світла. На цій властивості базується його практичне застосування у фотоелементах. 1.4 Фулерени Фулере́ни або бакиболи — одна з кількох алотропних модифікацій Карбону. Відкриті в 1985 Робертом Керлом, Гарольдом Кротой Річардом Смолі, ці невеличкі молекули, що складаються тільки з атомів Карбону. Свою назву фулерени отримали за прізвищем архітектора Бакмінстера Фулера, котрий сконструював купол і павільйон США на виставці у Монреалі у 1967 році у вигляді сполучених пентагонів та гексагонів. Першовідкривачі отримали Нобелівську премію з хімії за 1996 рік. Найвідоміший фулерен — молекула C60, яка має ідеальну форму футбольного м'яча. Природні фулерени можна знайти в сажі. Фулерен – п’ята алотропна модифікація вуглецю. Цей термін застосовують до широкого класу сполук із мінімально можливою будовою у 60 атомів вуглецю, що поєднані ковалентним зв’язком у сферичну молекулу, де кожен атом вуглецю поєднаний із трьома іншими, утворюючи п'ятикутники та шестикутники на поверхнях. Найбільша молекула фулерену складається із 560 атомів вуглецю. Найбільш вивченою молекулою фулерену є молекула С60. С60 найменший фулерен, що відповідає правилу ізольованого пентагону і тому він є найменшим стійким фулереном. Якийсь час фулерен був доступний лише в кількостях, достатніх для спектральних досліджень, але не хімічних. Одержати фулерен у помітних кількостях вдалося Д.Хаффману і В.Кретчмеру, що провели випарювання графіту за допомогою електричної дуги в атмосфері гелію. Чотиривалентність вуглецю у формулі фулерена повністю виконується. Правильніше зображувати фулерен у вигляді каркасу з простими короткими зв’язками, що чергуються, але частіше застосовують спрощене зображення, де каркас складається з однарних рисок. Ще одна незвичайна структурна особливість фулерену полягає в тому, що його молекула має внутрішню порожнину, діаметр якої приблизно 0,5 нм. Зовнішній діаметр самої молекули 0,71 нм. Фулерен – винятково стійка сполука. У кристалічному вигляді він не реагує з киснем повітря, стійкий до дії кислот і лугів, не плавиться до температури 3600С. 1.5 Вуглецеві нанотрубки Вуглецеві нанотрубки— протяжні циліндричні структури діаметром від одного до декількох десятків нанометрів і завдовжки до декількох мікрон складаються з однієї або декількох згорнутих в трубку гексагональних графітових площин (графенів) і закінчуються зазвичай півсферичною головкою. НАНОТРУБКИ ВУГЛЕЦЮ виявлені у 1991 р. Бувають одно- і багатошарові. Утворюються при розкладанні вуглецевовмісних газів (СН4, С2Н4, С2Н2, СО, парів С6Н6 і т.д.) на каталітично активних поверхнях металів (Fe, Co, Ni тощо) при т-рах 300 – 1500 °С. Нанотрубки можуть набувати найрізноманітніших форм – від прямолінійних до скручених волокон (у т.ч. спіралей). Головна особливість цих вуглецевих наноструктур (як і фулеренів) – їх каркасна форма. Якщо глобально оцінювати застосування нанотрубок, то можна впевнено стверджувати, що ми стали свідками початку ще однієї технічної революції. В наступні десять років будуть створені нанороботи-репліканти, на основі нанотрубок та інших наноматеріалів. Головною метою їх створення є побудова інших роботів та структур із атомарною якістю. Важко осягнути всі можливості такої перспективи. Ми зможемо, наприклад, перемогти практично всі інфекційні, хронічні, генетичні хвороби, досить буде мати індивідуальну програму керування для нанороботів та один наноробот-реплікант. Він розмножить себе до достатньої кількості і згідно програми буде на молекулярному рівні відшукувати збудника хвороби і переробляти його, наприклад, на глікоген. 2.Графен – одна з модифікацій Карбону
Лауреатами Нобелівської премії 2010 року по фізиці стали Костянтин Новосьолов і Андрій Гейм (випускники МФТІ, вчені з Манчестерського університету) за відкриття графену. Ця речовина може зробити революцію в індустрії електроніки й дозволить створювати легкі, міцніші від сталі, матеріали та надпотужні високочастотні електронні пристрої. Гейм заявив, що він "бачить паралелі із ситуацією, що склалася близько 100 років тому, коли були відкриті полімери. Пройшов якийсь час і полімери ввійшли в наше життя у вигляді пластмаси та стали відігравати важливу роль у житті людей". 2.1 Загальна характеристика Графен схожий за своєю будовою на окремий атомний шар у структурі графіту — атоми Карбону утворюють стільникову структуру з міжатомною віддаллю 142 нм. Без опори графен має тенденцію згортатися, але може бути стійким на підкладинці. Більше того, графен був отриманий також без підкладинки у вільному підвішеному стані, розтягнутий на опорах. Оскільки з моменту одержання графена пройшло не багато часу, його властивості поки вивчені не дуже добре. Але перші цікаві результати експериментів уже є. За своїми електронними властивостями графен відрізняється від тривимірного графіту. Його можна охарактеризувати якнапівметал, або ж як надпровідник. Для підвищення провідності у графен додають контрольовані домішки. Незважаючи на те, що графен моноатомний шар, він не зовсім прозорий, що й дає можливість бачити його. 2.2 Історія відкриття графена Одного разу Андрій Гейм і Костянтин Новосьолов зібралися в лабораторії, щоб з'ясувати, чи можна отримати одиночний шар графіту, і не просто отримати, а побачити його. Для цього вчені чиркали грифелем по підкладці, приклеювали скотч, акуратно його знімали разом з прилиплими шарами графіту і знову приклеювали на підкладинку з оксиду кремнію. Вважається, що саме вибір матеріалу підкладинки забезпечив успіх: при роздивлянні в оптичний мікроскоп оксид кремнію за рахунок інтерференції злегка змінює свій колір залежно від того, скільки шарів графіту на ньому знаходиться. І ось, після того, як смужка з одного-єдиного шару графіту була знайдена, до неї вдалося припаяти електроди й приступити до найголовнішого - вивченню незвичайних електричних властивостей цього матеріалу. 2.3 Властивості графена Дуже важливі такі властивості графена, як міцність, хімічна стійкість і прозорість. Вимірювання міцності з допомогою голки зондового мікроскопа показали, що з метрового листа можна зробити гамак, здатний витримати вагу кішки. При цьому сам гамак буде важити десяті частки міліграма. Про хімічну стійкість свідчить відсутність змін у властивостях графену при тривалому зберіганні на повітрі. А прозорість довго була перешкодою на шляху до відкриття графену. Надзвичайно цікаві властивості графенового бішару - двох шарів графена, розділених ізолятором. Прикладаючи до них різні напруги, можна в одному шарі створити електрони, а в іншому - дірки. Якщо товщина прошарку достатньо мала, то електрони з дірками створять пари подібно того, як це роблять електрони в надпровідному стані. Розрахунки показують, що температура подібного переходу в чистому графені наближається до кімнатної. Поки що гаряча надпровідність графена не відкрита, але теоретики надіються на те, що такий незвичайний ефект може існувати в цьому матеріалі. 2.4 Застосування графена Гейм із співробітниками запропонували так званий балістичний транзистор на базі графену. Графен відкриває перспективи створення транзисторів й інших напівпровідникових приладів з дуже малими габаритами (порядку декількох нанометрів). Графен можна уявити у вигляді «розгорнутої» вуглецевої нанотрубки. Підвищена мобільність електронів переводить його в розряд найперспективніших матеріалів для наноелектроніки. Графен у 200 разів міцніший від сталі. Тому його планують використати в різних композитних матеріалах, аби зробити їх міцнішими. Ту ж сталь можна покривати графеном. Досить одного нанометра, щоб металевий лист, завтовшки 1 міліметр, став значно міцнішим. Потенційні області застосування: заміна кремнію в транзисторах; датчики на основі графену можуть виявляти небезпечні молекули; використання графенової пудри в електричних акумуляторах, з метою збільшення їхньої ефективності; оптоелектроніка; міцніший і легший пластик; герметичні пластикові контейнери, які дозволять тижнями зберігати в них їжу, і вона буде залишатися свіжою; прозоре струмопровідне покриття для сонячних панелей та моніторів; міцніші вітряні двигуни; стійкіші до механічного впливу медичні імпланти; краще спортивне спорядження; суперконденсатори; покращення провідності матеріалів; надпотужні високочастотні електронні пристрої; штучні мембрани для розділення двох рідин у резервуарі; покращення сенсорних дисплеїв; графенові нанострічки дозволять створити балістичні транзистори. І це лише вершина айсберга можливостей застосування. Графен надає необмежені можливості практично у всіх областях індустрії та виробництва. Та згодом, він імовірно стане для нас звичайним матеріалом, подібно пластику в наші дні. |
Треба фізичні власт неметалівФізичні властивості алотропних форм Карбону
Властивості |
Графіт |
Алмаз |
Колір |
Темно – сірий |
Безбарвний |
Щільність, г/см3 |
2,26 |
3,5 |
Температура займання |
600-700 |
850 -1000 |
Твердість |
2 (уздовж шарів) 5 (упоперек) |
10 |
Температура плавлення |
3700 С |
Понад 3500 (у вакуумі) |
Температура алотропних переходів |
За 1500-3000 перетворюється на алмаз |
Вище 1000 перетворюється на графіт |
Блиск |
Металоподібний |
Специфічний«алмазний» |
Електропровідність |
Провідник |
Непровідник |
Загальні фізичні властивості неметалів.
За нормальних умов неметали водень Н2, фтор F2, хлор Cl2,кисень O2, озон О3, азот N2 та інертні гази (гелій He, неон Ne, аргон Ar, криптон Kr, ксенон Xe, радон Rn) пе ребувають у газоподібному агрегатному стані, бром Вr2 — рідина, а решта
неметалів — тверді речовини.Неметали відрізняються за кольором. Так, водень, кисень, азот — безбарвні гази; фтор — блідожовтий, а хлор —жовтозелений отруйний газ з різким специфічним запахом; бром — темночервона рідина, жовтобурі пари якої мають різкий, подразливий запах, а при потраплянні на шкіру викликають сильні опіки. Фосфор червоний — тверда речовина червоного кольору, фосфор білий — тверда речовина білого кольору.
Серед алотропних видозмін Фосфору найбільш поширені: білий фосфор(молекулярна будова кристалічної ґратки), червоний і чорний фосфор (атомна будова кристалічної ґратки). Усі вони — тверді речовини з кольором, зазначеним у назві. Змінюючи температуру, одну алотропну видозміну Фос фору можна за кілька годин перетворити на іншу.
Білий фосфор — безбарвна, з часниковим запахом, воскоподібна речовина, що світиться в темряві, дуже отруйна, самозаймається на повітрі при температурі +50 °С. Унаслідок високої хімічної активності його зберігають під водою і по можливості в темряві.
Червоний фосфор порівняно з білим стійкіший до нагрівання, без запаху, менш реакційно здатний і неотруйний. Його використовують у виробництві сірників (входить до складу намазки сірникової коробки). При швидкому проведенні головкою сірника по намазці фосфор окиснюється наявною в головці речовиною калій хлоратом KClO3. Від цього інша речовина головки — сірка — загорається й підпалює дерев’яну частину сірника.
Чорний фосфор має подібну з графітом будову і проводить електричний струм.
Природною алотропною видозміною Сульфуру є ромбічна сірка. Це лимонножовта, крихка, кристалічна речовина без запаху, нерозчинна у воді. Назва пов’язана з тим, що її кристали мають форму октаедра зі зрізаними кутами.
Взаємодія неметалів з металами:
Немета́ли — прості речовини, які не мають властивостей металів, а саме: металічного блиску, непридатні для кування, погано проводять тепло, електричний струм.
За електронною будовою зовнішнього енергетичного рівня атомів більшість неметалічних елементів є р-елементи, а Гідроген і Гелій — s-елементами. На зовнішньому енергетичному рівні мають від 3 до 8 електронів, крім гідрогену та гелію ( 1 та 2 електрони відповідно ). У хімічних реакціях атоми неметалів, як правило, приєднують електрони і перетворюються на негативно заряджені йони — аніони. Неметалічний характер елементів і хімічна активність неметалів посилюються в періодах зліва направо, а в головних підгрупах — знизу догори.
До неметалів зараховують 22 хімічних елементи: водень (гідроґен), азот, арсен, силіцій, кисень (оксиґен), флуор, хлор, інертні гази, бром, карбон, фосфор, сульфур, селен, йод, астат,телур, бор. Типові оксиди неметалів є ангідридами. Різкої межі між металами, металоїдами та неметалами немає.
Частина неметалів має атомну будову. Із окремих атомів складаються інертні гази — гелій, неон, аргон, криптон, ксенон і радон. У графіті, алмазі, силіції, борі, червоному фосфорі всі атоми сполучені один з одним. Водень, азот, кисень, фтор, хлор, бром, йод мають двохатомні молекули. Більшу кількість атомів містять молекули озону О3, білого фосфору Р4, сіркиS8, фулерену С60. Атоми в неметалах сполучені ковалентними неполярними зв'язками.
Застосування неметалів
Водень
виробництво амоніаку, хлоридної кислоти, метанолу, перетворення рідких жирів на тверді, зварювання та різання тугоплавких металів, відновлення металів з руд
Сірка
одержання сульфатної кислоти, виготовлення гуми з каучуку, виробництво сірників і чорного пороху, виготовлення лікарських препаратів
Бор
складова нейтронопоглинаючих матеріалів ядерних реакторів, захист поверхонь сталевих виробів від корозії, у напівпровідниковій техніці, виготовлення перетворювачів теплової енергії в електричну
Азот
газуватий — для виробництва амоніаку, створення інертного середовища при зварюванні металів, у вакуумних установках, електричних лампах; рідкий — як холодоагент у моро зильних установках, медицині
Фосфор
білий — для виробництва червоного фосфору; червоний — для виробництва сірників
Силіцій (кремній)
в електроніці й електротехніці для виготовлення схем, діодів, транзисторів, фотоелементів, виготовлення сплавів
Хлор
виробництво хлоридної кислоти, багатьох органічних розчинників, ліків, мономерів для виробництва пластмас, відбілювачів; як дезінфікуючий засіб
Вуглець
графіт — ливарне, металургій не, радiотехнiчне виробництво; виготовлення акумуляторів; адсорбція; у нафтогазодобувній промисловості для проведення бурових робіт; виготовлення антикорозійних покриттів; різних змазок, що зменшують силу тертя; алмаз — виготовлення інструментів для буріння й різання, абразивний матеріал, ювелірні прикраси.
Адсорбція — здатність одних речовин утримувати
на своїй поверхні частинки інших речовин.
^ Водневі сполуки неметалів Водневими сполуками називають бінарні сполуки Гідрогену з іншими хімічними елементами. Водневі сполуки неметалів можна розділити на такі групи: а) сполуки, що розчиняються в воді без гідролітичного розкладу; б) сполуки, що розкладаються водою; в) сполуки, які з водою не взаємодіють. Максимальна кількість атомів Гідрогену, які можуть входити в склад таких водневих сполук, визначається кількістю вакантних місць на зовнішньому енергетичному рівні неметалу. Таким чином, в водневих сполуках неметал проявляє властивий йому найнижчий негативний ступінь окиснення, наприклад:
NН3 |
Н2O |
HF |
PН3 |
Н2S |
HCl |
|
Н2Se |
HBr |
|
|
НІ |
Отже, кількість атомів Н в молекулах таких водневих сполук збільшується в періоді справа наліво. Електронна будова молекул водневих сполук другого періоду:
Н
Н |
Н |
|
Н |
метан |
аміак |
вода |
фторо-водень |
Атоми в молекулах зв’язані ковалентним полярним або слабо полярним (СН4, PН3) зв’язком. Полярність зв’язку в молекулах водневих сполук в періоді посилюється зліва направо, а в підгрупі – знизу вгору. Енергія зв’язку атомів в молекулі збільшується в тому ж напрямку. В цьому ж напрямку зростає і їх розчинність у воді. Розглянемо зміну кислотно-основних властивостей водневих сполук в періодах на прикладі сполук ІІ періоду: В молекулі метану всі валентності насичені атомами Гідрогену. Полярність зв’язку С–Н незначна. Тому метан – це міцна, стійка на повітрі сполука, не взаємодіє ні з кислотами, ні з основами, практично не розчиняється в воді. В аміаку полярність зв’язку N–Н більша, ніж зв’язку С–Н. Крім того, в Нітрогену є неподілена пара електронів. В зв’язку з цим при розчиненні аміаку в воді утворюється основа: NН3+Н2O NН4++OН–. Отже, вода по відношенню до аміаку виступає в ролі кислоти. Полярність зв’язку H–F більша, ніж N–Н. При розчиненні цієї речовини в воді утворюється кислота: HF+Н2O Н3O++F–. Вода по відношенню до фтороводню проявляє властивості основ. Здатність молекул води в залежності від умов проявляти властивості кислоти чи основи вказує на її подвійну, амфотерну природу. Таким чином, в періоді зліва направо посилюються кислотні і послаблюються оснóвні властивості водневих сполук. Розглянемо зміну кислотно-основних властивостей в групах на прикладах сполук V групи: Оснóвні властивості водневих сполук V групи послаблюються із збільшенням порядкового номеру елементу. Так, фосфін PН3, на відміну від аміаку, хоча й утворює донорно-акцепторний зв’язок із протоном, що призводить до утворення аналогічних аміаку солей фосфонію з багатьма кислотами, але їх міцність менша, ніж у сполук з іоном NН4+. Ця відмінність фосфіну від аміаку зумовлена значно більшим радіусом атому Фосфору в зрівнянні з атомом Нітрогену. Послаблення оснóвних властивостей рівносильне посиленню кислотних властивостей. В VІІ і VІ групах кислотні властивості водневих сполук p-елементів теж посилюються із збільшенням порядкового номеру елементу. а) До групи водневих сполук неметалів, що розчиняються у воді без гідролітичного розкладу відносяться сполуки, утворені неметалами, електронегативність яких більша, ніж у Н, наприклад H2F2, HCl, HBr, HI, H2O, H2S, H2Se, H2Te, H3N. Окрім H3N, всі вказані сполуки при взаємодії з H2O віддають Н+, наприклад: HCl + H2O = HClН2О Н3О++ Cl–, тоді як H3N відбирає Н+ у НОН: NH3+HOН = NH3НОН NH4++ОН–. Отже, водні розчини таких сполук є або кислотами, або основами. За звичайних умов ці сполуки є газами, окрім H2F2, H2O, H3N, які мають аномально високі температури плавлення та кипіння внаслідок утворення асоційованих молекул за рахунок водневого зв’язку. Відомі і водневі сполуки, в яких неметали проявляють не максимальний негативний ступінь окиснення: N2Н4 – гідразін, Н2О2 – пероксид гідрогену. В зв’язку з тим, що в водневих сполуках майже всі неметали проявляють негативну ступінь окиснення, ці сполуки виступають в окисно-відновних реакціях в ролі сильних відновників. Наприклад: 4HCl+MnO2 MnCl2+Cl2+2H2O 4NH3+3O2 2N2+6H2O 2H2S+SO2 3S+2H2O Відновні властивості посилюються в групах із збільшенням порядкового номеру елементу, а в періодах вони слабшають зліва направо. В якості окисників водневі сполуки неметалів можуть виступати за рахунок наявності в молекулах атому Н в ступені окиснення +1: 2HCl+Zn ZnCl2+H2 2H2O+2Na 2NaOH+H2 Водневі сполуки неметалів можуть вступати і в реакції, які протікають без зміни ступеня окиснення. Наприклад: CuSO4+5H2O CuSO4·5H2O HCl+NH3 NH4Cl K2O+H2O 2KOH Окремі представники: HF – рідина (tкип.= 19,9оС) з різким характерним запахом, з водою змішується в любих співвідношеннях (розчин називають плавиковою кислотою) HCl – безбарвний газ (з.у.) з характерним різким задушливим запахом, добре розчиняється у воді (1:500), утворюючи розчин соляної кислоти (максим.конц.–38%) HBr – безбарвний газ (з.у.) з різким запахом, добре розчиняється у воді (1:500) НІ – безбарвний газ (з.у.) з різким запахом, добре розчиняється у воді (1:500) H2S – безбарвний газ (з.у.) з запахом тухлих яєць, отруйний: сильний відновник, погано розчиняється у воді (1:2,5), розчин називають сірководневою водою NH3 – безбарвний газ з різким характерним запахом, добре розчиняється в воді (1:700); розчин називають аміачною водою або нашатирним спиртом (максим.конц. 25%); при розчиненні у воді утворюється гідроксид амонію NH4ОН (NH4+ – амоній-іон), який проявляє властивості слабої основи б) До водневих сполук неметалів, що розкладаються водою, відносять сполуки Бору та Силіцію. Оскільки ці елементи мають менше значення електронегативності, ніж Н, то в своїх водневих сполуках вони проявляють позитивний ступінь окиснення, тоді як Н – негативний (–1). Відомо багато сполук Бору з Гідрогеном (наприклад, В2Н6, В4Н10, В5Н9, В6Н10, В10Н14, В20Н16), вони дістали загальну назву борани. Наявність Н, який має ступінь окиснення –1 зумовлює той факт, що борани є надзвичайно сильними відновниками. Так, борани:
окислюються киснем повітря (окремі з них самозапалюються);
окислюються галогенами: В2Н6+Cl2 2ВCl3+6НCl;
розкладаються водою з виділенням Н2: В2Н6+6H2O 2Н3ВО3+6Н2;
В4Н10+12H2O 4Н3ВО3+11Н2;
частково відновлюються лугами: В2Н6+2КОН 2КОВН3+Н2;
В4Н10+4КОН 4КОВН3+Н2; Борани утворюють продукти приєднання з аміаком: В2Н6+2NH3 В2Н62NH3 Всі борани одержують тільки непрямим шляхом, головним чином із боридів металів: 4Mg2B+16HCl B4H10+8MgCl2+3H2 Аналогічно сполуки Силіцію з Гідрогеном дістали назву силани. Загальна формула силанів SinH2n+2, де n приймає значення від 1 до 6. Хімічні властивості силанів аналогічні боранам. Так, вони можуть самозапалюватися на повітрі; розкладатися водою з виділенням водню і утворенням відповідної кислоти; показовою є реакція галогенування силанів галогеноводнями (а не галогенами, як вуглеводнів): Si2H6+2HBr Si2H4Br2+2H2. в) До водневих сполук неметалів, що не взаємодіють з водою, відносяться сполуки Н з С (вуглеводні) та Р (фосфіни). Вуглеводнів відомо дуже багато (їх властивості вивчає органічна хімія), тоді як фосфінів – декілька: РН3, Р2Н4, Р12Н6. Фосфін РН3 – газ, дуже погано розчинний у воді. Утворює нестійкі сполуки приєднання з галогеноводнями. Одержують гідролізом фосфідів металів: Са3Р2+НОН Са(ОН)2+РН3. Оксиди Електронегативність всіх неметалів, окрім Флуору, менша, ніж у Оксигену. Це означає, що в сполуках з Оксигеном неметали мають позитивний ступінь окиснення, а Оксиген – негативний; зв'язок між Оксигеном і неметалом – ковалентний полярний. У сполуці з Флуором OF2 Оксиген проявляє позитивну ступінь окиснення і її можна розглядати як фторид оксигену. Сполуки елементу з Оксигеном, ступінь окиснення якого –2, відносять до класу оксидів. Молекули оксидів побудовані так, що в них наявні зв'язки тільки між елементом та Оксигеном. Сполуки елементів з Оксигеном, у молекулах яких між двома атомами Оксигену є зв’язок, називають пероксидами (Н2О2– пероксид гідрогену (Н–О–О–Н). Назви оксидів складають з двох слів: оксид+назва елементу в родовому відмінку. Відомі оксиди, в яких неметал проявляє властивий йому вищий ступінь окиснення (наприклад, В2О3, СО2, N2O5, SO3, Cl2O7), а також нижчі (наприклад, СО, N2O, NO, N2O3, NO2, СlO2). Якщо елемент утворює декілька оксидів, то після назви елемента вказують його ступінь окиснення (римською цифрою в дужках): оксид сульфуру(ІV) – SO2, оксид сульфуру(VI) – SO3. Окремі оксиди мають і тривіальні назви: СО – чадний газ, СО2 – вуглекислий газ, SiO2 – пісок, N2O – веселящий газ. За хімічними властивостями оксиди поділяють на солетворні та несолетворні. Несолетворними називають оксиди, які не взаємодіють з водою і не утворюють солей, їх є небагато: СО, SiO, N2O, NO. Оксиди, що під час хімічних реакцій утворюють солі, є солетворними. До них належить більшість оксидів. Оксиди неметалів при взаємодії з водою утворюють відповідні кислоти, тому їх відносять до кислотних оксидів, а також називають ангідридами відповідних кислот. Властивості оксидів неметалів Різні кислотні оксиди за звичайних умов мають неоднаковий агрегатний стан. Це можуть бути тверді речовини (В2О3, SiO2, Р2О5,), рідкі (N2О5, SO3, Cl2O7) і газоподібні (всі інші). Кислотні оксиди проявляють певні загальні (тобто властиві всім) хімічні властивості, а саме:
вступають в реакцію сполучення з водою з утворенням відповідних кислот (в окремих випадках –двох кислот);
вступають в реакцію сполучення з оксидами металів з утворенням солей відповідних кислот;
вступають в реакцію обмінної взаємодії з розчинами лугів з утворенням солі відповідної кислоти і води (сплавлення твердих кислотних оксидів з основами).
Окрім загальних властивостей, окремі оксиди можуть проявляти й інші (властиві тільки даному оксиду) властивості. Так, наприклад, тверді оксиди при сплавленні їх з карбонатами здатні замістити СО2 і утворити відповідні солі; кислотні оксиди, яким відповідають багатоосновні кислоти, можуть взаємодіяти з розчинами середніх солей цієї ж кислоти з утворенням кислих солей; якщо неметал утворює декілька оксидів, то ці оксиди можуть вступати у реакції окислення-відновлення. Нижче наведено приклади рівнянь реакцій оксидів та коротка характеристика оксидів.
Оксид |
Деякі властивості оксиду |
Коротка характеристика оксиду |
|
Cl 2O+ H2O 2HClO |
Ангідрид хлорнуватистої кислоти. |
|
2ClO2+ H2O HClO2+HClO3 |
Ангідрид хлористої кислоти. Нестійкий. |
|
2ClO3+ H2O HClO3+HClO4 |
Ангідрид хлорнуватої кислоти. Нестійкий |
|
Cl 2O7+ H2O 2НClО4 |
Ангідрид хлорної кислоти. Безбарвна рідина. |
|
Br2O+ H2O 2HBrO |
|
|
І 2O5+ H2O 2HІO3 |
|
|
SО2+
H2O
Н2SО3
SО2+Na2O
Na2SО3
SО2+2NaOH
Na2SО3+H2O
Проявляє
властивості і окисника, і відновника:
SO2+O2 |
Ангідрид сірчистої кислоти. Безбарвний газ з різким задушливим запахом, розчиняється у воді (1:40) з утворенням |
|
SО3+ H2O Н2SО4 SО3+Na2O Na2SО4 SО3+2NaOH Na2SО4+H2O |
Ангідрид сірчаної кислоти. Безбарвна рідина в інтервалі температур 17–45оС, дуже гігроскопічна, добре розчиняється в концентровані сірчаній кислоті, утворюючи так званий олеум |
|
несолетворний оксид; нестійкий: 2N2O 2N2+O2 |
Газ без кольору в запаху, погано розчиняється у воді (1:1,3); збуджуюче діє на нервову систему і притупляє больові відчуття, тому використовується як наркотичний засіб |
|
несолетворний
оксид;
приєднує О2 (з
повітря) та Cl2:
2NO+O2 2NO2;
2NO+Cl2 2NOCl
NO+NO2 |
Безбарвний газ, слабо розчинний у воді (1:0,08) |
|
N2О3+ H2O 2НNО2 N2О3+ 2NaOH 2NaNО2+H2O |
Ангідрид азотистої кислоти. Рідина темно-синього кольору, що кипить при 3,5оС |
|
2NО2+ H2O НNО2+НNО3, а утворена розкладається: 3НNО2НNО3+2NO+Н2О 2NО2+2NaOHNaNО2+NaNО3+H2O NO+NO2 N2O3 |
Бурий газ з характерним різким запахом, здатний в міру охолодження утворювати димери: 2NО2 N2О4 |
|
N2О5+
H2O
2НNО3
N2О5+
2NaOH 2NaNО3+H2O
2N2О5 |
Ангідрид азотної кислоти. Тверда кристалічна речовина. |
|
Р2О3+ 3H2O 2Н3РО3 |
Ангідрид фосфористої кислоти. Біла кристалічна речовина, (плавиться при 23,8о)С |
|
P2O5+3H2O
2H3PO4
P2O5+
H2O
2HPO3
P2O5+CaO
Ca(PO3)2
P2O5+3Ca(OH)2Ca3(PO4)2+3H2O
2NaHCO3+P2O5 |
Ангідрид мета-, орто- та пірофосфорної кислоти. Білий порошок, дуже гігроскопічний, віднімає навіть воду, що входить до складу хімічних сполук. При взаємодії з водою може утворювати три кислоти: |
|
2СО+О2
2СО2
FeO+CO
Fe+CO2
CO+Cl2 |
Отруйний газ без кольору і запаху (тривіальна назва – чадний газ). Малорозчинний у воді. Несолетворний. Сильний відновник. |
|
СО2+ H2O Н2СО3 СО2+Ca(OH)2 CaCO3+H2O CO2+2MgO 2MgO+C CO2+2Mg 2MgO+C CO2+C 2CO CaCO3+H2O+CO2 Ca(НCO3)2 процес фотосинтезу: 6nСО2+6nН2О (С6Н10О5)n+6Н2О+6О2 |
Ангідрид вугільної кислоти. Безбарвний газ (тривіальна назва – вуглекислий газ), малорозчинний у воді, не підтримує дихання і горіння. |
|
SiO2+ H2O ⇏(не взаємодіє) SiO2+ 2NaOH Na2SiO3+H2O SiO2+ Na2CO3 Na2SiO3+CO2 SiO2+4HF SiF4+2H2O |
Ангідрид кремнієвої кислоти. Тверда кристалічна речовина (пісок), нерозчинна в воді. |
|
3В2О3+2Na3PO4 P2O5+6NaBO2 |
Ангідрид борної кислоти. Біла кристалічна або склоподібна речовина |
В періодах кислотні властивості вищих оксидів зростають зліва направо, а в групах – знизу вгору.
Солі амонію(амоніяк) - це кристалічні речовини з іонним типом зв'язку. До складу солей амонію входять один або кілька катіонів і аніон кислотного залишку.
Солі амонію утворюються при взаємодії відповідних кислот з амоніаком або розчином гідроксиду амонію. Більшість солей амонію безбарвні. При взаємодії з сильними основами і нагріванні солі амонію легко розкладаються з утворенням амоніаку. В термічному відношенні солі амонію нестійкі і при нагріванні порівняно легко розкладаються, наприклад:
NH4Cl = NH3 + HCl
NH4NO2 = N2 + 2H2O
NH4NO3 = N2O + 2H2O
(NH4)2SO4 = 2NH3 + H2SO4
Найважливішими солями амонію є нітрат амонію NH4NO3, сульфат амонію (NH4)2SO4 і хлорид амонію NH4Cl. Вони застосовуються головним чином як азотні добрива. Гідрокарбонат амонію NH4HCO3 (вуглеамонійна сіль, побутова назва амоняк, індекс E 503) використовують як розпушувач тіста.
Для амоніаку характерні реакції приєднання і окислення. 1.Взаємодіє з водою і утворює гідрати NH3.H2O, 2NH3.Н2: NH3+H2O=NH4OH. Лужна реакція розчину амоніаку наявністю . Водний розчин NH3 - амоній гідроксид (слабка основа). Фенолфталеїн - малинове забарвлення, розчин NH3 10% нашатирний спирт. 2. Взаємодія з кислотами .Утворюються солі амонію: NH3+HCl=NH4Cl; 2NH3+H2SO4=(NH4)2SO4 3.Відновні властивості (при нагріванні). а) згорає у кисні: 4NH3+3О2=2N2+6Н2О; б)каталітичне окислення: 4NH3+5О2=4NО+6Н2О; в)реагує з окислювачами: 4H3N +3Br2=6НBr+3N2; 2NH3+3CuO=3Cu+N2+3H2O. 3.Солі амонію. Солі амонію складаються з катіона амонію та аніана кислоти. Солі амонію добувають при взаємодії амоніаку або амоній гідроксид з кислотами: NH3+NHО3=NH4NО3; 2NH3+H2SO4=(NH4)2SO4; NH4OH+HNO3=NH4NO3+H2O. У катіоні NH є чотири ковалентні зв'язки: донор акцептор Солі амонію виявляють загальні властивості солей: 1) взаємодіють з лугами: NH4Cl+NaOH=NaCl+NH4OH (NH3 +H2O) 2) взаємодіють з кислотами: 2NH4Cl+H3SO4=(NH4)2SO4+2HCl 3) взаємодіють із солями: (NH4)2SO4+BaCl2=2NH4Cl+BaSO4 Всі амонійні солі добре розчиняютьсяу воді. У водних розчинах солі добре гідролізують. NH +H2O=NH4OН+H+ Якісна реакція на NH 1) взаємодія з лугами: NH +ОН-=NH3 +H2O Реакцію проводять: у пробірку з сіллю або розчином, що аналізують, вводить розчин лугу і суміш обережно нагрівають. При наявності NH виділяється амоніак. Добування амоніаку в промисловості. У промисловості амоніак синтезують з простих речовин Н2 і N2. Реакція азоту з воднем екзотермічна, вона відбувається із виділенням теплоти. Тому для зміщення рівноваги в оборотній системі слід зменшувати температуру. Таке зменшення допускається до 450оС, при нижчій температурі швидкість реакції дуже мала. Рівновага в системі зміщується в бік утворення амоніаку при підвищенні тиску, тому процес проводять при тиску 30Мпа. Для збільшення швидкості реакції у виробництві амоніаку використовують каталізатори - залізо з добавками алюміній і калій оксидів. Суміш азоту і водню за допомогою компресора стискується до необхідного тиску. Потім вона очищується, проходячи у контактний апарат, де знаходиться каталізатор. З контактного апарату виходить газова суміш, газів N2 і Н2, що не прореагували. Амоніак легко виділяється з суміші: він зріджується значно легше ніж азот і водень, що не прореагували. Рідкий амоніак добувають у холодильнику і збирають у збірнику. 1 - компресор; 2 - фільтр; 3 - контактний апарат; 4 - холодильник; 5 - збірник. Застосування. Значну частину NH3 переробляють на НNO3 і її солі. Амоніак застосують у виробництві соди. Рідкий амоніак, його водний розчин, солі амонію (NH4 NO3, (NH4)2 НРО4, NH4PO4 (NH4)2SO4) використовують як азотні добрива. Рідкий амоніак застосовують як розчинник: у ньому може бути розчинено багато речовин, у тому числі деякі Ме (Na, K). Водневу сполуку азоту N2H4 (гідразин) використовують у хімічних джерелах електричного струму (відновник). Водний розчин амоніаку (10%) - нашатирний спирт - застосовують у медицині. Отже, якісною реакцією на солі амонію є дія лугів при нагризанні з виділенням аміаку, який виявляють за запахом або посинінням червоного вологого лакмусового папірця.
Хлоридна або соляна кислота — розчин хлороводню (HCl) у воді.
Хлоридна кислота є типовою кислотою. За своєю хімічною активністю вона належить до найсильніших кислот. Подібно до інших сильних кислот вона активно розчиняє більшість металів з виділенням водню, взаємодіє з оксидами металів тощо.
Концентрована хлоридна кислота містить 37% HCl і має густину 1,19 г/см3. Вона має різкий запах і «димить» на повітрі внаслідок виділення газоподібного хлороводню. Технічна кислота має жовтий колір, який обумовлюється домішками головним чином солей заліза.
Хлоридна кислота широко використовується в народному господарстві. Найбільше застосовується вона у хімічній промисловості для добування різних солей: хлориду цинку, хлориду барію та ін., а також для виробництва барвників, лікувальних речовин тощо. Багато хлоридної кислоти споживає також металургійна промисловість для виділення кольорових і рідкісних металів з їх природних сумішей. У хімічних лабораторіях хлоридна кислота належить до найуживаніших реактивів. У невеликих кількостях з неї також одержують водень і хлор.
Треба власт хлор к ти
Якісна реакція на хлорид-іон.
Щоб зрозуміти, який з продуктів реакції випадає в осад, напишемо молекулярні та йонні рівняння проведених реакцій обміну:
НCl + AgNO3 = AgCl + НNO3
H+ + Cl– + Ag+ + NO3- = AgCl + H+ + NO3-
Ag+ + Cl– = AgCl
СaCl2 + 2AgNO3 = 2AgCl + Сa(NO3)2
Сa + 2Cl– + 2Ag+ + 2 NO3- = 2AgCl + Сa2+ + 2 NO3-
Ag+ + Cl– = AgCl .
Якісною реакцією на хлорид%іони (хлоридну кислоту та її солі) є взаємодія з розчином аргентум(І) нітрату. Реакція супроводжується випаданням сирнисто_білого осаду нерозчинної у воді та в сильних кислотах солі аргентум(І) хлориду AgCl. Скорочене йонне рівняння якісної реакції таке:
Ag+ + Cl– = AgCl
Сульфур утворює два кислотні оксиди: оксид сульфуру (ІV) S02і оксид сульфуру(VI) S03. Різний кількісний склад молекул (і різна їхня будова) зумовлюють відмінні властивості цих речовин.
Оксид сульфуру(IV) SO2(діоксид сульфуру, сірчистий газ) — це безбарвний важкий газ (у 2,2 раза важчий за повітря), з різким запахом, що викликає кашель. Негорючий. Дуже легко розчиняється у воді (в 1 л води при 20 °С Розчиняється 43 л S02). Поряд з «фізичним» розчиненням одночасно відбувається хімічна взаємодія невеликої частини молекул оксиду сульфуру(ІV) S02 з водою, внаслідок чого утворюється сульфітна кислота:
S02 + Н20 ⇔ H2S03
Сульфітна кислота H2S03 — дуже нетривка сполука. Існує тільки у водних розчинах. За спроб виділити її розкладається на оксид сульфуру(ІV) і воду. Легко поглинає з повітря кисень і повільно окиснюється у сульфатну кислоту:
2H2S03 + 02 = 2H2S04
Сульфітна кислота H2S03 двохосновна. Належить до кислот середньої сили. У водному розчині дисоціює ступіні часто, в основному за першим ступенем:
I ступінь H2SO3 ⇔H+ + HSO3-
гідросульфіт-іон
ІІ ступінь HSO3- ⇔H+ + SO2-3
сульфіт-іон
За другим ступенем дисоціація відбувається незначною мірою.
Як двохосновна сульфітна кислота H2SO3 може утворювати два ряди солей: а) середні солі — сульфіти і б) кислі солі — гідросульфіти (продукти неповного заміщення Гідрогену кислоти на метал).
NaOH + SO2 = NaHSO3
1 моль 1 моль гідросульфіт натрію
2NaOH + SO2 = Na2SO3 + H2O
2 моль 1моль сульфіт натрію
Це слід брати до уваги під час виконання дослідів та розвязування задач.
Усі сульфіти — нерозчинні солі, за винятком сульфітів лужних металів і амонію.
Добування
Оксид сульфуру (IV) добувають спалюванням сірки, a також як побічний продукт випалювання сульфідних руд кольорових металів, наприклад:
S + O2 = SO2↑
2Pb + 3O2 = 2PbO + 2SO2↑
У лабораторних умовах оксид сульфуру (IV) добувають дією кислот на сульфіти. При цьому замість нетривкої сульфітної кислоти виділяється оксид сульфуру(IV):
Na2S03 + H2S04 = Na2S04 + H2S03 ↓ ↓ H2O SO2↑
Застосування
Найважливіша галузь застосування оксиду сульфуру (IV) S02 — це виробництво сульфатної кислоти H2S04. Його використовують також у виробництві сульфітів і гідросульфітів. Сірчистий газ S02 здатний знищуватимікроорганізми і шкідників сільськогосподарських культур, тому його використовують для обкурювання овочесховищ і з метою перевезення ягід і фруктів. Сірчистий газ знебарвлює багато природних фарб, тому з його допомогою вибілюють солому, шовк, вовну та інші матеріали. Застосовують його також для консервування фруктів і ягід та як дезінфікувальний засіб (для знищення плісені у підвалах, льохах, винних бочках, бродильних чанах).
Фізіологічна дія
Оксид сульфуру (IV) S02 токсичний. Невелика концентрація його у повітрі викликає подразнення слизових оболонок дихальних органів і очей. Тривала дія навіть малих концентрацій оксиду сульфуру (IV) призводить до виникнення у людини бронхіту, гастриту та інших хвороб у тому числі, можливо, й раку легенів. Оксид сульфуру (IV) S02 вважається найнебезпечнішим для здоров'я людини, оскільки викликає загальне ослаблення організму і у поєднанні з іншими забрудниками спричинює скорочення середньої тривалості життя.
Вплив на навколишнє середовище
Діоксид сульфуру S02 один з основних забрудників повітря, він отруює навколишнє середовище.
Звідки ж береться діоксид сульфуру S02 у повітрі?
Природним джерелом S02 є окиснення сірководню H2S атмосферним киснем й озоном:
2H2S + 302 = 2SO2 + H2O H2S + O3 = SO2 + Н20
Основними антропогенними джерелами діоксиду сульфуру S02 є спалювання палива, виплавляння металів (димові гази), робота автомобільного транспорту (вихлопні гази).
Діоксид сульфуру S02, потрапляючи у повітря, викликає утворення «кислотних дощів», шкідливих для усього живого.
Як же утворюються «кислотні дощі»?
В атмосфері діоксид сульфуру S02 під впливом незначних кількостей розпорошених металів та їхніх солей (в основному Fe і Мп) окиснюється до триоксиду сульфуру S03:
2S02 + О2 ⇔ 2SO3,
який взаємодіє з краплинами вологи, утворюючи сторонню для повітря речовину — сульфатну кислоту:
SO3 + H2O = H2S04
Аналогічним чином роблять свій «внесок» у появу «кислотних дощів» й оксиди нітрогену:
2NO + 02 = 2N02
2N02 + Н20 = HN03 + HNО2
Кислотні опади (дощ, град, сніг тощо) негативно впливають на водні екосистеми, на ріст дерев та сільсько-господарських культур. Вплив кислотних опадів на живі організми, у тому числі на людину, ще недостатньо вивчений. Проте відомо, що в умовах забруднення атмосфери (димовими газами, що утворюються у процесі спалювання палива, або відхідними газами переробки сульфуровмісноі сировини чи викидами металургійних підприємств) не слід ходити під дощем з непокритою головою (це може стати причиною випадання волосся).
Оксид сульфуру (VІ) S03(триоксид сульфуру) — безбарвна рідина, яка за температури, нижчої від 17 °С, кристалізується, перетворюючись на довгі шовковисті кристали. Дуже летка речовина, сильний окисник. Токсичний, уражує слизові оболонки й дихальні шляхи, викликає тяжкі опіки шкіри, енергійно руйнує органічні сполуки. Зберігають його у запаяних скляних посудинах. Оксид сульфуру (VІ) на повітрі димить, бурхливо взаємодіє з водою з виділенням великої кількості теплоти, утворюючи сульфатну кислоту:
S03 + Н20 = H2S04
Він може навіть вбирати вологу з повітря, утворюючи білий туман, що складається з найдрібніших краплинок сульфатної кислоти.
Оксид сульфуру(VI) розчиняється у концентрованій cульфатній кислоті H2S04, і цей розчин називаєтьсяолеумом.
Знаючи, що S03 — типовий кислотний оксид, напишіть рівняння реакцій, характерних для нього.
Добувають оксид сульфуру(VI) у результаті окиснення S02 киснем повітря (напишіть рівняння реакції).
За звичайних умов ця реакція відбувається дуже повільно. Значно швидше і легше вона відбувається за температури 450—600 °С і за наявності каталізатора оксиду ванадію(V) V205.
Застосовується оксид сульфуру(VI) S03 у виробництві сульфатної кислоти H2S04. У лабораторній практиці він використовується як водовбирний засіб.
Нітроген з оксигеном утворює п'ять оксидів, в яких він виявляє ступінь окиснення від +1 до +5:
+1 +2 +3 +4 +5
N20, NO, N203, N02, N2O5
Різний кількісний склад оксидів нітрогену (і різна їхня будова) зумовлює відмінність їхніх властивостей.
Усі оксиди нітрогену дуже отруйні, за винятком N20.
Серед них розглянемо оксид нітрогену (ІІ) NO та оксид нітрогену (IV) N02.
Оксид нітрогену (ІІ) NO — безбарвний газ, без запаху, у воді не розчиняється. Належить до несолетвірних оксидів. На повітрі легко окиснюється, перетворюючись на бурий газ — діоксид нітрогену, або оксид нїтрогену (IV) N02: 2NO + 02 = 2N02
Оксид нітрогену (IV) N02 — бурий газ із характерним апахом. Належить до солетвірних (кислотних) оксидів. Добре розчиняється у воді, бо реагує з нею, утворюючи суміш двох кислот — нітратної і нітритної:
2N02 + Н20 = HN03 + HN02
За наявності надлишку кисню у воді утворюється тільки нітратна кислота:
4N02 + 2Н20 + 02 = 4HN03
Бурий газ N02 отруйний, подразнює слизові оболонки очей і дихальних шляхів. Він є шкідливим відходом хімічного виробництва. У вигляді «лисячого хвоста» бурий газ викидається в атмосферу заводами, що виробляють нітратну кислоту, і є шкідливим для всього живого.
Тепер знайдено ряд хімічних способів боротьби з «лисячими хвостами» й захисту навколишнього середовища. Наприклад, оксид нітрогену(IV), що міститься у відхідних газах, розкладається за допомогою каталізатора (паладований оксид алюмінію) на азот і кисень:
АІ2О3, Pd
2N02 -------> N2 + 202
Такий спосіб боротьби із забрудненням атмосфери застосовують нині на багатьох сучасних підприємствах.
Оксид нітрогену (І) N20 — безбарвний газ із приємним запахом, залежить до несолетвірних оксидів. Під назвою «веселильний газ» N20 у суміші з киснем використовується в медицині для наркозу. Не отруйний. Оксид нітрогену(ІІІ) N203 — нестійка темно-синя рідина за низьких теператур, солетвірний (кислотний) оксид, розчиняючись у воді, утворює нітритну кислоту:
N2О3 + Н2О = 2HN02
Нітритна кислота є слабкою одноосновною кислотою. Її солі — нітри-(наприклад, NaN02 — нітрит натрію) отруйні.
Оксид нітрогену(V) N205 — білі кристали, також солетвірний (киcлотний) оксид, реагує з водою, утворюючи нітратну кислоту:
N205 + H2О = 2HN03
Нітратна кислота являє собою сильну одноосновну кислоту. Її солі — нітрати (наприклад, NaN03 — нітрат натрію) також отруйні.
З оксидів фосфору (Р205 і Р203) найбільше значення має оксид фосфору(V).
Оксид фосфору (V) Р205 — білий дрібнокристалічний порошок, дуже гігроскопічний, тому застосовується для осушування газів. Типовий кислотний оксид. Енергійно реагує з водою, утворюючи різні фосфатні кислоти, залежно від співвідношення і температури води:
Р205 + Н20 = 2НР03
холодна метафосфатна кислота
Р205 + ЗН20 = 2Н3Р04
гаряча ортофосфатна кислота
HPO3 — найпростіша формула, якою умовно виражають склад метафосфатних кислот — із загальною формулою (НР03)n. У даному разі під час взаємодії оксиду фосфору (V) з холодною водою утворюється тетраме-тафосфатна кислота:
2Р205 + 2Н20 = (НР03)4
Оксид фосфору(V) і оксид нітрогену(V) — типові кислотні оксиди. Напишіть рівняння їх взаємодії з типовими основними оксидами і лугами. ЕЛЕМЕНТ КАРБОН З ЕЛЕМЕНТОМ ОКСИГЕНОМ утворює два оксиди — С02 і СО.
С02 — оксид карбону(IV), діоксид карбону, вуглекислий газ;
СО — оксид карбону(II), монооксид карбону, чадний газ.
Для елемента Силіцію характерним є SiO2 —оксид силіцію(IV), діоксид силіцію, кремнезем.
Фізичні властивості
Оксид карбону(IV), або вуглекислий газ, С02 за звичайних умов — безбарвний газ, без запаху, важчий за повітря в 1,5 раза, доволі добре розчиняється у воді, особливо під тиском, легко перетворюється на рідину навіть за кімнатної температури і невеликого тиску (5 МПа). Зріджений С02 зберігають у стальних балонах. Якщо його швидко вилити з балона, вуглекислий газ випаровується, внаслідок чого частина газу перетворюється на снігоподібну масу. Твердий вуглекислий газ називають сухим льодом.
Оксид карбону СО, або чадний газ, — безбарвний, без запаху, погано розчиняється у воді, важко перетворюється на рідину (за нормального тиску і температури -191,5 °С), трохи легший за повітря.
Обчисліть відносні молекулярні маси вуглекислого та чадного газів і порівняйте їх з усередненою відносною молекулярною масою повітря, яка дорівнює 29. Чи залежить густина газу від його молекулярної маси?
Вуглекислий газ С02 у великих кількостях шкідливий для людіни і тварин, спричинює запаморочення, може викликати ядуху, тому приміщення, де перебувають люди, треба часто провітрювати.
Чадний газ СО — дуже отруйний. Він утворює стійку сполуку з гемоглобіном крові, внаслідок чого кров втрачає властивість переносити кисень в організмі, і настає кисневе голодування. У людини з'являються сильний головний біль, нудота, вона може знепритомніти і навіть померти!
Особливо небезпечно заводити автомобіль у гаражі за зачиненими дверима... Це рівнозначно самогубству! Заслінку в печі можна закривати тільки тоді, коли вугілля вже не горить полум'ям, а лише слабко жевріє...
Оксид силіцію(ІV) SiO2, або діоксид силіцію, — тверда речовина, кристалічна, безбарвна, тугоплавка (tпл. 1728 °С), у воді не розчиняється (пригадайте білий річковий пісок).
Чому ж така велика відмінність у властивостях діоксиду силіцію SiO2 і діоксиду карбону С02 (за звичайних умов С02 — газ, а Sі02 — тверда тугоплавка речовина), адже за хімічним складом ці оксиди є аналогами?
Щоб зрозуміти причину відмінності їхніх властивостей, пригадайте, що властивості речовини залежать від її будови. Отже, причина відмінності властивостей оксиду карбону (IV) і оксиду силіцію (IV) полягає у відмінності будови цих речовин. Оксид карбону (IV) складається з молекул С02, тобто має молекулярні кристалічні ґратки, а оксид силіцію (IV) — атомні кристалічні ґратки, кожна структурна одиниця яких являє собою тетраедр з атомом Силіцію в центрі та атомами Оксигену по кутах. Це можна пояснити тим, що атом Силіцію має більший радіус, ніж атом Карбону. Навколо нього може розміститись не два, а чотири атоми Оксигену, кожний з яких з'єднується з двома атомами Силіцію. Відповідне розміщення атомів можна зобразити на площині схемою:
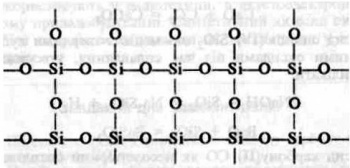
Така будова оксиду силіцію (IV) й обумовлює його високу твердість і тугоплавкість.
Отже, відмінністю у будові кристалічних ґраток пояснюється відмінність властивостей діоксидів карбону й силіцію.
Хімічні властивості
Оксид карбону (ІV) С02 і оксид силіцію (ІV) Sі02 — солетвірні кислотні оксиди, а оксид карбону (ІІ) СО — несолетвірний оксид.
1. Взаємодія з водою. Якщо у пробірку з водою (1 — 2 мл) додати 1—2 краплі розчину лакмусу, а потім пустити туди вуглекислий газ, лакмус змінить своє забарвлення, і розчин почервоніє. Це пояснюється тим, що С02 взаємодіє з водою з утворенням нестійкої карбонатної кислоти:
H2O + CO2 ⇔ H2CO3
Знаючи закономірності зміщення хімічної рівноваги, зазначте, в якому напрямі можна змістити рівновагу в реакції, рівняння якої наведено вище:
а) підвищуючи тиск; б) підвищуючи температуру.
Оксид силіцію (IV) SiO2 хоча й належить до кислотних оксидів, але з водою не реагує. Відповідна йому силікатна кислота H2Si03 утворюється іншим шляхом (вивчатиметься пізніше).
2. Взаємодія з основами і основними оксидами. Оксид карбону (IV) С02 реагує з лугами у водних розчинах та з твердими лугами і основними оксидами за звичайних умов, утворюючи солі — карбонати:
Са(ОН)2 + С02 - СаС03↓ + Н20
СаО + С02 = СаС03
Оксид силіцію (IV) Si02 взаємодіє з твердими лугами та основними оксидами під час сплавляння, утворюючи солі — силікати:
2NaOH + Si02 = Na2Si03 + Н20
BaO + Si02 = BaSi03
Оксид карбону(ІІ) CO як несолетвірний оксид зазначених вище реакцій не дає (солей не утворює). Йому притаманні інші властивості:
а) здатність горіти васильково-синім полум'ям, виділяючи велику кількість теплоти:
2СО + О = 2С02, ΔH = -572 кДж,
через що його використовують (разом з іншими газами) як газувате паливо (у доменному виробництві); б) здатність відновлювати метали з оксидів (під час нагрівання):
Fe304 + 4СО = 3Fe + 4С02↑
Зазначена властивість використовується під час виплавляння металів із руд.
Добування оксиду карбону(ІУ). У лабораторних умовах С02 добувають дією хлоридної кислоти на мармур:
СаС03 + 2НСl = СаСl2 + Н20 + С02↑
Запишіть рівняння даної реакції у повній і скороченій йонних формах.
У промисловості оксид карбону(ІV) добувають прожарюванням вапняку:
СаС03 = СаО + С02↑
Застосування. Вуглекислий газ С02 застосовують під час виробництва соди, цукру, для газування води, гасіння пожеж (наприклад, содові вогнегасники). Сухий лід використовують для зберігання продуктів, які швидко псуються.
Діоксид силіцію SiO2 у вигляді піску широко застосовують у будівництві, для добування скла, кераміки, порцеляни, фаянсу, цегли, цементу, абразивів1. У вигляді кварцу Sі02 використовують у радіотехніці, в акустоелектроніці, в оптичному приладобудуванні. Синтетичний діоксид силіцію Sі02 («біла сажа») застосовується як наповнювач у виробництві гуми.
Абразиви (фр. abrasif — шліфувальний, від лат. abrado — зіскоблюю) — природні або штучні матеріали високої твердості.
Сульфатна кислота H2S04 (безводна, 100%-ва) — важка безбарвна оліїста рідина. Густина її концентрованого розчину (w(H2S04) = 98%) за звичайних умов 1,84 г/см3. Вона нелетка, запаху не має. Надзвичайно гігроскопічна. Активно вбирає вологу. Змішується з водою у будь-яких співвідношеннях. Розчинення сульфатної кислоти у воді супроводжується виділенням великої кількості теплоти, що може призвести до закипання води і розбризкування кислоти.
Сульфатна кислота — їдка рідина, тому треба остерігатись, щоб вона не потрапила на шкіру й одяг. А якщо це сталося, треба швидко змити її великою кількістю води, після чого нейтралізувати розчином соди і знову змити водою. Пам'ятайте таке правило:
Не можна воду доливати до концентрованої сульфатної кислоти! Для розбавляння кислоту треба доливати до води невеликими порціями.
Хімічні властивості сульфатної кислоти багато в чому залежать від її концентрації. В лабораторіях та промисловості використовують розбавлену і концентровану сульфатну кислоту, хоча такий поділ дещо умовний.
Розбавлена сульфатна кислота виявляє всі хімічні властивості, характерні для кислот.
1. Дисоціація кислоти. Сульфатна кислота двохосновна, належить до сильних кислот. У водних розчинах вона дисоціює на йони за двома ступенями (за першим — практично повністю):
I ступінь Н2S04 ⇔ Н++ НSО-4 — гідросульфат-іон
II ступінь НS0-4 ⇔ Н+ + S02-4 — сульфат-іон
Ось чому в процесі нейтралізації розчинів сульфатної кислоти Н2S04 утворюються два ряди солей: середні солі — сульфати і кислі солі — гідросульфати.
2. Взаємодія з основами. Якщо у пробірку з розбавленою сульфатною кислотою добавити дві-три краплі фіолетового лакмусу, розчин набуває червоного забарвлення (кисле середовище). Потім у цю пробірку доливатимемо краплями розчин гідроксиду натрію доти, доки вміст пробірки набуде фіолетового забарвлення (нейтральне середовище):
2NaОН + Н2S04 = Nа2SО4 + 2Н20
сульфат натрію
Якщо ж розчину лугу Na0Н не вистачає для нейтралізації усієї кислоти, то сіль, що утворюється, буде кислою:
Na0H + Н2S04 = NаНS04 + Н20
гідросульфат натрію
Отже, гідросульфати утворюються тоді, коли кислота береться у надлишку.
Більшість сульфатів добре розчиняються у воді. Малорозчинним є сульфат кальцію CaS04, ще менше розчиняється сульфат плюмбуму PbS04 і практично нерозчинній є сульфат барію BaS04 (див. таблицю розчинності).
3. Взаємодія з оксидами металів. Сульфатна кислота реагує з основними та амфотерними оксидами, утворюючі солі, наприклад:
MgO + H2S04 = MgS04 + Н20
ZnO + H2S04 = ZnS04 + H20
4. Взаємодія з солями. Сульфатна кислота сильна і нелетка, одна з найстійкіших із відомих мінеральних кислот. Вона може вступати в реакцію обміну з солями, утвореними слабкішими або леткими кислотами і навіть сильними кислотами, якщо вони менш стійкі:
Na2C03 + H2S04 = Na2S04 + С02↑ + H20
2KN03 + H2S04 = K2S04 + 2HN03↑
2KCl04 + H2S04 = K2S04 + 2HCl04
BaCl2 + H2S04 = BaS04↓+ 2НСl↑
Останнє рівняння відображує якісну реакцію на кислоту та її солі, бо утворюється нерозчинний у воді сульфат барію BaS04.
Сульфатна кислота може взаємодіяти із своїми солями — сульфатами. При цьому середні солі — сульфати перетворюються на кислі солі гідросульфати:
Na2SO4 + H2S04 = 2NaHS04
Усі реакції, рівняння яких наведені у пункті 4, є реакціями йонного обміну. Напишіть їх у повній і скороченій йонних формах.
Лабораторна робота 2
Визначення сульфат-іонів у розчині
Налийте у першу пробірку трохи розбавленої сульфатної кислоти, у другу — розчину сульфату натрію, у третю — розчину нітрату натрію. До кожної з пробірок додайте кілька крапель розчину хлориду барію (або нітрату барію). Що спостерігається? До білого осаду, що утворився у двох пробірках (чому?), додайте по кілька крапель розбавленої нітратної кислоти.
Якщо осад не розчиняється, то це — сульфат барію BaS04. Він свідчить про те, що в цих пробірках розчини містили йони S042-.
Напишіть рівняння здійснених реакцій у молекулярній, повній і скороченій йонних формах.
Отже, про наявність у розчині сульфатної кислоти та її солей можна робити висновок на підставі утворення білого осаду BaS04, який практично не розчиняється ні у воді, ні в нітратній кислоті.
Таким чином, реактивом на сульфат-іони S02-4 є йони барію Ва2+:
Ва2+ + SO2-4 = BaS04↓ 5. Взаємодія з металами. Розбавлена сульфатна кислота реагує, наприклад, з магнієм, цинком, залізом з виділенням водню:
Mg + H2S04 = MgS04 + Н2↑
Zn + H2S04 = ZnSO4 + H2↑
Fe + H2S04 = FeS04 + H2↑
Малоактивні метали (мідь, срібло, золото) з розбавленою сульфатною кислотою не реагують.
Концентрована сульфатна кислота — сильний окисник. Вона може взаємодіяти з малоактивними металами, наприклад з міддю:
0 +6 +2 +4
Cu + 2H2S04 = CuS04 + S02↑ + 2Н20
0 - окиснення +2
Cu - 2e ------------------------> Cu
Відновник
+6 - відновлення +4
S + 2e -------------------------> S
Окисник
Нітратна кислота у водних розчинах дисоціює майже повністю та відноситься до сильних кислот: НNО3 == Н+ + NО3- Солі нітратної кислоти мають назву нітрати. Наприклад:Mg (NO3)2 - Магній нітрат.
Нітратна кислота проявляє властивості сильного окисника – при дії нітратної кислоти на метали водень не виділяється. Відновлення Нітрогену нітратної кислоти відбувається до різноманітних ступенів окислення, залежно від концентрації Нітратної кислоти та активності металу:
Активні метали (Ca, Mg, Zn) |
Метали середньої активності ( Fe, Cr, Ni) |
Малоактивні метали (Pb, Cu, Hg, Ag) |
Благородні метали (Au,Pt,Os,Ir) |
||||||
З НNО3конц. |
З НNО3 розведена |
З НNО3 Дуже розведена |
З НNО3концент. |
З НNО3різної конц. |
З НNО3концент |
З НNО3розвед. |
З НNО3різної конц. |
||
NО |
N2О абоN2 |
NН3 або солі амонію |
Не реагують |
NО2,NОN2О абоNН3 |
NО2 |
NО |
Не реагують |
||
Наприклад, розглянемо дію концентрованої нітратної кислоти на активні метали: Mg0 + конц.HN+5O3 ------ Mg+2 (NO3)2 + N+2O + H2O
Mg0 -2е ------ Mg2+ 3 відновник, процес окиснення
N+5 +3е ------ N+2 2 окисник, процес відновлення
Розставимо коефіцієнти у рівнянні:
3Mg + конц.8HNO3 ------ 3Mg (NO3)2 + 2NO + 4H2O
Нітратна кислота є безбарвною димучою рідиною з їдким запахом, легко розкладається, забарвлюючись у жовтий колір. Густина 1,53 г/см³. Кипить при 86°С, замерзає при — 41°С. На повітрі HNO3 «димить» внаслідок притягання її парами вологого повітря і утворення дрібненьких крапельок туману.
Нітратна кислота нестійка і вже під впливом сонячного світла поступово розкладається:
4HNO3 = 4NO2 + O2 + 2H2O
При нагріванні розклад її значно прискорюється. Утворюваний діоксид азоту розчиняється в HNO3 і надає їй жовтуватого кольору. У водних розчинах нітратна кислота значно стійкіша. З водою HNO3 змішується в будь-яких співвідношеннях.
Нітратна кислота належить до сильних кислот, у водних розчинах вона практично повністю дисоціює:
У продаж нітратна кислота звичайно поступає у вигляді 68%-ного розчину з густиною 1,4 г/см³.
Нітрат ( лат. nitras ; устар. селітри ) - сіль азотної кислоти, містить одне зарядний аніон N O 3 -.
Застаріла назва - селітри - в даний час використовується переважно в мінералогії, як назва для мінералів, а також для добрив в сільському господарстві.
