
- •3. Задача. Какое количество вещества гидроксида калия потребуется для полной нейтрализации 0,3 моль сероводородной кислоты?
- •1.Строение атомов химических элементов и закономерности в изменении их свойств на примере: а) элементов одного периода; б) элементов одной главной подгруппы.
- •2.Непредельные углеводороды ряда этилена, общая формула состава. Электронное и пространственное строение, химические свойства этилена
- •1. Виды химической связи: ковалентная (полярная и неполярная), ионная; их сходство и различие. Типы кристаллических решеток. Примеры веществ с различными типами решеток.
- •3. Задача. Рассчитайте массу пропена, вступившего в реакцию с водой, если в результате реакции образовалось 3,5 моль спирта.
- •2. Диеновые углеводороды, их строение, свойства, получение и практическое значение
- •2.Ацетилен – представитель углеводородов с тройной связью в молекуле. Химические свойства, получение и применение ацетилена в органическом синтезе
- •2. Ароматические углеводороды. Бензол, структурная формула, свойства и получение. Применение бензола и его гомологов
- •2. Реакции ионного обмена. Условия их необратимости.
- •2. Использование их в качестве топлива и в химическом синтезе
- •3. Задача. Оксид кальция массой 14 г взаимодействует с раствором, содержащим 35 г азотной кислоты. Определите массу получившейся соли.
- •3. Гомологический ряд альдегидов и кетонов.
- •1. Водородные соединения неметаллов. Закономерности в изменении их свойств в
- •2. Карбоновые кислоты - органические соединения, содержащие одну или несколько карбоксильных групп –соон, связанных с углеводородным радикалом.
- •2. «Жиры» их состав и свойства. Жиры в природе, превращение жиров в организме. Продукты технической переработки жиров, понятие о синтетических моющих средствах. Защита природы от загрязнения cmc.
- •1. Соли – это продукт полного или частичного замещения атомов водорода в молекуле кислоты на металл или же продукт полного или частичного замещения гидроксигрупп в основании на кислотный остаток
- •2. Аминокислоты, их строение и химические свойства: взаимодействие с соляной кислотой, щелочами, друг с другом. Биологическая роль аминокислот и их применение.
- •3. Взаимодействие со спиртами с образованием сложных эфиров.
- •5. Гидролиз дипептидов:
- •2. Взаимосвязь между важнейшими классами органических соединений.
- •2. Взаимное влияние атомов в молекулах органических веществ на примере этанола и фенола.
- •1. Причины многообразия неорганических и органических веществ; взаимосвязь веществ.
2. «Жиры» их состав и свойства. Жиры в природе, превращение жиров в организме. Продукты технической переработки жиров, понятие о синтетических моющих средствах. Защита природы от загрязнения cmc.
Жиры – это сложные эфиры глицерина и высших карбоновых кислот (стеариновой, пальмитиновой, линоленовой, олеиновой и др.). Синтез одного из жиров (тристеарина) можно представить схемой:
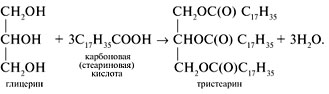
По происхождению жиры подразделяют на животные и растительные.
К животным жирам относят свиной и говяжий жиры, барсучье сало, жиры млекопитающих, рыбий жир.
Растительные жиры называют маслами. Известны соевое, подсолнечное, оливковое, облепиховое, кокосовое и другие масла.
В составе животных жиров преобладают остатки предельных кислот, а в составе растительных – остатки непредельных кислот.
Остатки карбоновых кислот могут быть одинаковыми (простые жиры) или различными (смешанные жиры).
По физическим свойствам жиры – легкоплавкие, твердые или жидкие вещества. Жиры нерастворимы в воде, зато хорошо растворяются в органических растворителях (ацетон, керосин, бензин).
Проведите лабораторный опыт и посмотрите, происходит ли растворение жира (подсолнечного масла) в холодной воде, бензине и ацетоне.
Жиры не имеют точки плавления и плавятся в широком интервале температур. При высоких температурах жиры разлагаются. Плотность жиров меньше 1 г/мл, они бывают различными по окраске, впитывают запахи других веществ.
Химические свойства жиров определяются их принадлежностью к классу сложных эфиров. Поэтому наиболее характерная реакция жиров – гидролиз. Непредельные жиры могут вступать в реакцию окисления, например окисляются кислородом воздуха.
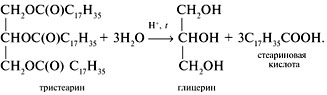
Реакция гидролиза жиров:
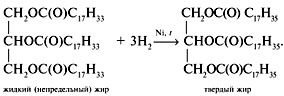
Уравнение реакции гидрирования жиров:
Все природные жиры — смесь глицеридов, не только симметричных, т.е. с тремя одинаковыми остатками жирных кислот, но и смешанных. Симметричные глицериды встречаются чаще в растительных маслах. Животные жиры отличаются весьма разнообразным составом жирных кислот. Жирные кислоты, входящие в состав триглициридов, определяют их свойства. Триглицириды способны вступать во все химические реакции, свойственные эфирам. Наибольшее значение имеет реакция омыления, в результате которой из триглицирида образуется глицерин и жирные кислоты.
Омыление происходит как при гидролизе, так и при действии кислот или щелочей.
Жиры — питательное вещество, является обязательной составной частью сбалансированного пищевого рациона человека. Они — важный источник энергии, который можно рассматривать как природный пищевой концентрат большой энергетической ценности, способный в небольшом объеме обеспечить организм энергией. Средняя потребность жиров для человека — 80-100 г в сутки. Один грамм жиров при окислении дает 9,3 ккал. Жиры также являются растворителями витаминов A, D и E. Обеспеченность организма в этих витаминах зависит от поступления жиров в составе пищи. С жирами в организм вводится комплекс биологически активных веществ, играющих важнейшую роль в нормальном жировом обмене.
СМС это "вещества или смеси веществ, применяемые в водных растворах для очистки (отмывки) поверхности твёрдых тел от загрязнений." Они содержат гидрофильную часть (в данном случае - карбоксильную группу) и гидрофобную часть (углеводородный радикал).
Другие названия синтетических моющих средств - детергенты и CMC. Примеры CMC: мыло, моющее средство для посуды, шампунь и т.д.
Как работают синтетические моющие средства? Очень просто. Но перед этим давайте разберёмся, какую грязь нужно отмывать с их помощью. Грязь, которую нужно отмывать с помощью детергентов - это грязь, которую не получается отмыть простой водой. То есть, это нерастворимая в воде грязь. Например, это жир. Или масло. Соответственно, поскольку вода не может отмыть жир или масло, то нужны вещества, которые позволят это сделать. Собственно, этим и занимаются синтетические моющие средства. Как же они это делают? Как уже говорилось, очень просто: детергенты состоят из двух частей. Одна часть растворяется в масле, а вторая часть-растворяется в воде.
Принцип работы CMC - молекула детергента одним концом (который может соединиться с жиром) Синтетические моющие средства встраивается в жир. Несколько молекул окружают каплю жира со всех сторон. Результат: грязь с жиром стала растворяться в воде. Почему? Потому что синтетические моющие средства спрятали свои "жирные" части в грязь, а "водные" части выставили наружу. Соответственно, вода легко отделяет обработанную детергентами часть жиросодержащей грязи.
Итак, вывод: в нашем случае синтетические моющие средства - это вещества, которые с помощью своего двойного строения позволяют растворять воде то, что она обычно растворить не может, например, подсолнечное масло со сковородки.
Чем вредят синтетические моющие средства в воде?
То есть, мы определили, что такое CMC, как они работают, и теперь можем переходить к их влиянию в воде. Могут ли детергенты оказаться в воде? Естественно, так как именно для воды они и предназначены.
Рассмотрим примерный путь, каким проходит детергент в обычном доме:
Первый шаг - покупка синтетического моющего средства для мытья посуды.
Второй шаг - намыливание этим CMC губки и мытьё сковороды с маслом.
Далее детергент окружает масло, заставляет его растворяться в воде, и попадает в канализацию.
Оттуда синтетическое моющее средство попадает в реку.
Синтетические моющие средства Возможно, между канализацией и рекой существует очистительная станция. Но поскольку в нашей стране очистительные станции слегка устарели (лет на 20), то будем считать, что её нет.
Итак, CMC в реке. И основные, кто страдает or синтетических моющих средств - это животные, которые дышат жабрами. То есть, рыбы, раки и прочие мелкие зверьки. Почему страдают именно они? Потому что CMC прилипают к жабрам, вода начинает прилипать к CMC, в жабры льётся вода, и рыбы захлёбываются. И умирают. Или (если детергентов не очень много), просто растут больными и хилыми. Другими словами: в обычном состоянии, хоть вода и попадает в жабры, но она не касается их, поскольку они покрыты отталкивающим воду веществом - специальным жиром. А поскольку моющие средства растворяют жир, то рыба не может пользоваться жабрами.
Вывод: синтетические моющие средства действительно вредны для водных обитателей.
3. Задача.
Какое количество вещества этана получится
при пропускании 6,72 г этена, содержащего
20% примесей, с водородом над нагретым
никелевым катализатором?

БИЛЕТ 15
1. Кислоты, их классификация и свойства на основе представлений об электролитической диссоциации. Особенности свойств концентрированной серной кислоты.
Кислота — сложное вещество, при диссоциации которого образуется только один тип катионов — ионы водорода.
![]()
Классификация кислот.
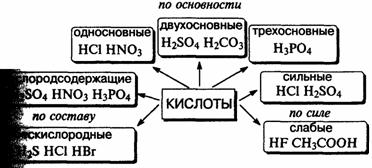
Соляная кислота — водный раствор газа хлоро-водорода в воде.
Химические свойства. Кислоты изменяют цвет индикаторов: лакмус окрашивается в красный цвет, метилоранж — в желтый. При реакции с основаниями образуется соль и вода (реакция нейтрализации). В
реакцию вступают как растворимые, так и нерастворимые в воде основания:
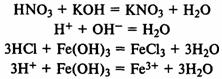
При реакции с основными оксидами образуются со ли:
![]()
Кислоты реагируют с металлами, находящимися в ряду напряжений до водорода, при этом выделяется газообразный водород и образуется соль:
![]()
Сильные кислоты реагирует с солями слабых кислот, вытесняя слабые кислоты из их солей:
![]()
Получение кислот. Многие кислоты можно получить при реакции кислотных оксидов с водой:
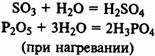

Концентрированная серная кислота при обычной температуре не действует на многие металлы. По этой причине, например, безводная серная кислота в отличие от её растворов может сохраняться в железной таре. Но концентрированная серная кислота действует почти на все металлы при нагревании. При этом образуются соли серной кислоты, однако водород не выделяется, а получаются другие вещества, например сернистый газ. Так, при нагревании концентрированной серной кислоты с медью вначале серная
кислота окисляет медь до окиси меди, а сама восстанавливается при этом до сернистой кислоты, которая тотчас же разлагается на сернистый газ и воду:
![]()
Образовавшаяся окись меди реагирует с избытком серной кислоты, образуя соль и воду:
![]()
Таким образом, окись меди является промежуточным веществом в этой реакции. Сложив эти уравнения, мы получим итоговое уравнение реакции, в которое входят только исходные и конечные вещества:
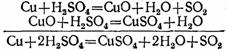
2. Целлюлоза, строение молекул, физические и химические свойства, применение. Понятие об искусственных волокнах на примере ацетатного волокна.
Целлюло́за — (C6H10O5)nбелое твердое вещество, нерастворимое в воде, молекула имеет линейное (полимерное) строение, структурная единица — остаток β-глюкозы [С6Н7О2(OH)3]n. Полисахарид, главная составная часть клеточных оболочек всех высших растений.
Целлюлоза была обнаружена и описана французским химиком Ансельмом Пайя в 1838 году.
Целлюлоза — белое твердое, стойкое вещество, не разрушается при нагревании (до 200 °C), но является горючим веществом. Температура воспламенения 275 °С, температура самовоспламенения 420 °С (хлопковая целлюлоза). Не растворима в воде и слабых кислотах.
Целлюлоза представляет собой длинные нити, содержащие 300—10 000 остатков глюкозы, без боковых ответвлений. Эти нити соединены между собой множеством водородных связей, что придает целлюлозе большую механическую прочность, при сохранении эластичности.
Зарегистрирована в качестве пищевой добавки E460.
Химические свойства
Целлюлоза состоит из остатков молекул глюкозы, которая и образуется при гидролизе целлюлозы:
(C6H10O5)n + nH2O
![]() nC6H12O6
nC6H12O6
Серная кислота с йодом, благодаря гидролизу, окрашивают целлюлозу в синий цвет. Один же йод — только в коричневый.[источник не указан 237 дней]
При реакции с азотной кислотой образуется нитроцеллюлоза (тринитрат целлюлозы):
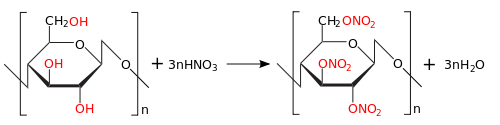
В процессе этерификации целлюлозы уксусной кислотой получается ацетат целлюлозы:

Промышленным методом целлюлозу получают методом варки щепы на целлюлозных заводах, входящих в промышленные комплексы (комбинаты). По типу применяемых реагентов различают следующие способы варки целлюлозы:
Сульфитный. Варочный раствор содержит сернистую кислоту и её соль, например гидросульфит натрия. Этот метод применяется для получения целлюлозы из малосмолистых пород древесины: ели, пихты.
Натронный. Используется раствор гидроксида натрия. Натронным способом можно получать целлюлозу из лиственных пород древесины и однолетних растений. Преимуществом данного метода — отсутствие неприятного запаха соединений серы, недостатки — высокая стоимость получаемой целлюлозы. Метод практически не используется.
Сульфатный. Наиболее распространенный метод на сегодняшний день. В качестве реагента используют раствор, содержащий гидроксид и сульфид натрия, и называемый белым щёлоком. Своё название метод получил от сульфата натрия, из которого на целлюлозных комбинатах получают сульфид для белого щёлока. Метод пригоден для получения целлюлозы из любого вида растительного сырья. Недостатком его является выделения большого количества дурно пахнущих сернистых соединений: метилмеркаптана, диметилсульфида и др. в результате побочных реакций.
Получаемая после варки техническая целлюлоза содержит различные примеси: лигнин, гемицеллюлозы. Если целлюлоза предназначена для химической переработки (например, для получения искусственных волокон), то она подвергается облагораживанию — обработке холодным или горячим раствором щелочи для удаления гемицеллюлоз.
Для удаления остаточного лигнина и придания целлюлозе белизны проводится её отбелка. Традиционная для 20 века хлорная отбелка включала в себя две ступени:
обработка хлором — для разрушения макромолекул лигнина;
обработка щелочью — для экстракции образовавшихся продуктов разрушения лигнина.
Целлюлозу и её эфиры используют для получения искусственного волокна (вискозный, ацетатный, медно-аммиачный шёлк,искусственная шерсть). Хлопок, состоящий большей частью из целлюлозы (до 99,5 %), идёт на изготовление тканей.
Древесная целлюлоза используется для производства бумаги, пластмасс, кино и фотоплёнок, лаков, бездымного порохаи т. д.
Кроме целлюлозы, в состав клеточных оболочек входят ещё несколько других углеводов, известных под общим именем гемицеллюлоз, извлекаемых из клеточных оболочек 1%-м раствором соляной или серной кислоты при нагревании.
Один из относящихся сюда углеводов — парагалактан, дающий при гидролизе галактозу. В клеточных оболочках имеются ещё и другие гемицеллюлозы, дающие маннозу, арабинозу и ксилозу.
С возрастом многие клеточные оболочки перестают давать реакцию на целлюлозу, потому что одни подвергаютсяодревеснению, другие — опробковению и т. д.
У млекопитающих (как и большинства других животных) нет ферментов, способных расщеплять целлюлозу. Однако многие травоядные животные (например, жвачные) имеют в пищеварительном тракте бактерий-симбионтов, которые расщепляют и помогают хозяевам усваивать этот полисахарид.
Ацетатные волокна — один из основных видов искусственных волокон; получают из ацетилцеллюлозы. В зависимости от типа исходного сырья различают триацетатное волокно (из триацетилцеллюлозы) и собственно ацетатные волокна (из частичноомыленной, т. н. вторичной, ацетилцеллюлозы).
Ацетатные волокна формуют из растворов ацетилцеллюлозы в органических растворителях (триацетилцеллюлозу — в смеси метиленхлорида и спирта, вторичную ацетилцеллюлозу — в ацетоне), обычно по сухому методу. По этому методу получают филаментные нити, т. н. ацетатный шёлк. При получении ацетатного штапельного волокна формование ведут по сухому или мокрому методу.
Ацетатные волокна вдвое превосходят вискозные и медноаммиачные волокна по эластичности; поэтому ткани из них отличаются пониженной сминаемостью. Кроме того, ацетатные волокна приятны на ощупь, мягки, обладают способностью пропускать ультрафиолетовые лучи. Окрашиваются ацетатные волокна только специальными типами красителей, которые непригодны для большинства других волокон. Это даёт возможность получать разнообразные колористические эффекты на изделиях из смеси ацетатных волокон и волокон других типов. Триацетатное волокно характеризуется более низкой гигроскопичностью, но большей эластичностью и меньшей сминаемостью, чем изделия из ацетатного волокна При 65%-ной относительной влажности триацетатное волокно сорбирует 2,5—3 % влаги, а ацетатное 6—7 % .
Прочность при разрыве ацетатных волокон невысока (разрывная длина 11—13 км). Потеря прочности при испытании в мокром состоянии для ацетатного волокна составляет 40—45 %, а для триацетатного 15—20 %. Ацетатные волокна характеризуются недостаточно высокой термостабильностью: выше 160—170 °C изменяется форма изделий из этого волокна, при 210 °C начинается его термический распад. Поэтому изделия из ацетатных волокон можно гладить только через влажную ткань. Ацетатные волокна малоустойчивы к действию даже разбавленных растворов щелочей. К недостаткам изделий из ацетатных волокон относятся также низкая устойчивость к истиранию и высокая электризуемость. Для устранения этих недостатков используют методы химической модификации ацетилцеллюлозы.
Основные области применения ацетатных волокон — изготовление изделий широкого потребления (верхней одежды, дамского нижнего белья, подкладочных и плательных тканей). Ацетатное штапельное волокно применяют для частичной замены шерстипри изготовлении тонких сукон и некоторых трикотажных изделий. Использование ацетатных волокон позволяет снижать сминаемость изделий. Триацетатные гидрофобные нити применяют как электроизоляционный материал. Также ацетатное волокно используется для изготовления сигаретных фильтров.
О п ы т. Испытание индикаторами растворов солей, образованных: а) сильным основанием и слабой кислотой; 6) сильной кислотой и слабым основанием. Объяснение результатов наблюдений.
А) Исследуем соль Na2CO3 (образованна угольной кислотой H2CO3 и гидроксидом натрия NaOH). (Угольная кислота – слабая летучая кислота, гидроксид натрия – сильное растворимое основание, щелочь).
Na2CO3 + HOH <––> NaOH + NaHCO3 2Na+ + CO32– + HOH <––> Na+ + OH– + Na+ + HCO3– CO32– + HOH <––> OH– + HCO3–
pH > 7, [H+] < [OH–].
Раствор соли, образованной сильным основанием и слабой кислотой, имеет щелочную среду, т.к. имеется избыток гидроксид-анионов. Лакмус в этом растворе посинеет. Фенолфталеин окрасит раствор в малиновый цвет.
Б) Проанализируем соль FeCl3 (образована слабым основанием Fe(OH)3 (нерастворимое основание) и сильной кислотой HCl).
FeCl3 + HOH <––> HCl + FeOHCl2 Fe3+ + 3Cl– + HOH <––> H+ + Cl– + FeOH2+ + 2Cl– Fe3+ + HOH <––> FeOH2+ + H+
pH < 7, [H+] > [OH–].
Раствор соли, образованной слабым основанием и сильной кислотой, имеет кислую среду, т.к. имеется избыток ионов водорода. Метилоранж этот раствор окрасит в красный цвет.
БИЛЕТ 16
Основания, их классификация и химические свойства на основе представлений об
электролитической диссоциации.
Основания — электролиты, при диссоциации которых образуется только один вид анионов — гидроксид-ионы.
![]()
Классификация оснований
1. Растворимые в воде (щелочи) — гидроксиды металлов главных подгрупп I
и II групп.
![]()
2. Нерастворимые в воде — гидроксиды остальных металлов.
![]()
Химические свойства. Щелочи изменяют окраску индикаторов (лакмус
становится синим, фенолфталеин – малиновым).
Взаимодействие с кислотами:
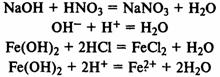
Взаимодействие с кислотными оксидами:
![]()
Растворы щелочей вступают в реакции ионного обмена с растворами солей, если
образующийся при этом гидроксид нерастворим в воде:
![]()
При нагревании слабые основания разлагаются на оксиды металлов и воду:
![]()
Получение оснований. Щелочи получают электролизом растворов солей.
Электролиз раствора хлорида натрия. Процессы на катоде и аноде:
![]()
Уравнение реакции:
![]()
Нерастворимые в воде основания получают реакцией обмена со щелочами:
![]()
2. Глюкоза — представитель моносахаридов, строение, физические и химические свойства, применение.
Бесцветное кристаллическое вещество сладкого вкуса, растворимое в воде и органических растворителях, растворимо в реактиве Швейцера: аммиачном растворе гидроксида меди — Cu(NH3)4(OH)2, в концентрированном растворехлорида цинка и концентрированном растворе серной кислоты.
Глюкоза может существовать в виде циклов (α и β глюкозы).
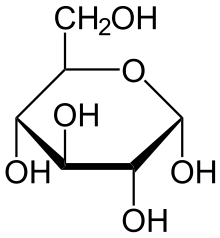 альфа
– глюкоза
альфа
– глюкоза
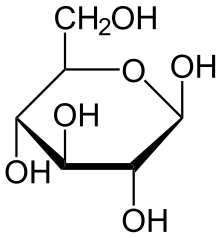 бетта
– глюкоза
бетта
– глюкоза
Реакция брожения глюкозы
![]()
Получение глюкозы
а) Реакция фотосинтеза
6СО2 + 6H2O –> С6Н12 О6 + 6О2 +Q
б) Реакция полимеризации
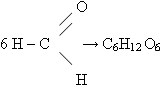
в) Гидролиз крахмала (уравнение записывает учитель)
(С6Н10О5)n + nH2O –> nС6Н12О6
Доказать наличие альдегидной группы в глюкозе можно с помощью аммиачного раствора оксида серебра. К аммиачному раствору оксида серебра добавим раствор глюкозы и подогреем смесь на водяной бане. Вскоре на стенках колбы начинает осаждаться металлическое серебро. Эта реакция называется реакцией серебряного зеркала. Ее используют как качественную для открытия альдегидов. Альдегидная группа глюкозы окисляется до карбоксильной группы. Глюкоза превращается в глюконовую кислоту. Запишите уравнение реакции:
СН2ОН
– (СНОН)4 –
СОН + Ag2O
= СН2ОН
– (СНОН)4 –
СООН + 2Ag![]()
(Реакцию серебряного зеркала используют в промышленности для серебрения зеркал, изготовления колб для термосов, елочных украшений).
2) Взаимодействие глюкозы с гидроксидом меди (II)
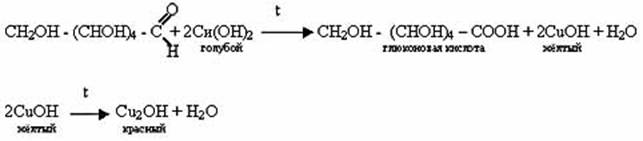
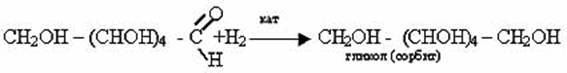
3) Гидрирование глюкозы
Альдегидная группа может быть восстановлена в гидроксильную группу действием водорода в присутствии катализатора.
Глюкоза находит применение в различных отраслях промышленности:
в пищевой промышленности, как заменитель сахарозы;
в кондитерской промышленности при изготовлении мягких конфет, десертных сортов шоколада, тортов и различных диетических изделий;
в хлебопечении глюкоза улучшает условия брожения, придает пористость и хороший вкус изделиям, замедляет очерствение;
в производстве мороженого она занижает точку замерзания, увеличивает его твердость;
при производстве фруктовых консервов, соков, ликеров, вин, безалкогольных напитков, так как глюкоза не маскирует аромата и вкуса;
в молочной промышленности при изготовлении молочных продуктов и продуктов детского питания рекомендуется использовать глюкозу в определенной пропорции с сахарозой для придания этим продуктам более высокой питательной ценности;
в ветеринарии;
в птицеводстве;
в фармацевтической промышленности.
Кристаллическую глюкозу целесообразно использовать для питания больных, травмированных, выздоравливающих, а также людей, работающих с большими перегрузками.
Медицинскую глюкозу применяют в антибиотиках и других лекарственных препаратах, в том числе для внутривенных вливаний, и для получения витамина С. Техническая глюкоза находит применение в качестве восстановителя в кожевенном производстве, в текстильном – при производстве вискозы, в качестве питательной среды при выращивании различных видов микроорганизмов в медицинской и микробиологической промышленности.
3. Задача.
Определите массу соли, которая образуется
при взаимодействии 245 г 20% -ной серной
кислоты с хлоридом бария, при условии,
что они вступили в реакцию полностью.

БИЛЕТ 17
