
- •Вопрос 1.
- •Вопрос 2
- •Вопрос 3.
- •Вопрос 4.
- •Вопрос 5.
- •Вопрос 6.
- •Вопрос 7.
- •Вопрос 8.
- •Вопрос 9.
- •Вопрос 10.
- •Вопрос 11.
- •Вопрос 12.
- •Вопрос 13.
- •Вопрос 14.
- •Вопрос 15.
- •Вопрос 16.
- •Вопрос 17.
- •Вопрос 18.
- •Вопрос 19.
- •Вопрос 20
- •Вопрос 21.
- •Вопрос 22.
- •Вопрос 23.
- •Вопрос 24.
- •Вопрос 25.
- •Вопрос 26.
- •Вопрос 27.
- •Вопрос 28.
- •Вопрос 29.
- •Вопрос 30.
- •Вопрос 31.
- •Вопрос 32.
- •Вопрос 33.
- •Вопрос 34.
- •Вопрос 35.
- •Вопрос 36.
- •Вопрос 37.
- •Вопрос 38.
- •Вопрос 39.
- •Вопрос 40.
- •Вопрос 41.
- •Вопрос 42.
- •Вопрос 43.
- •Вопрос 44.
- •Вопрос 45.
- •Вопрос 46.
- •Вопрос 47.
- •Вопрос 48.
- •Вопрос 49.
- •Вопрос 50.
- •Вопрос 51.
- •Вопрос 52.
- •Вопрос 53.
- •Вопрос 54.
- •Вопрос 55.
- •Вопрос 56.
- •Вопрос 57.
- •Вопрос 58.
- •Вопрос 59.
- •Вопрос 60.
- •Вопрос 61.
- •Вопрос 62.
- •Вопрос 63.
Вопрос 22.
Реальный газ — газ, который не описывается уравнением состояния идеального газа Менделеева—Клапейрона.
Зависимости
между его параметрами показывают, что
молекулы в реальном газе взаимодействуют
между собой и занимают определенный
объем. Состояние реального газа часто
на практике описывается обобщенным
уравнением Менделеева - Клапейрона:
![]()
где p — давление; T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; М — масса; R — газовая постоянная.
Модель идеального газа хорошо описывает поведение реальных газов при низких давлениях и высоких температурах, в других условиях её соответствие с опытом гораздо хуже. В частности, это проявляется в том, что реальные газы могут быть переведены в жидкое и даже в твёрдое состояние, а идеальные — не могут. Для более точного описания поведения реальных газов при низких температурах была создана модель газа Ван-дер-Ваальса, вводящая поправку на конечный диаметр молекулы и на притяжение молекул на больших расстояниях, тогда как в идеальных газах частицы считаются точечными и никак не взаимодействуют на расстоянии.
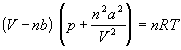 - уравнение
Ван-дер-Ваальса.
- уравнение
Ван-дер-Ваальса.
Опыт Эндрюса: Сжимая газ под поршнем, Эндрюс обнаружил, что при уменьшении объема газа его давление сначала растет, но, начиная с некоторого момента, оно остается постоянным. Это означает, что пар под поршнем стал насыщенным. При дальнейшем сжатии в цилиндре появляется жидкость, заполняющая постепенно весь объем, а давление насыщенного пара над жидкостью остается постоянным. Однако такой фазовый переход происходит при достаточно низких температурах, начиная с некоторой температуры газ можно сжать до любого давления без превращения в жидкость. Изотермы при температуре выше критической не отличаются от изотерм. ид. газа, значит реальный газ им. св-ва идеального газа. Существуют 4 зоны, которые соответствуют различным состоянием газа. При темпер. выше критической состояние в-ва – газообразное. Если газ охлаждается- пар. Если газ сжать то перейдет в жид. сост.
Вопрос 23.
Когда вещество находится в жидком состоянии, между его молекулами действуют силы, мешающие молекулам вещества разлетаться во все стороны. Будем называть эти силы молекулярными силами или силами сцепления. При уменьшении расстояния между молекулами жидкого или твердого тела между ними возникают большие силы отталкивания. Вследствие теплового движения молекулы совершают малые колебания около равновесных положений, в процессе которых силы притяжения сменяются силами отталкивания и наоборот. Чтобы сжать жидкость (например, сдавить воду в цилиндре поршнем), нужно уменьшить средние расстояния между молекулами. При этом возникают все возрастающие силы отталкивания между молекулами.
Пове́рхностное натяже́ние — термодинамическая характеристика поверхности раздела двух находящихся в равновесии фаз, определяемая работой обратимого изотермокинетического образования единицы площади этой поверхности раздела при условии, что температура, объем системы и химические потенциалы всех компонентов в обеих фазах остаются постоянными. Капиллярные явления, физические явления, обусловленные действием поверхностного натяжения на границе раздела несмешивающихся сред. К Капиллярным явлениям относят обычно явления в жидких средах, вызванные искривлением их поверхности, граничащей с др. жидкостью, газом или собственным паром.
