
- •1.Суть явления электромагнитной индукции
- •2.Законы Ленца для электромагнитной индукции
- •3.Основной закон электромагнитной индукции
- •4.Самоиндукция.
- •5.Свободные электромагнитные колебания.
- •6.Затухающие электромагнитные колебания. Вынужденные электромагнитные колебания. Переменные токи. Затухающие электромагнитные колебания
- •Вынужденные электромагнитные колебания
- •Переменные токи.
- •7.Сопротивление в цепи переменного тока.
- •8.Емкость в цепи переменного тока. Рис. 2.12
- •9. Индуктивность в цепи переменного тока.
- •10.Закон Ома для переменных токов.
- •11. Резонанс напряжений в цепи переменного тока.
- •12. Интерференция волн в механике
- •13. Условия интерференции света.
- •14. Интерференция в тонких пластинках.
- •15. Кольца Ньютона.
- •16. Дифракция света. Суть явления. Принцип Гюйгенса.
- •17. Принцип Гюйгенса-Френеля
- •18. Метод зон Френеля.
- •19. Дифракция на круглом отверстии.
- •20. Поляризация света.Суть явления. Поляризация света при отражении и преломлении света
- •21. Прохождение света через анизотропные среды.
- •22 Нормальная и аномальная дисперсия света.
- •23. Фотоэффект: суть явления, исследования Столетова
- •Законы фотоэффекта
- •24. Уравнение Эйнштейна для фотоэффекта
- •Доказательство законов фотоэффекта
- •25. Тепловое излучение. Виды излучений. Правило Прево.
- •26. Закон Кирхгофа для теплового излучения.
- •27. Излучение абсолютно черного тела.
- •28. Закон Стефана-Гольцмана.
- •29.Закон смещения Вина.
- •30. Формула излучения Планка.
- •31. Физика атома.Модели атома.
- •Квантовомеханическая модель атома
- •32. Постулаты Бора.
- •33. Теория атома водорода.
- •34. Строение ядра.
- •35. Энергия связи ядра и ядерных реакций.
Квантовомеханическая модель атома
Современная модель атома является развитием планетарной модели Бора-Резерфорда. Согласно современной модели, ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома).
Химические свойства атомов определяются конфигурацией электронной оболочки и описываются квантовой механикой. Положение атома в таблице Менделеева определяется электрическим зарядом его ядра (то есть количеством протонов), в то время как количество нейтронов принципиально не влияет на химические свойства; при этом нейтронов в ядре, как правило, больше, чем протонов (см.: атомное ядро). Если атом находится в нейтральном состоянии, то количество электронов в нём равно количеству протонов. Основная масса атома сосредоточена в ядре, а массовая доля электронов в общей массе атома незначительна (несколько сотых процента массы ядра).
Массу атома принято измерять в атомных единицах массы, равных 1⁄12 от массы атома стабильного изотопа углерода 12C.
32. Постулаты Бора.
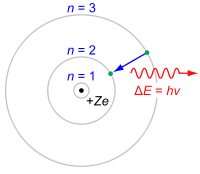 Атом может
находиться только в особенных стационарных
или квантовых состояниях, каждому из
которых отвечает определенная энергия.
В стационарном состоянии атом не
излучает электромагнитных волн.
Атом может
находиться только в особенных стационарных
или квантовых состояниях, каждому из
которых отвечает определенная энергия.
В стационарном состоянии атом не
излучает электромагнитных волн.Электрон в атоме, не теряя энергии, двигается по определённым дискретным круговым орбитам, для которых момент импульса квантуется:
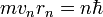 ,
где
,
где 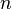 — натуральные
числа,
а
— натуральные
числа,
а 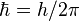 — постоянная
Планка.
Пребывание электрона на орбите определяет
энергию этих стационарных
состояний.
— постоянная
Планка.
Пребывание электрона на орбите определяет
энергию этих стационарных
состояний.При переходе электрона с орбиты (энергетический уровень) на орбиту излучается или поглощается квант энергии
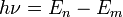 ,
где
,
где 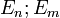 — энергетические
уровни,
между которыми осуществляется переход.
При переходе с верхнего уровня на нижний
энергия излучается, при переходе с
нижнего на верхний — поглощается.
— энергетические
уровни,
между которыми осуществляется переход.
При переходе с верхнего уровня на нижний
энергия излучается, при переходе с
нижнего на верхний — поглощается.
Используя данные постулаты и законы классической механики, Бор предложил модель атома, ныне именуемую Боровской моделью атома[1]. В дальнейшем Зоммерфельд расширил теорию Бора на случай эллиптических орбит. Её называют моделью Бора-Зоммерфельда.
33. Теория атома водорода.
Атом водорода — физическая система, состоящая из атомного ядра, несущего элементарный положительный электрический заряд, и электрона, несущего элементарный отрицательный электрический заряд. В состав атомного ядра может входить протон или протон с одним или несколькими нейтронами, образуя изотопы водорода. Электрон преимущественно находится в тонком концентрическом шаровом слое вокруг атомного ядра, образуя электронную оболочку атома. Наиболее вероятный радиус электронной оболочки атома водорода в стабильном состоянии равен боровскому радиусу a0 = 0,529 Å.
Атом водорода имеет специальное значение в квантовой механике и релятивистской квантовой механике, поскольку для него проблема двух тел имеет точное или приближенное аналитическое решения. Эти решения применимы для разных изотопов водорода, с соответствующей коррекцией.
В квантовой механике атом водорода описывается двухчастичной матрицей плотности или двухчастичной волновой функцией. Также упрощенно рассматривается как электрон в электростатическом поле бесконечно тяжёлого атомного ядра, не участвующего в движении (или просто в кулоновском электростатическом потенциале вида 1/r). В этом случае атом водорода описывается редуцированной одночастичной матрицей плотности или волновой функцией.
В 1913 году Нильс Бор предложил модель атома водорода, имеющую множество предположений и упрощений, и вывел из неё спектр излучения водорода. Предположения модели не были полностью правильны, но тем не менее приводили к верным значениям энергетических уровней атома.
Результаты расчётов Бора были подтверждены в 1925—1926 годах строгим квантово-механическим анализом, основанном на уравнении Шрёдингера. Решение уравнения Шрёдингера для электрона в электростатическом поле атомного ядра выводится в аналитической форме. Оно описывает не только уровни энергии электрона и спектр излучения, но и формуатомных орбиталей.
