
- •Лабораторная работа 1
- •Ход работы
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа 2
- •Теоретическое обоснование
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа 3
- •Теоретическое обоснование работы
- •Ход работы
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа 4
- •Теоретическое обоснование работы
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа 5
- •Теоретическое обоснование работы
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа 6
- •Теоретическое обоснование
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа 7
- •Теоретическое обоснование
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа 8
- •Теоретическое обоснование
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа 9
- •Теоретическое обоснование
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа 10
- •Теоретическое обоснование работы
- •Ход работы
- •Взаимная коагуляция
- •Расчёта порога коагуляции
- •Контрольные вопросы
Лабораторная работа 5
ТЕМА: Изучение равновесия гомогенной химической реакции
ЦЕЛЬ: определить величину константы равновесия обратимой химической реакции при постоянной температуре
ПРИБОРЫ И РЕАКТИВЫ: четыре колбы на 100 мл с пробками; две воронки; две конические колбы для титрования; пипетка на 5 мл; пипетка на 10 мл; четыре бюретки на 50 мл с делениями в 0,1 мл; дистиллированная вода; лед; растворы: 0.03 М FeCl3; 0.03 М KI; 0.015 М Na2S2O3 ; раствор крахмала.
Теоретическое обоснование работы
Химическое равновесие — это термодинамическое равновесие в химически реагирующей системе, между компонентами которой осуществляется кинетически обратимая реакция. Равенство скоростей прямой и обратной реакций является кинетическим условием химического равновесия. Смещением положения равновесия называют изменение состояния равновесия в результате изменения условий, т.е. переход системы из одного равновесного состояния в другое в соответствии с принципом Ле Шателье: если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то в системе происходит смещение равновесия в направлении процесса, усиленное протекание которого ослабляет оказываемое воздействие.
Для обратимой гомогенной реакции: aA + bB ↔ cC+ dD
константа равновесия может быть выражена в виде отношения равновесных молярных концентраций реагирующих веществ - KC, равновесных парциальных давлений — KP:
[A] a [B] b Р(A) a Р(B) b
K C=
; Kр=
C=
; Kр=
[C] c [D] d Р(C) c Р(D) d
Между константами равновесия KC и KP существует взаимосвязь: KP = KC(RT)Δn , где Δn = (nc +nd ) — (na + nb)
Ход работы
В данной работе химическое равновесие изучается на примере обратимой реакции:
![]()
![]()
Опыт проводится при комнатной температуре. Для выполнения работы берут четыре колбы с притертыми пробками емкостью 100 мл. Пронумеровав колбы, наливают в них из бюреток следующие количества растворов реагентов:
-
Раствор
Объём раствора, мл
№ 1
№ 2
№ 3
№ 4
0.03 М FeCl3
50
–
55
–
0.03 М KI
–
50
–
45
Приготавливают охлаждённую до 0 °С дистиллированную воду. Сливают вместе содержимое колб №№ 1 и 2, а через 10 минут – содержимое колб №№ 3 и 4. Колбы со смешанными растворами плотно закрывают пробками.
Первая проба для титрования отбирается из каждой колбы через 15 минут после смешивания растворов.
В коническую колбу для титрования наливают 50 мл ледяной дистиллированной воды. Из колбы, в которой протекает реакция, отбирают пипеткой 15 мл раствора и выливают пробу в приготовленную колбу с ледяной водой. Немедленно после выливания пробы образовавшийся в ходе реакции иод титруют 0.015 М раствором тиосульфата натрия Na2S2O3. При титровании раствор тиосульфата прибавляется до бледно-жёлтой окраски раствора, затем добавляется 3-5 капель раствора крахмала и продолжается титрование до исчезновения синего окрашивания (поскольку при выливании пробы в ледяную воду реакция не останавливается, а лишь замедляется, через некоторое время после завершения титрования синяя окраска раствора появляется вновь).
Отбор пробы из каждой колбы и её титрование осуществляется каждые 15 минут до тех пор, пока на титрование двух последовательных проб из данной колбы не будет затрачен одинаковый объём раствора тиосульфата. Прекращение увеличения концентрации иода указывает на достижение равновесия в реакции. Для расчёта равновесных концентраций реагентов используют объём раствора тиосульфата V (Na2S2O3) , затраченный на титрование пробы в момент равновесия (т.е. на титрование последней пробы).
Результаты эксперимента представляют в виде таблицы:
Колба № 1 (50 мл 0.03 М FeCl3 + 50 мл 0.03 М KI, комнатная температура) |
Колба № 2 (55 мл 0.03 М FeCl3 + 45 мл 0.03 М KI, комнатная температура) |
||||
№ пробы |
Время от начала реакции, мин |
Объём раствора Na2S2O3, затраченный на титрование пробы, мл |
№ пробы |
Время от начала реакции, мин |
Объём раствора Na2S2O3, затраченный на титрование пробы, мл |
1 |
15 |
|
1 |
15 |
|
2 |
30 |
|
2 |
30 |
|
... |
,,, |
|
... |
,,, |
|
Расчёт равновесных концентраций ведут следующим образом.
1.
Концентрация иода
![]() :
:
![]()
2. Концентрация ионов Fe2+ равна удвоенной концентрации иода:
![]()
3. Концентрация ионов Fe3+ равна разности начальной концентрации FeCl3 и равновесной концентрации ионов Fe2+:
![]()
Концентрация
FeCl3
вычисляется из концентрации исходного
раствора
![]() и
степени его разбавления при смешении
с раствором иодида калия:
и
степени его разбавления при смешении
с раствором иодида калия:
![]()
Здесь a и b – объёмы растворов соответственно FeCl3 и KI, взятых для проведения реакции.
4.
Равновесная концентрация иодид-иона
![]() вычисляется,
исходя из концентрации исходного
раствора
вычисляется,
исходя из концентрации исходного
раствора
![]() и равновесной концентрации иода:
и равновесной концентрации иода:
![]()
![]()
Расчёт константы равновесия для каждого из растворов проводится по формуле:
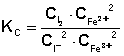
Средняя константа равновесия при данной температуре вычисляется как полусумма значений Кс, полученных для каждого из приготовленных растворов.
Результаты расчётов константы равновесия представляют в виде таблицы:
|
Колба 1 |
Колба 2 |
|
|
|
, моль/л |
|
|
|
|
|
|
|
|
, моль/л |
|
|
Кс |
|
|
Средняя Кс |
|
|
ВЫВОД:
Устно ответить на контрольные вопросы.
