
- •Лабораторная работа 1
- •Ход работы
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа 2
- •Теоретическое обоснование
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа 3
- •Теоретическое обоснование работы
- •Ход работы
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа 4
- •Теоретическое обоснование работы
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа 5
- •Теоретическое обоснование работы
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа 6
- •Теоретическое обоснование
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа 7
- •Теоретическое обоснование
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа 8
- •Теоретическое обоснование
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа 9
- •Теоретическое обоснование
- •Ход работы
- •Контрольные вопросы
- •Лабораторная работа 10
- •Теоретическое обоснование работы
- •Ход работы
- •Взаимная коагуляция
- •Расчёта порога коагуляции
- •Контрольные вопросы
Лабораторная работа 9
Тема: Определение водородного показателя (рН) потенциометрическим методом
Цель работы: Ознакомиться с потенциометрическим методом титрования.
 Приборы
и реактивы: устройство
лабораторное интерфейсное Unipractic,
промежуточный преобразователь
ионометрический, электрод стеклянный
комбинированный; стаканчик ёмкостью
50 мл., 0.1н раствор НСl,
0.1н раствор NaOH,
бюретка.
Приборы
и реактивы: устройство
лабораторное интерфейсное Unipractic,
промежуточный преобразователь
ионометрический, электрод стеклянный
комбинированный; стаканчик ёмкостью
50 мл., 0.1н раствор НСl,
0.1н раствор NaOH,
бюретка.
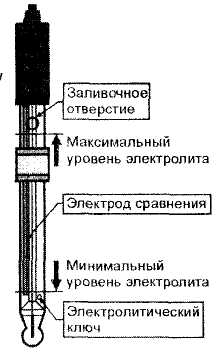
Устройство стеклянного электрода
Электрод стеклянный комбинированный предназначен для определения величины водородного показателя при подключении его через промежуточный преобразователь к устройству Unipractic.
Теоретическое обоснование
Водородный показатель равен отрицательному десятичному логарифму величины концентрации водородных ионов.
Наиболее употребительными методами определения концентрации водородных ионов являются электрометрический и колориметрический, или индикаторный.
Из существующих методов наиболее точным является потенциометрический, основанный на измерении ЭДС гальванической пары, потенциал одного из электродов которой зависит от концентрации ионов водорода.
Для измерения рН растворов наиболее широко применяется стеклянный электрод, так как его потенциал не зависит от присутствия окислителей или восстановителей, поверхностно-активных веществ, электродных ядов и зависит лишь от концентрации ионов водорода. Стеклянный электрод позволяет измерить рН в пределах 1-13,5 в интервале температур 0-950С.
Ход работы
Управление устройством осуществляется с помощью сенсорной панели жидкокристаллического индикатора посредством отображаемого пользовательского меню.
ВНИМАНИЕ! Разъем датчика можно подключать только к выключенному измерительному преобразователю!
Присоедините шнур сетевого адаптера к Устройству. Включите блок питания в электрическую сеть, включите питание Устройства. На жидкокристаллическом индикаторе должно отобразиться Главное меню, состоящее из 4-х пунктов: «ИЗМЕРЕНИЕ», «НАСТРОЙКА ДАТЧИКОВ», «ВРЕМЯ», «ФЛЕШ». Для выбора нужного пункта меню необходимо прикоснуться к его полю на сенсорной панели жидкокристаллического индикатора. Активный пункт меню отображается инверсно.
Измерения проводят в следующем порядке:
1. Промыть электрод дистиллированной водой.
Произвести измерение рН. Для этого в стаканчик с исследуемым раствором помещают
электрод и производят замер по шкале прибора.
Титрование производят следующим образом: в стакан наливают 20 мл НС1, концентрацию которой надо найти, измеряют рН раствора, затем приливают из бюретки 2 мл 0,1 н. раствора NaOH, измеряют рН, затем еще приливают 2 мл раствора NaOH и т. д. При титровании все время перемешивают раствор.
Данные занести в таблицу:
Количество прилитой NaOH, мл |
2 |
4 |
6 |
8 |
10 и т.д. |
рН |
|
|
|
|
|
Значение рН будет изменяться медленно, затем будет скачок, после чего рН снова будет изменяться медленно. Сделав 2—3 измерения после скачка, титрование закончить. По окончании титрования необходимо выключить прибор.
По результатам титрования строят кривую зависимости изменения рН раствора от объема добавляемого рабочего раствора, концентрация которого известна. Эквивалентная точка находится в середине вертикального отрезка кривой.

V NaOH
Vэкв
