
- •1. Фосфоенолпируват ббразуется из пирувата через оксалоацетат.
- •8 Термин "витамин е" объединяет 8 токоферолов . Наиболее активный и широко распространенный среди них - альфа-токоферол ( рис. 79.1 ).
- •Первичная структура белка несет информацию о его пространственной структуре.
- •13. Строение белков
- •Функции белков
- •16. В состав рибофлавина входит флавин- изоаллоксазиновое кольцо (азотистое основание) и спирт рибитол.
- •Источники витамина в2
- •21. В основе биосинтеза нуклеиновых кислот, как и биосинтеза белков, лежит матричный принцип, т.Е. Новая молекула строится на ранее существующей как ее отпечаток, или реплика.
- •Химические свойства белков
- •2. Денатурация белков.
- •29 К нуклеиновым кислотам относятся две группы веществ:
- •Классификация нуклеиновых кислот.
- •39. Транскрипция — синтез рнк с использованием днк в качестве матрицы. В результате возникает 3 типа рнк:
- •Роль ферментов в организме
- •43 Различают три стадии в механизме ферментативного катализа:
- •49 Третичная структура днк (суперспирализация днк)
- •Третичная структура рнк
16. В состав рибофлавина входит флавин- изоаллоксазиновое кольцо (азотистое основание) и спирт рибитол.
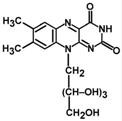
Витамин В2 (рибофлавин) играет большую роль в обмене веществ, росте и развитии организма человека; необходим для нормальной работы нервной системы; повышает активность витамина РР, усвояемость витамина В6 и пантотеновой кислоты; способствует сохранению функций органов зрения и поддержанию нормального тонуса сосудистой системы; в частности капилляров.
Витамин В2 (рибофлавин), входя в состав ряда ферментов, участвует в углеводном и белковом обмене, а также в регулировании тканевого дыхания.
Источники витамина в2
Витамин В2 содержится в мясе, фасоли, горохе. Овощи и фрукты являются дополнительными источниками поступления этого витамина в организм.
Источники витамина В2: сыр, гречневая крупа, тощее мясо, яйца (особенно желток), хлеб ржаной и из пшеничной муки грубого помола, фасоль, горох. Этот витамин имеется мясных и молочных продуктах, особенно в свежем твороге. Много этого витамина в пивных дрожжах. Витамин В2 синтезируется кишечными бактериями.
17. Распад жиров наиболее интенсивно протекает при: прорастании семян масличных растений. Эти семена содержат очень мало углеводов, и основными запасными веществами в. Жиры отличаются от углеводов или белков не только тем, что-при их окислении освобождается значительно больше энергии, но также и тем, что при окислении жиров выделяется повышенное количество воды. Если при окислении 1 г белков образуется 0 41 г воды, при окислении 1 г углеводов - - 0 55 г, то при окислении 1 г жиров-1 07 г. Это имеет большое значение для развивающегося зародыша, особенно при прорастании семян в засушливых условиях. [1]
Распад жира может происходить как в аэробных, так и анаэробных условиях. Наиболее энергичными разрушителями жира являются некоторые неспороносные палочки, например Pseu-domonas iluorescens. Многие плесени также весьма быстро гилролизуют жир. Этим свойством обладают Oidium lar. [2]
Различная интенсивность распада жиров, углеводов и белков приводит к изменению доли участия их в газообразовании, при этом доля участия жиров, как правило, снижается за счет увеличения доли участия белков, что оказывает прямое влияние на изменение состава газа и иловой жидкости. [3]
На этой стадии распада жиров в продуктах появляются не свойственные им вкус и запах, например альдегиды и кетоны сообщают жиру прогорклый вкус, кетоны вызывают специфический запах. [4]
Наибольшая масса газа образуется при распаде жиров, наименьшая - при распаде белков. Поскольку в составе активного ила преобладают белки, выход газа при его сбраживании оказывается меньшим, чем при сбраживании осадка из первичных отстойников.
18 Нуклеопротеины состоят из белков и нуклеиновых кислот. Последние рассматриваются как простетические группы. В природе обнаружено 2 типа нуклеопротеинов, отличающихся друг от друга по составу, размерам и физико-химическим свойствам,– дезоксирибонуклеопротеины (ДНП) и рибонуклеопротеины (РНП). Названия нуклеопротеинов отражают только природу углеводного компонента (пентозы), входящего в состав нуклеиновых кислот. У РНП углевод представлен рибозой, у ДНП – дезоксирибозой. Термин «нуклеопротеины» связан с названием ядра клетки, однако ДНП и РНП содержатся и в других субклеточных структурах. Следовательно, речь идет о химически индивидуальном классе органических веществ, имеющих своеобразные состав, структуру и функции независимо от локализации в клетке. Доказано, что ДНП преимущественно локализованы в ядре, а РНП – в цитоплазме. В то же время ДНП открыты в митохондриях, а в ядрах и ядрышках обнаружены также высокомолекулярные РНП.
Пристальное внимание исследователей привлечено к структуре и функции макромолекул, включающих комплексы белков и нуклеиновых кислот. Этот особый интерес вызван тем, что многообразие проявлений жизни непосредственно связано с этими полимерными молекулами. Биохимики имеют достаточно оснований для утверждения, что природа синтезированных в клетках белков зависит в первую очередь от природы ДНП, точнее ДНК, а свойства живых организмов, как и структурная организация субклеточных органелл, клеток и целостного организма, определяются свойствами синтезированных белков.
ДНК хранит наследственную информацию. Подтверждением этого служит явление трансформации, наблюдаемое у бактерий и открытое также в культуре клеток человека. Сущность явления заключается в превращении одного генетического типа клеток в другой путем изменения природы ДНК. Так, удалось получить штамм капсулированных и вирулентных пневмококков из исходного штамма, не обладающего этими признаками, путем внесения в среду ДНК, выделенной из капсулированного (и вирулентного) штамма. С нуклеопротеинами и соответственно нуклеиновыми кислотами непосредственно связаны, кроме того, такие биологические процессы, как митоз, мейоз, эмбриональный и злокачественный рост и др.
У большинства клеток эукариот, когда ядро находится в интерфазе, из ДНК и белковых молекул образуются так называемые филаменты – нити, имеющие меняющуюся толщину (в среднем около 10 нм, реже 2 нм). Оказывается, что толщина филаментов определяется наличием или отсутствием белков, окружающих двухспиральную структуру ДНК, а длина их – молекулярной массой ДНК. Известно, что одна хромосома содержит одну молекулу ДНК, имеющую длину несколько сантиметров. Вообще ДНП входит в состав мононуклеосом, являющихся составной частью хромосомы. Таким образом, в состав хроматина входят молекула ДНК, пять различных классов белков – гистонов и так называемые негистоновые белки.
19 Третичной структурой белка называется способ укладки полипептидной цепи в пространстве. По форме третичной структуры белки делятся в основном на глобулярные и фибриллярные. Глобулярные белки чаще всего имеют эллипсовидную форму, а фибриллярные (нитевидные) белки — вытянутую (форма палочки, веретена).
Однако конфигурация третичной структуры белков еще не дает основания думать, что фибриллярные белки имеют только β-структуру, а глобулярные α-спиральные. Есть фибриллярные белки, имеющие спиральную, а не слоисто-складчатую вторичную структуру. Например, α-кератин и парамиозин (белок запирательной мышцы моллюсков), тропомиозины (белки скелетных мышц) относятся к фибриллярным белкам (имеют палочковидную форму), а вторичная структура у них — α-спираль; напротив, в глобулярных белках может быть большое количество β-структур.
Спирализация линейной полипептидной цепи уменьшает ее размеры примерно в 4 раза; а укладка в третичную структуру делает ее в десятки раз более компактной, чем исходная цепь.
Связи, стабилизирующие третичную структуру белка. В стабилизации третичной структуры играют роль связи между боковыми радикалами аминокислот. Эти связи можно разделить на:
сильные (ковалентные)
слабые (полярные и ван-дер-ваальсовы)
Многочисленные связи между боковыми радикалами аминокислот определяют пространственную конфигурацию белковой молекулы.
Особенности организации третичной структуры белка. Конформация третичной структуры полипептидной цепи определяется свойствами боковых радикалов входящих в нее аминокислот (которые не оказывают заметного влияния на формирование первичной и вторичной структур) и микроокружением, т. е. средой. При укладке полипептидная цепь белка стремится принять энергетически выгодную форму, характеризующуюся минимумом свободной энергии. Поэтому неполярные R-группы, "избегая" воды, образуют как бы внутреннюю часть третичной структуры белка, где расположена основная часть гидрофобных остатков полипептидной цепи. В центре белковой глобулы почти нет молекул воды. Полярные (гидрофильные) R-группы аминокислоты располагаются снаружи этого гидрофобного ядра и окружены молекулами воды. Полипептидная цепь причудливо изгибается в трехмерном пространстве. При ее изгибах нарушается вторичная спиральная конформация. "Ломается" цепь в слабых точках, где находятся пролин или гидроксипролин, поскольку эти аминокислоты более подвижны в цепи, образуя только одну водородную связь с другими пептидными группами. Другим местом изгиба является глицин, R-группа которого мала (водород). Поэтому R-группы других аминокислот при укладке стремятся занять свободное пространство в месте нахождения глицина. Ряд аминокислот - аланин, лейцин, глутамат, гистидин - способствуют сохранению устойчивых спиральных структур в белке, а такие, как метионин, валин, изолейцин, аспарагиновая кислота, благоприятствуют образованию β-структур. В молекуле белка с третичной конфигурацией встречаются участки в виде α-спиралей (спирализованные), β-структур (слоистые) и беспорядочного клубка. Только правильная пространственная укладка белка делает его активным; нарушение ее приводит к изменению свойств белка и потере биологической активности.
20. Углеводы или, как их часто называют, сахара являются первыми синтезируемыми в процессах фотосинтеза или хемосинтеза органическими веществами, а затем в процессе биохимических превращений участвуют в создании других органических веществ.
Химический состав - это углерод, водород, кислород. Пространственная структура определяется сложностью молекулы.
Классифицируются углеводы на 3 группы:
моносахариды или монозы, иногда их называют - простые сахара.
олигосахариды,
полисахариды или полиозы.
Моносахара - это простые молекулы с числом атомов углерода от 2 до 7. В соответствии с этим она называются: биозы, триозы, тетрозы, пентозы, гексозы, гептозы. Первые три - имеют линейную структуру молекул, последние - циклическую. Наиболее известный представитель моноз - глюкоза. Монозы легко растворяются в воде, легко вступают в биохимические реакции. Общая формула моноз (СН2О) п.
Олигосахара - это относительно простые молекулы, состоящие всего из 2-3 молекул моноз. Они не имеют собственной классификации, названия молекул - тривиальны. Наиболее известный представитель олигосахаридов - сахароза. Олигосахариды легко растворяются в воде, участвуют в реакциях синтеза более сложных сахаров.
Полисахариды - это биополимеры, т.е. сложные молекулы, состоящие из большого количества простых сахаров. Процесс синтеза этих молекул достаточно сложен и будет нами изучен в седьмом разделе курса. Пространственная структура полисахаридов сложна, эти молекулы нерастворимы в воде. Наиболее известные представители полисахаридов - крахмал, гликоген, клетчатка или гемицеллюлоза, пектины.
Функции углеводов:
энергетическая,
строительная,
запасающая.
