
- •Запись уравнений горения веществ на воздухе
- •2)Диффузионное и кинетическое горение
- •3)Температурные пределы воспламенения жидкости. Температура вспышки.
- •4)Современная теория окисления-восстановления.
- •5)Скорость выгорания жидкостей
- •16. Классификация пожароопасных веществ.
- •17. Состав и свойства твёрдых горючих веществ.
- •18. Пожар. Пожарная опасность. Показатели пожарной опасности веществ.
- •19. Горение древесины.
- •20. Процесс горения. Условия, необходимые для возникновения горения.
- •21. Методы определения концентрационных пределов распространения пламени.
- •22. Скорость химической реакции. Зависимость Аррениуса. Энергия активации.
- •23. Горение металлов.
- •24. Факторы влияющие на скорость химической реакции.
- •25. Взрыв. Характерные особенности возникновения и развития.
- •26. Превращение твёрдых горючих веществ при нагревании.
- •27. Химический взрыв.
- •28. Цепная теория горения. Теория н.Н. Семенова и его учеников.
- •29. Физический взрыв.
- •31) Дефлаграция (вспышка) при взрыве.
- •32Температура самовоспламенения
- •33. Детонация.
- •34. Закон Гесса.
- •35. 1Й закон термодинамики (первое начало термодинамики).
- •36. Основные положения мктг.
- •37) Давление, температура, энтальпия и внутренняя энергия
- •38 Цель и задачи Дисциплины «теория горения и взрыва».
- •39. Основные физико-химические свойства горючих газов.
- •40. Основные газовые законы.
- •41. Реакции горения и их тепловой эффект. Тепловой механизм.
- •42. Расчет давления при взрыве газов.
- •43. Распространение пламени в ламинарном потоке.
- •44. Распространение пламени в турбулентном потоке.
- •45) Процесс возгорания и воспламенения
- •46)Ударная волна, ее параметры. Энергия и мощность взрыва.
- •48)Минимальная энергия зажигания.
- •52)Параметры взрыва и его последствия.
- •54)Взрыв газо- и паро-воздушной смеси.
- •55)Теория горения газовых смесей.Давление взрыва
- •56)Конденсированный взрыв.
- •57)Концетрационные пределы распространения пламени.
- •58)Осколочное действие взрыва.
- •59)Факторы, влияющие на концетрационные пределы воспламенения.
- •60)Тепловое воздействие взрыва.
21. Методы определения концентрационных пределов распространения пламени.
Концентрационные пределы распространения пламени (воспламенения) – нижний (НКПР), верхний (ВКПР). НКПР, ВКПР – минимальное (максимальное) содержание горючего вещества в однородной смеси с окислительной средой, при котором возможно распространение пламени
по смеси на любое расстояние от источника зажигания.
Сущность метода экспериментального определения концентрационных пределов распространения пламени заключается в зажигания газо-воздушной смеси заданной концентрации в объеме реакционного сосуда и установления факта наличия или отсутствия распространения пламени. Изменяя конценрацию горючего в смеси, устанавливают её минимальное и максимальное значение, при которых происходит распространение пламени.
НКПРП – это минимальная конценрация горючего вещества в смеси, при котором возможно воспламенение и горение смеси.
ВКПРП называется максимальная конценрация горючего вещества в смеси при которой смесь может воспламеняться и гореть.
При концентрации вещества ниже нижнего предела и выше верхнего предела пламени смесь не горючая.
Например, для метана CH4 концентрационные пределы распространения пламени составляют НКПР – 5 об. %, а ВКПР – 15 об. % (см. табл. Х приложения), для аммиака NH3 НКПР – 15 об. %, а ВКПР – 28 об. %. Скорость распространения пламени и его температура минимальны в предельных смесях, т.е. при концентрациях горючего, равных НКПР и ВКПР.
КПРП могут быть вычислены по эмпирической зависимости:
Yг = 100/an+b
a и b – экспериментальные коэффициенты
n – количество молей кислорода в стехиометрическом уравнении реакции
a и b имеют след. значения:
для НКПРП:
a = 8,684
b = 4,679
для ВКПРП:
если n ≤ 7,5 то a = 1,550 b = 0,560
если n > 7,5 то a = 0,768 b = 6,554
22. Скорость химической реакции. Зависимость Аррениуса. Энергия активации.
Закон действующих масс выражает зависимость скорости реакции от концентрации реагирующих веществ. При P и T-const или при V и T-const скорость хим. р-ции в однородной среде пропорциональна произведению [ ] реагир-их в-в.
Скорость химической реакции – это изменение количества реагирующего вещества или продукта реакции за единицу времени в единице объема (для гомогенной реакции) или на единице поверхности раздела фаз (для гетерогенной реакции).
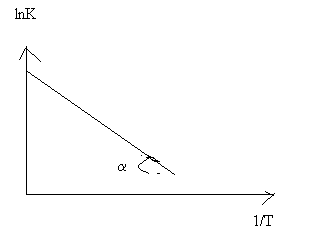
Зависимость скорости реакции от T Скорость гомогенной так и гетерогенной при Р-const зависит от температуры и концентрации реагирующих веществ. С ростом температуры – скорость химической р-ции очень быстро возрастает. Константа скорости реакции- K- характериз. собой ск-ть хим. реакции при данной T. След-но чтобы определить ск-ть ракции горения от Т достаточно опред. К- эта зав-ть устан-ся законом Аррениуса lnk = lnk0 – E/RT
 Выражение
Аррениуса.
Const
скорости р-ции – k – характерез. соб-ной
скорости хим.р-ции при данной тем-ры, =>
чтобы опред-ть завис-ть скорости р-ции
горения от тем-ры достаточно определ.
k – эта зависимость устанав-ся з-ом
Аррениуса:
lnk = lnk0 –
E/RT lnk~(1/T)
k = k0exp(E/RT) = k0e-(E/RT), где
k0 –
предэкспонента; Для бимолекулярной
реакций К0=полному числу двойных
соударений
^ E –
эн-ия активации;
R –
универсальн. газовая пост.;
T –
абсолютная тем-ра.
Чем выше Е
актив-ции, тем
зав-ть ск-ти хим. реакции от Т. Чем
Е актив. тем
зав-ть.
Выражение
Аррениуса.
Const
скорости р-ции – k – характерез. соб-ной
скорости хим.р-ции при данной тем-ры, =>
чтобы опред-ть завис-ть скорости р-ции
горения от тем-ры достаточно определ.
k – эта зависимость устанав-ся з-ом
Аррениуса:
lnk = lnk0 –
E/RT lnk~(1/T)
k = k0exp(E/RT) = k0e-(E/RT), где
k0 –
предэкспонента; Для бимолекулярной
реакций К0=полному числу двойных
соударений
^ E –
эн-ия активации;
R –
универсальн. газовая пост.;
T –
абсолютная тем-ра.
Чем выше Е
актив-ции, тем
зав-ть ск-ти хим. реакции от Т. Чем
Е актив. тем
зав-ть.
Энергия активации
Скорость химической реакции зависит от энергии ее активации. Эта энергия необходима для эффективного соударения молекул (частиц), приводящего к их взаимодействию.
Энергия активации (Еа) - энергия, необходимая для достижения системой переходного состояния, называемого активированным (или переходным) комплексом, который превращается в продукты реакции уже самопроизвольно .
Энергия активации Еа равна разности энергий переходного и исходного состояний:
Еа = Еперех.сост. - Еисх.сост.
Чем меньше энергия активации реакции, тем выше ее скорость. Эта зависимость выражается уравнением Аррениуса, которое связывает константу скорости реакции k сЕа:
![]()
где A – предэкспоненциальныи множитель (размерность совпадает с размерностью к), Еа -энергия активации, обычно принимающая положит. значения, Т-абс. температура, k-постоянная Больцмана. Принято приводить Еа в расчете не на одну молекулу. а на число частиц NA = 6,02*1023 (постоянная Авогадро) и выражать в кДж/моль; в этих случаях в уравнении Аррениуса величину k заменяют газовой постоянной R. График зависимости 1nк от 1/kT (аррениусов график) – прямая линия, отрицательный наклон которой определяется энергией активации Еа и характеризует положит. температурную зависимость к.
