
- •Запись уравнений горения веществ на воздухе
- •2)Диффузионное и кинетическое горение
- •3)Температурные пределы воспламенения жидкости. Температура вспышки.
- •4)Современная теория окисления-восстановления.
- •5)Скорость выгорания жидкостей
- •16. Классификация пожароопасных веществ.
- •17. Состав и свойства твёрдых горючих веществ.
- •18. Пожар. Пожарная опасность. Показатели пожарной опасности веществ.
- •19. Горение древесины.
- •20. Процесс горения. Условия, необходимые для возникновения горения.
- •21. Методы определения концентрационных пределов распространения пламени.
- •22. Скорость химической реакции. Зависимость Аррениуса. Энергия активации.
- •23. Горение металлов.
- •24. Факторы влияющие на скорость химической реакции.
- •25. Взрыв. Характерные особенности возникновения и развития.
- •26. Превращение твёрдых горючих веществ при нагревании.
- •27. Химический взрыв.
- •28. Цепная теория горения. Теория н.Н. Семенова и его учеников.
- •29. Физический взрыв.
- •31) Дефлаграция (вспышка) при взрыве.
- •32Температура самовоспламенения
- •33. Детонация.
- •34. Закон Гесса.
- •35. 1Й закон термодинамики (первое начало термодинамики).
- •36. Основные положения мктг.
- •37) Давление, температура, энтальпия и внутренняя энергия
- •38 Цель и задачи Дисциплины «теория горения и взрыва».
- •39. Основные физико-химические свойства горючих газов.
- •40. Основные газовые законы.
- •41. Реакции горения и их тепловой эффект. Тепловой механизм.
- •42. Расчет давления при взрыве газов.
- •43. Распространение пламени в ламинарном потоке.
- •44. Распространение пламени в турбулентном потоке.
- •45) Процесс возгорания и воспламенения
- •46)Ударная волна, ее параметры. Энергия и мощность взрыва.
- •48)Минимальная энергия зажигания.
- •52)Параметры взрыва и его последствия.
- •54)Взрыв газо- и паро-воздушной смеси.
- •55)Теория горения газовых смесей.Давление взрыва
- •56)Конденсированный взрыв.
- •57)Концетрационные пределы распространения пламени.
- •58)Осколочное действие взрыва.
- •59)Факторы, влияющие на концетрационные пределы воспламенения.
- •60)Тепловое воздействие взрыва.
1.Уравнение
реакции горения вещества в воздухе…..Горением
называется сложный физико-химический
процесс, представляющий собой
окислительно-восстановительную реакцию
между горючим веществом и окислителем,
сопровождающийся выделением тепла и
излучением света. Горючее вещество
в процессе реакции окисляется, образуя
продукты окисления. Окислителем
называется вещество, атомы (молекулы)
которого способны присоединять валентные
электроны в процессе реакции. Окислитель
в ходе реакции восстанавливается. В
условиях пожара горение чаще всего
протекает в среде воздуха. При составлении
уравнения материального баланса
процессов горения принято учитывать
не только кислород, принимающий участие
в реакции окисления, но и азот, входящий
в состав воздуха. Воздух состоит из
азота, кислорода, водорода, углекислого
газа и инертных газов. Поэтому можно
принять, что воздух состоит из 21 %
кислорода и 79 % азота. Таким образом,
объёмное (и мольное) соотношение азота
и кислорода в воздухе составит
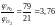
где
 ,
,
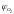 - содержание азота и кислорода в объёмных
процентах в окислительной среде.
Следовательно, на 1 м3
(1 кмоль) кислорода, в воздухе приходится
3,76 м3
(3,76 кмоль) азота. При составлении уравнений
реакций горения веществ на воздухе
состав воздуха передают формулой
(O2
+ 3,76N2).
- содержание азота и кислорода в объёмных
процентах в окислительной среде.
Следовательно, на 1 м3
(1 кмоль) кислорода, в воздухе приходится
3,76 м3
(3,76 кмоль) азота. При составлении уравнений
реакций горения веществ на воздухе
состав воздуха передают формулой
(O2
+ 3,76N2).
Запись уравнений горения веществ на воздухе
Обобщённая запись брутто-уравнения материального баланса реакции горения имеет вид:
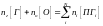
При составлении уравнения материального баланса процессов горения принято учитывать не только кислород, принимающий участие в реакции окисления, но и азот, входящий в состав воздуха. В реакции горения принимает участие только кислород. Азот в реакцию не вступает и выделяется из зоны горения вместе с продуктами горения. Таким образом, уравнение горения вещества на воздухе принимает вид:
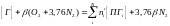 ,
,
где
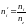 .
Азот, входивший в состав воздуха,
учитывается отдельно от остальных
продуктов реакции.
.
Азот, входивший в состав воздуха,
учитывается отдельно от остальных
продуктов реакции.
Пример:C3H8///Брутто уровнение реакции окисления.
C3H8+5O2+5*3,76N2=3Co2+4H2O+5*3,76N2
Объем воздуха:Vв=n(o2)+n(N2)/n(г), к.моль/к.моль
n(o2)-количество молей кислорода, n(N2)-азота, n(г)-горючего вещества.
2)Диффузионное и кинетическое горение
Диффузионное горение- горение не перемешанных газо-, паровоздушных смесей с воздухом. Оно свойственно конденсированным горючим веществам жидкостям и твёрдым материалам. Для диффузионного горения характерно наличие светящегося пламени. Различают диффузионное горение следующего вида:
Гомогенное горение-это такое горение когда и горючие вещества и окислители находятся в одном агрегатном состоянии.
Гетерогенное горение- когда компоненты смеси находятся в разных агрегатных состояниях например(тв.горючее вещество и газообразный распылитель)
Диффузионное горение сопровождается, как правило, саже образованием, что характерно для турбулентных факелов, образуемых при горении нефтепродуктов в резервуарах. К диффузионному горению относятся различные очаги пожаров.
Кинетическое горение - называется горение заранее перемешанных горючего газа, пара или пыли с окислителем. В этом случае скорость горения зависит только от физико-химических свойств горючей смеси (теплопроводности, теплоемкости, турбулентности, концентрации веществ, давления и т.п.). Поэтому скорость горения резко возрастает. Такой вид горения присущ взрывам.В данном случае при поджигании горючей смеси в какой-либо точке фронт пламени движется от продуктов сгорания в свежую смесь. Таким образом, пламя при кинетическом горении чаще всего не стационарно
Т(горения)+Т(кипения)=Тг
Т(горения)-меньше- Т(кипения)-кинетическое горение
Т(горения) -больше -Т(кипения)= диффузионное горение
3)Температурные пределы воспламенения жидкости. Температура вспышки.
Температурные пределы воспламенения жидкости:
Наименьшая температура жидкости, при которой она загорается и продолжает гореть при поднесении источника воспламенения, называется температурой воспламенения. За температуру воспламенения принимают температуру, при которой жидкость продолжает гореть в течение не менее 5 с после удаления пламени газовой горелки. Под горючей жидкостью (ГЖ) понимают жидкость, способную самостоятельно гореть после удаления
Легковоспламеняющаяся жидкость (ЛВЖ) - это жидкость, способная самостоятельно гореть после удаления источника зажигания и имеющая температуру вспышки не выше +61° С (в закрытом тигле) или +66° С (в открытом тигле).
Температура жидкости, при которой концентрация насыщенных паров в воздухе в замкнутом объеме способна воспламениться при воздействии источника зажигания, называется нижним температурным пределом воспламенения. Температура жидкости, при которой концентрация насыщенных паров в воздухе в замкнутом объеме еще может воспламениться при воздействии источника зажигания, называется верхним температурным пределом воспламенения.
Температура вспышки:
Все горючие жидкости способны испаряться, и горение их происходит только в паровой фазе, находящейся над поверхностью жидкости. Количество паров зависит от состава и температуры жидкости. Горение паров в воздухе возможно лишь при определенной их концентрации.
Наименьшая температура жидкости, при которой концентрация ее паров в смеси с воздухом обеспечивает воспламенение смеси от открытого источника зажигания без последующего устойчивого горения, называется температурой вспышки. При температуре вспышки не возникает стабильного горения, поскольку при этой температуре концентрация смеси паров жидкости с воздухом не является устойчивой, что необходимо для такого горения. Количество тепла, выделенного при вспышке, недостаточно для продолжения горения, а вещество еще недостаточно нагрето. Для того чтобы воспламенить жидкость, нужен не кратковременный, а длительно действующий источник зажигания, температура которого была бы выше температуры самовоспламенения смеси паров этой жидкости с воздухом.
