
- •Механическое движение тела. Понятие материальной точки. Путь и перемещение тела. Система отсчёта. Относительность механического движения.
- •Виды механического движения тела. Понятие скорости. Ускорение.
- •Вопрос 3
- •Вопрос 4
- •Вопрос 5
- •Вопрос 6
- •Вопрос 7
- •Закон Гука в простейшем случае одномерных малых упругих деформаций формула для силы упругости имеет вид:
- •Вопрос 8
- •Виды трения
- •Определение коэффициента трения
- •Коэффициент трения покоя
- •Коэффициент трения скольжения
- •Вопрос 9
- •Импульс тела — это физическая векторная величина, равная произведению массы тела на его скорость
- •Вопрос 10
- •Механическая работа
- •Абсолютная шкала температур
- •Коэффициент полезного действия тепловых двигателей
- •Эдс индукции
- •Первый закон Кирхгофа.
- •Надо знать !
- •Колебания нитяного маятника
- •Книжная полка
- •Маятник фуко в парижском пантеоне
- •Сделай модель маятника фуко сам !
- •Крутильный маятник
- •Сделай крутильный маятник сам!
- •Знаешь ли ты ?
- •Переменный электрический ток
- •Работа и мощность переменного тока
- •Полосы равного наклона
- •Интерференция от клина. Полосы равной толщины
- •Кольца Ньютона
- •Дифракция на щели [править]
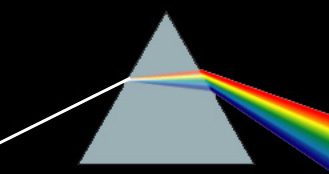
- •Свойства световых лучей. Призматический и дифракционный спектры
Свойства световых лучей. Призматический и дифракционный спектры
Тщательные и всесторонние исследования прохождения световых лучей сквозь кристаллы убедили ученых, что световые колебания – это колебания поперечные, подобные колебаниям каучуковой трубки или поверхности моря.
|
Призматический спектр |
|
Дифракционный спектр |
Обращаясь к размерам световых волн и числу колебаний в секунду, мы погружаемся в область чисел, совершенно недоступных нашему воображению. Наблюдая над явлениями, происходящими при прохождении света сквозь узкие отверстия, именно над так называемой «дифракцией» световых лучей, ученые пришли к выводу, что длины волн в световом луче измеряются десятитысячными долями миллиметра или десятыми долями микрона (1 мкм = 0,001 мм).
Скорость света определяли разными способами. Впервые ее узнали из астрономических наблюдений, где было замечено время, нужное для того, чтобы луч света от спутника Юпитера пробежал расстояние, равное диаметру земной орбиты (способ Реомюра). Позднее – из непосредственного определения промежутков времени, в которое свет пробегал определенное расстояние на земной поверхности (способы Физо и Фуко). В результате ученые пришли к выводу, что эта скорость в круглых числах выражается 300 000 000 м/с.
По двум данным (скорости и длине волны) нетрудно вычислить число колебаний в секунду. Они измеряются сотнями биллионов (принимая биллион, по немецкому счислению, равным миллиону миллионов) или сотнями триллионов (принимая, по французскому счислению, 1 биллион = 1 миллиард = 1000 миллионов, а триллион = 1000 биллионов).
Световые лучи могут вызывать не только световое действие, но также тепловое и химическое. Свойства лучей были обнаружены при изучении их спектров: призматического и дифракционного. Разлагая пучок белых лучей света призмой, мы получаем «призматический» семицветный спектр. Растянутость спектра получается из-за различной способности лучей преломляться. Более всего преломляются фиолетовые, менее всего – красные лучи.
Оказывается, что каждому из различно преломленных лучей спектра, как и каждому тону в музыке, соответствуют определенное число колебаний в секунду и определенная величина длины волны и что наш глаз, подобно уху, чувствителен лишь к весьма ограниченному числу колебаний.
Дифракционный спектр получается при прохождении света сквозь большое число малых отверстий и щелей. Одно из отличий дифракционного спектра от призматического заключается в том, что в дифракционном спектре отклонение лучей строго пропорционально длине волны. Фиолетовые лучи, как обладающие наиболее короткими волнами, отклонены наименее, а красные, как обладающие наиболее длинными волнами, отклонены наиболее. В призматическом спектре, наоборот, наиболее отклонены фиолетовые лучи. Другое отличие заключается в том, что дифракционный спектр наиболее растянут в сторону красных лучей, а призматический в сторону фиолетовых.
Билет 65
Название диапазона |
Длина
волны, |
Частота, v |
Источники излучения |
|
||||||||||||||||
Низкочастотное излучение |
свыше 10 000 м |
менее 30 кГц |
Электротехнические приборы. Переменные токи низкой частоты |
|
||||||||||||||||
|
|
|
Атмосферные явления. Переменные токи в проводниках и колебательных контурах |
|
||||||||||||||||
Инфракрасное излучение |
1 мм 780 нм |
300 ГГц 429 ТГц |
Излучение молекул и атомов при тепловых и электрических взаимодействиях |
|
||||||||||||||||
Видимый свет |
780 380 нм |
429 750 ТГц |
|
|||||||||||||||||
Ультрафиолетовое излучение |
380 10 нм |
7.5 *1014 3*1016 Гц |
Излучение атомов под действием ускоренных электронов |
|
||||||||||||||||
Рентгеновское излучение |
10 5 * 10-3 нм |
3 * 1016 6 * 1019 Гц |
Атомные процессы под действием ускоренных заряженных частиц |
|
||||||||||||||||
Гамма-излучение |
менее 5 * 10-3 нм |
свыше 6 * 1019 Гц |
Ядерные и космические процессы, радиоактивный распад |
|
Ультрафиоле́товое излуче́ние (ультрафиолет, УФ, UV) — электромагнитное излучение, занимающее диапазон между фиолетовой границей видимого излучения и рентгеновским излучением (10 — 380 нм, 7,9·1014 — 3·1016 Герц).ъ
Инфракра́сное излуче́ние — электромагнитное излучение, занимающее спектральную область между красным концом видимого света (с длиной волны[1] λ = 0,74 мкм) и микроволновым излучением (λ ~ 1—2 мм).
Оптические свойства веществ в инфракрасном излучении значительно отличаются от их свойств в видимом излучении. Например, слой воды в несколько сантиметров непрозрачен для инфракрасного излучения с λ = 1 мкм. Инфракрасное излучение составляет большую часть излучения ламп накаливания, газоразрядных ламп, около 50 % излучения Солнца; инфракрасное излучение испускают некоторые лазеры. Для его регистрации пользуются тепловыми и фотоэлектрическими приёмниками, а также специальными фотоматериалами[2].
Сейчас весь диапазон инфракрасного излучения делят на три составляющих:
коротковолновая область: λ = 0,74—2,5 мкм;
средневолновая область: λ = 2,5—50 мкм;
длинноволновая область: λ = 50—2000 мкм;
Последнее время длинноволновую окраину этого диапазона выделяют в отдельный, независимый диапазон электромагнитных волн — терагерцовое излучение (субмиллиметровое излучение).
Инфракрасное излучение также называют «тепловым» излучением, так как инфракрасное излучение от нагретых предметов воспринимается кожей человека как ощущение тепла. При этом длины волн, излучаемые телом, зависят от температуры нагревания: чем выше температура, тем короче длина волны и выше интенсивность излучения. Спектр излучения абсолютно чёрного тела при относительно невысоких (до нескольких тысяч Кельвинов) температурах лежит в основном именно в этом диапазоне. Инфракрасное излучение испускают возбуждённые атомы или ионы.
Рентге́новское излуче́ние — электромагнитные волны, энергия фотонов которых лежит на шкале электромагнитных волн между ультрафиолетовым излучением и гамма-излучением, что соответствует длинам волн
от 10−2 до 103 Å (от 10−12 до 10−7
билет 66
Теплово́е излуче́ние или лучеиспускание — передача энергии от одних тел к другим в виде электромагнитных волн за счёт их тепловой энергии. Тепловое излучение в основном приходится на инфракрасный участок спектра, т.е на длины волн от 0,74 мкм до 1000 мкм. Отличительной особенностью лучистого теплообмена является то, что он может осуществляться между телами, находящимися не только в какой-либо среде, но и вакууме.
Примером теплового излучения является свет от лампы накаливания.
Мощность теплового излучения объекта, удовлетворяющего критериям абсолютно чёрного тела, описывается законом Стефана — Больцмана.
Отношение излучательной и поглощательной способностей тел описывается законом излучения Кирхгофа.
Тепловое излучение является одним из трёх элементарных видов переноса тепловой энергии (помимо теплопроводности и конвекции).
Равновесное излучение — тепловое излучение, находящееся в термодинамическом равновесии с веществом.
Тела, нагретые до достаточно высоких температур, светятся. Свечение тел, обусловленное нагреванием, называется тепловым (температурным) излучением. Тепловое излучение, являясь самым распространенным в природе, совершается за счет энергии теплового движения атомов и молекул вещества (т. е. за счет его внутренней энергии) и свойственно всем телам при температуре выше 0 К. Тепловое излучение характеризуется сплошным спектром, положение максимума которого зависит от температуры. При высоких температурах излучаются короткие (видимые и ультрафиолетовые) электромагнитные волны, при низких — преимущественно длинные (инфракрасные).
Тепловое излучение — практически единственный вид излучения, который может быть равновесным. Предположим, что нагретое (излучающее) тело помещено в полость, ограниченную идеально отражающей оболочкой. С течением времени, в результате непрерывного обмена энергией между телом и излучением, наступит равновесие, т. е. тело в единицу времени будет поглощать столько же энергии, сколько и излучать. Допустим, что равновесие между телом и излучением по какой-либо причине нарушено и тело излучает энергии больше, чем поглощает. Если в единицу времени тело больше излучает, чем поглощает (или наоборот), то температура тела начнет понижаться (или повышаться). В результате будет ослабляться (или возрастать) количество излучаемой телом энергии, пока, наконец, не установится равновесие. Все другие виды излучения неравновесны.
Количественной характеристикой теплового излучения служит спектральная плотность энергетической светимости (излучательности) тела — мощность излучения с единицы площади поверхности тела в интервале частот единичной ширины:
![]()
где d![]() —
энергия электромагнитного излучения,
испускаемого за единицу времени
(мощность излучения) с единицы площади
поверхности тела в интервале частот
от до +d.
—
энергия электромагнитного излучения,
испускаемого за единицу времени
(мощность излучения) с единицы площади
поверхности тела в интервале частот
от до +d.
Единица спектральной плотности энергетической светимости (R,T) — джоуль на метр в квадрате (Дж/м2).
Записанную формулу можно представить в виде функции длины волны:
![]()
Так как c=, то
![]()
где знак минус указывает на то, что с возрастанием одной из величин ( или ) другая величина убывает. Поэтому в дальнейшем знак минус будем опускать. Таким образом,
![]() (197.1)
(197.1)
С помощью формулы (197.1) можно перейти от R,T к R,T и наоборот.
Зная спектральную плотность энергетической светимости, можно вычислить интегральную энергетическую светимость (интегральную излучательность)(ее называют просто энергетической светимостью тела), просуммировав по всем частотам:
![]() (197.2)
(197.2)
Способность тел поглощать падающее на них излучение характеризуется спектральной поглощательной способностью
![]()
показывающей, какая доля энергии, приносимой за единицу времени на единицу площади поверхности тела падающими на нее электромагнитными волнами с частотами от до +d, поглощается телом. Спектральная поглощательная способность — величина безразмерная. Величины R,T и А,T зависят от природы тела, его термодинамической температуры и при этом различаются для излучений с различными частотами. Поэтому эти величины относят к определенным Т и (вернее, к достаточно узкому интервалу частот от до +d).
Тело,
способное поглощать полностью при
любой температуре все падающее на него
излучение любой частоты, называется
черным. Следовательно, спектральная
поглощательная способность черного
тела для всех частот и температур
тождественно равна единице (![]() ).
Абсолютно черных тел в природе нет,
однако такие тела, как сажа, платиновая
чернь, черный бархат и некоторые другие,
в определенном интервале частот по
своим свойствам близки к ним.
).
Абсолютно черных тел в природе нет,
однако такие тела, как сажа, платиновая
чернь, черный бархат и некоторые другие,
в определенном интервале частот по
своим свойствам близки к ним.
Идеальной моделью черного тела является замкнутая полость с небольшим отверстием О, внутренняя поверхность которой зачернена (рис. 286). Луч света, попавший внутрь такой полости, испытывает многократные отражения от стенок, в результате чего интенсивность вышедшего излучения оказывается практически равной нулю. Опыт показывает, что при размере отверстия, меньшего 0,1 диаметра полости, падающее излучение всех частот полностью поглощается. Вследствие этого открытые окна домов со стороны улицы кажутся черными, хотя внутри комнат достаточно светло из-за отражения света от стен.

Наряду
с понятием черного тела используют
понятие серого
тела —
тела, поглощательная способность
которого меньше единицы, но одинакова
для всех частот и зависит только от
температуры, материала и состояния
поверхности тела. Таким образом, для
серого тела ![]() =AT = const<l.
=AT = const<l.
Исследование теплового излучения сыграло важную роль в создании квантовой теории света, поэтому необходимо рассмотреть законы, которым оно подчиняется.
Квантовая гипотеза Планка
День рождения квантовых представлений – 14.12.1900. Предварительные результаты были доложены немного раньше – 19 октября 1900 г., когда была доложена работа, в которой выведена новая формула для излучения. Эта работа была опубликована в 1901 г.
Напомню,
что основной энергетической характеристикой
равновесного теплового излучения
является плотность энергии ![]() .
Мы ограничимся излучением абсолютно
чёрного тела, т.е. такого тела, которое
полностью поглощает электромагнитное
излучение, падающее на тело.
.
Мы ограничимся излучением абсолютно
чёрного тела, т.е. такого тела, которое
полностью поглощает электромагнитное
излучение, падающее на тело.
Величина ![]() содержит
вклад электромагнитных волн всех
частот, поэтому
содержит
вклад электромагнитных волн всех
частот, поэтому
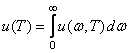 ,
(1)
,
(1)
где ![]() -
спектральная плотность энергии,
-
спектральная плотность энергии, ![]() -
доля плотности энергии, приходящаяся
на интервал частот
-
доля плотности энергии, приходящаяся
на интервал частот ![]() в
окрестности частоты
в
окрестности частоты ![]() ,
, ![]() -
абсолютная температура, при которой
излучение находится в состоянии
равновесия с веществом.
-
абсолютная температура, при которой
излучение находится в состоянии
равновесия с веществом.
Если
имеется тело в полости, ограниченной
замкнутой оболочкой, стенки которой
поддерживаются при ![]() ,
то внутри полости устанавливается
равновесие между телом и электромагнитным
излучением. Пусть оболочка имеет
идеально отражающие стенки. Тело
испускает электромагнитные волны,
которые отражаются стенками оболочки,
падают на тело и поглощаются им. В
состоянии равновесия тело поглощает
в единицу времени столько же энергии,
сколько и отдаёт в виде электромагнитного
излучения (теплового излучения).
,
то внутри полости устанавливается
равновесие между телом и электромагнитным
излучением. Пусть оболочка имеет
идеально отражающие стенки. Тело
испускает электромагнитные волны,
которые отражаются стенками оболочки,
падают на тело и поглощаются им. В
состоянии равновесия тело поглощает
в единицу времени столько же энергии,
сколько и отдаёт в виде электромагнитного
излучения (теплового излучения).
В классической статистической физике доказывается теорема о равномерном распределении энергии молекул по степеням свободы в состоянии теплового равновесия: на каждое электромагнитное колебание приходится в среднем энергия, равная
![]() (2)
(2)
(величина ![]() приходится
на энергию электрического поля и столько
же - на энергию магнитного поля).
Основываясь на этой теореме, легко
вывести следующую формулу:
приходится
на энергию электрического поля и столько
же - на энергию магнитного поля).
Основываясь на этой теореме, легко
вывести следующую формулу:
![]() . (3)
. (3)
Это
формула Релея-Джинса. Она даёт хорошее
согласие с опытом при малых частотах
(при ![]() ,
см. рис.).
,
см. рис.).
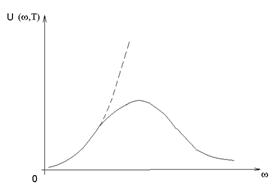
Рис.
Зависимость спектральной плотности
энергии ![]() от
частоты
:
пунктирная кривая отвечает формуле
Релея-Джинса, а сплошная – описывает
экспериментальные данные.
от
частоты
:
пунктирная кривая отвечает формуле
Релея-Джинса, а сплошная – описывает
экспериментальные данные.
Однако
подстановка (3) в (1) приводит к
бесконечности: ![]() .
Этот результат, называемый ультрафиолетовой
катастрофой, означает, что классическая
теория неспособна правильно описать
тепловое излучение.
.
Этот результат, называемый ультрафиолетовой
катастрофой, означает, что классическая
теория неспособна правильно описать
тепловое излучение.
В
поисках выхода из указанного затруднения
Планк предположил, что электромагнитное
излучение испускается и поглощается
телом в виде отдельных порций с
энергией ![]() :
:
![]() . (4)
. (4)
Используя
распределение Больцмана для энергии
электромагнитных колебаний (энергия
колебания составляет ![]() ,
, ![]() )
)
 ,
,
где ![]() -
вероятность того, что энергия
электромагнитного колебания равна
-
вероятность того, что энергия
электромагнитного колебания равна ![]() ,
вычислим среднее значение энергии,
приходящейся на одно колебание:
,
вычислим среднее значение энергии,
приходящейся на одно колебание:
![]() .
.
Расчет дает:
![]() . (5)
. (5)
Отметим,
что формула (5) совпадает с (2) лишь в
классическом пределе, т.е. при
.
Умножая ![]() на
число электромагнитных колебаний в
интервале
и
объёме
на
число электромагнитных колебаний в
интервале
и
объёме ![]() ,
, ![]() ,
получаем формулу Планка:
,
получаем формулу Планка:
![]() , (6)
, (6)
где ![]() Дж
Дж![]() -
квант действия (постоянная Планка).
Оказалось, что формула Планка хорошо
описывает экспериментальные данные.
Эта формула не приводит и к ультрафиолетовой
катастрофе.
-
квант действия (постоянная Планка).
Оказалось, что формула Планка хорошо
описывает экспериментальные данные.
Эта формула не приводит и к ультрафиолетовой
катастрофе.
Фото́н (от др.-греч. φῶς, род. пад. φωτός, «свет») — элементарная частица, квант электромагнитного излучения (в узком смысле — света). Это безмассовая частица, способная существовать только двигаясь со скоростью света.Электрический заряд фотона также равен нулю. Фотон может находиться только в двух спиновых состояниях с проекцией спина на направление движения (спиральностью) ±1. Этому свойству в классической электродинамикесоответствует круговая правая и левая поляризация электромагнитной волны. Фотону как квантовой частице свойственен корпускулярно-волновой дуализм, он проявляет одновременно свойства частицы и волны. В физике фотоны обозначаются буквой γ. С точки зрения Стандартной модели фотон является калибровочным бозоном. Виртуальные фотоны[5] являются переносчиками электромагнитного взаимодействия, таким образом обеспечивая взаимодействие, например, между двумя электрическими зарядами.[6] Фотон — самая распространённая по численности частица во Вселенной. На один нуклон приходится не менее 20 миллиардов фотонов.
Билет67
Внешний фотоэлектрический эффект, открытый в 1887 г. Герцем, был в том же году тщательно исследован А. Г. Столетовым, в работах которого были установлены важнейшие закономерности нового явления. [1]
Внешним фотоэлектрическим эффектом, или фотоэлектронной эмиссией, называют способность металлов эмитировать электроны под действием светового потока, падающего на них. Светочувствительные поверхности в передающих телевизионных трубках называются фотокатодами. [2]
Явления внешнего фотоэлектрического эффекта и вторичной электронной эмиссии составляют основу фотоэлектроники - области, получившей в наши дни широкое научное и техническое применение. [3]
В основе внешнего фотоэлектрического эффекта лежит эмиссия фотоэлектронов под действием падающего излучения. [4]
В рассмотренных фотоэлементах использован внешний фотоэлектрический эффект, о котором шла речь в этой главе. [5]
-
Вспышка свечения ватухающгго ZnS Мп-фосфора под действием электрического иоля напряженности 20000 в /.
Опыты с электропроводностью и с внешним фотоэлектрическим эффектом заставляют связывать возбуждение фосфоресценции с полным отделением электрона от центра, поглотившего свет. [6]
В рассмотренных фотоэлементах использован так называемый внешний фотоэлектрический эффект, о котором шла речь в этой главе. [7]
Во всех передающих трубках, работающих с внешним фотоэлектрическим эффектом, используются полупрозрачные фотокатоды. Исключением является иконоскоп - трубка, в которой использован мозаичный фотокатод. [8]
-
Зависимость коэффициента пропускания интерференционного полосового фильтра ( / и двойного полосового фильтра ( 2 от длины волны 0-макс. 55 мкм. ПВ - полуширина полосы пропускания фильтра.
В фотоэлектрических приемниках поглощенная фотоэлементом энергия излучения вследствие внешнего фотоэлектрического эффекта выбивает электроны в окружающее пространство. У фоторезисторов, фотодиодов и фототранзисторов, благодаря внутреннему фотоэффекту, связанные в кристаллической решетке электроны переходят на более высокий энергетический уровень. [9]
Способность металлов испускать электроны под действием света называется внешним фотоэлектрическим эффектом. При освещении веществ, являющихся изоляторами и полупроводниками, электроны не могут покинуть поверхность вещества, но они получают энергию, достаточную для отрыва от атомов и передвижения внутри вещества. Возрастание проводимости изоляторов и проводников при освещении их светом называется внутренним фотоэлектрическим эффектом. [10]
ЭОП основан на использовании, с одной стороны, внешнего фотоэлектрического эффекта, открытого Халлваксом в 1888 г., и, с другой стороны, на свойствах электронов, которые принято связывать с понятием электронная оптика. [11]
На эти поверхности проецируется оптическое изображение, и за счет внешнего фотоэлектрического эффектапроисходит преобразование оптического изображения в электронное. [12]
В Внутренний фотоэлектрический эффект при возбуждении отсутствует. Устройство диссектора 53. Внутренним фотоэлектрическим эффектом, или фотопроводимостью, называется изменение проводимости полупроводников при изменении интенсивности падающего на них светового потока. Фоторезистивный эффект ( внутренний фотоэлектрический эффект) - это изменение удельного сопротивления полупроводника, обусловленное исключительно действием электромагнитного излучения ( квантов света) и не связанное с нагреванием полупроводника. Сущность этого явления состоит в том, что при поглощении квантов света с энергией, достаточной для ионизации собственных атомов полупроводника или ионизации примесей, происходит увеличение концентрации носителей заряда. В результате увеличения концентрации носителей уменьшается удельное сопротивление полупроводника. В ионных кристаллах также наблюдается внутренний фотоэлектрический эффект, причем энергия отрыва электрона равна ионизационному потенциалу. Без облучения ионные кристаллы, так же как и гомеополяр-ные, электрического тока не проводят. Но, в отличие от гомеополярных, ионные вещества проводят электрический ток в расплаве, где проводимость обусловлена передвижением самих ионов. В ионных кристаллах также наблюдается внутренний фотоэлектрический эффект, причем энергия отрыва электрона раина ионизационному потенциалу. Без облучения ионные кристаллы, так же как и гомео-полярные, электрического тока не проводят. Но, в отличие от гомео-полярных веществ, ионные проводят электрический ток в расплаве; проводимость обусловлена переносом электрических зарядов ионами. В передающих трубках, работающих с внутренним фотоэлектрическим эффектом, принцип накопления световой энергии является существенно отличным от рассмотренного выше. В качестве мишени используются специальные слои, обладающие высокой фотопроводимостью. Форма полного телевизионного сигнала при чересстрочной развертке. В передающих телевизионных трубках используется внешний или внутренний фотоэлектрический эффект. В передающих трубках в качестве поверхностей, обладающих внутренним фотоэлектрическим эффектом, используются слои селена, таллофида и серно-висмутовых соединений. Такие слои называются фотосопротивлениями. Изменение электрического сопротивления полупроводника, обусловленное непосредственным действием излучения, называется фото-резистивным эффектом, или внутренним фотоэлектрическим эффектом. Изменение сопротивления, или проводимости, вызывается изменением концентрации носителей заряда. Изменение электрического сопротивления полупроводника, обусловленное непосредственным действием излучения, называют фоторези-стивным эффектом, или внутренним фотоэлектрическим эффектом. Изменение сопротивления, или проводимости, вызывают изменением концентрации носителей заряда. Исследовалась фотопроводимость слоев органических красителей толщиной 0.5 - 10 мкм в полях с напряженностью до 5000 в / см. Внутренний фотоэлектрический эффект в таких слоях наблюдался в области спектра поглощения раствора красителя. Темновая проводимость § 0 10 - 10 ом 1 и не изменяется до 80 С. Изучение электрических свойств показало, что группа высокопроводящих халькогенидных стекол по ряду таких признаков, как температурная зависимость электропроводности, большие значения термоэлектродвижущей силы и в особенности внутренний фотоэлектрический эффект, являются типичными электронными полупроводниками с дырочным механизмом проводимости. Таким, образом, халькогенидные стекла являются весьма интересной группой веществ, в которой сочетаются свойства как стекол, так и кристаллических тел полупроводников. Это, несомненно, интересно как в научном, так и в практическом отношениях. Для объяснения влияния статического давления мы использовали общепринятые представления о природе и механизме образования скрытого изображения, развитые Герни и Моттом [5, 6] в 1930 г. Согласно этим авторам, фотохимический процесс состоит из двух раздельных стадий. Первая представляет внутренний фотоэлектрический эффект с последующей миграцией фотоэлектрона к центру светочувствительности, который захватывает этот электрон. Вторая стадия представляет процесс электролитической проводимости, при котором междуузельный ион серебра движется к центру светочувствительности и нейтрализует его, образуя атом серебра. Последняя стадия, повидимому, более чувствительна к внешним влияниям. Поэтому в качестве рабочей гипотезы мы предположили [4, 7, 8], что действие статического давления обусловлено обратимым влиянием давления на электролитическую проводимость бромистого серебра. Следовательно, с увеличением давления проводимость должна уменьшаться. Смит, 1873) состоит из изменений проводимости полупроводника под воздействием излучения. В основе фотопроводимости лежит внутренний фотоэлектрический эффект - переход электронов из связанных состояний в свободные при поглощении квантов излучения. Некоторые полупроводники и диэлектрики становятся проводниками или увеличивают свою проводимость при освещении. Причина фотопроводимости кроется во внутреннем фотоэлектрическом эффекте - электроны освобождаются не около поверхности освещаемого тела, прорываясь через нее наружу, а г о внутренних слоях, перенося электричество при своем движении. Вольт-амперная характеристика варисто-ра в цепи тока повышенной частоты ( 20 кгц.| Основные характеристики фоторезисте-ров. Полупроводниковые приборы поликристаллической структуры, электрическое сопротивление которых зависит от освещенности, называются фоторезисторами. Их действие основано на эффекте фотопроводимости, или внутреннем фотоэлектрическом эффекте. Этот эффект заключается в переходе электронов из валентной зоны или с примесных уровней в зону проводимости или из валентной зоны на примесные уровни за счет энергии фотонов, которая при этом должна равняться энергии активации ЕЛ соответствующего перехода или превосходить ее. Основные характеристики фоторезисторов. Фоторезистором называется резистор, электрическое сопротивление которого зависит от освещенности. Действие полупроводниковых фоторезисторов основано на эффекте фотопроводимости, или внутреннем фотоэлектрическом эффекте. Отметим здесь давно известную [119] фотокаталитическую реакцию разложения и синтеза перекиси водорода, протекающую на окиси цинка. Реакция существенно ускоряется при освещении видимым светом, поглощаемым катализатором и вызывающим в окиси цинка внутренний фотоэлектрический эффект. Способность металлов испускать электроны под действием света называется внешним фотоэлектрическим эффектом. При освещении веществ, являющихся изоляторами и полупроводниками, электроны не могут покинуть поверхность вещества, но они получают энергию, достаточную для отрыва от атомов и передвижения внутри вещества. Возрастание проводимости изоляторов и проводников при освещении их светом называется внутренним фотоэлектрическим эффектом. При этом у нее хорошо выражены фотоэлектрические свойства. Поэтому вполне возможно, что проводимость во время освещения обязана своим происхождением электронам, возникшим при внутреннем фотоэлектрическом эффекте на частицах натрия. Выше были описаны основные представления о развитии процессов свечения кристаллофосфоров в рамках зонной теории полупроводников. Общая принципиальная схема процессов свечения кристаллофосфорок на основании изложенных данных сводится к следующему: причиной появления свободных электронов в кристалле служит внутренний фотоэлектрический эффект, возникающий при возбуждении; далее следует локализация части выделившихся электронов в отдельных местах решетки, что является необходимым звеном для возникновения длительного послесвечения; наконец, освобождение локализованных электронов и их рекомбинация с ионизованными центрами составляют заключительный этап длительного свечения. Однако в настоящее время не существует еще установленной точки зрения на характер всех этих процессов, существенных для построения теории свечения. Схема вакуумного фотоэлемента. Способность металлов испускать электроны под действием света называется внешним фотоэлектрически-м эффектом. При освещении веществ, являющихся изоляторами или полупроводниками, электроны не могут покинуть поверхность вещества, но они получают энергию, достаточную для отрыва от атомов и передвижения внутри вещества. Возрастание проводимости изоляторов и полупроводников при освещении их светом называется внутренним фотоэлектрическим эффектом.рассматриваемом типе вакуумных фотоэлементов используется, как известно, явление внешнего фотоэлектрического эффекта.
Фотоэффе́кт — это испускание электронов веществом под действием света (и, вообще говоря, любого электромагнитного излучения). В конденсированных веществах (твёрдых и жидких) выделяют внешний и внутренний фотоэффект.
Законы фотоэффекта:
Формулировка 1-го закона фотоэффекта: Сила фототока прямо пропорциональна плотности светового потока.
Согласно 2-му закону фотоэффекта, максимальная кинетическая энергия вырываемых светом электронов линейно возрастает с частотой света и не зависит от его интенсивности.
3-й
закон фотоэффекта: для
каждого вещества существует красная
граница фотоэффекта, то есть минимальная
частота света ![]() (или
максимальная длина волны λ0),
при которой ещё возможен фотоэффект,
и если
(или
максимальная длина волны λ0),
при которой ещё возможен фотоэффект,
и если ![]() ,
то фотоэффект уже не происходит.
,
то фотоэффект уже не происходит.
Теоретическое
объяснение этих законов было дано
в 1905
году Эйнштейном.
Согласно ему, электромагнитное излучение
представляет собой поток отдельных
квантов (фотонов)
с энергией hν каждый,
где h — постоянная
Планка.
При фотоэффекте часть падающего
электромагнитного излучения от
поверхности металла отражается, а часть
проникает внутрь поверхностного слоя
металла и там поглощается. Поглотив
фотон, электрон получает от него энергию
и, совершая работу выхода φ,
покидает металл: ![]() где
где ![]() —
максимальная кинетическая энергия,
которую имеет электрон при вылете из
металла.
—
максимальная кинетическая энергия,
которую имеет электрон при вылете из
металла.
Уравне́ния Эйнште́йна (иногда встречается название «уравнения Эйнштейна-Гильберта»[1]) — уравнения гравитационного поля в общей теории относительности, связывающие между собой метрику искривлённого пространства-времени со свойствами заполняющей его материи. Термин используется и в единственном числе: «уравне́ние Эйнште́йна», так как в тензорной записи это одно уравнение, хотя в компонентах представляет собой систему уравнений.
Выглядят уравнения следующим образом:
![]()
где ![]() — тензор
Риччи,
получающийся из тензора
кривизны пространства-времени
— тензор
Риччи,
получающийся из тензора
кривизны пространства-времени ![]() посредством свёртки его
по паре индексов, R — скалярная
кривизна,
то есть свёрнутый тензор Риччи,
посредством свёртки его
по паре индексов, R — скалярная
кривизна,
то есть свёрнутый тензор Риччи, ![]() — метрический
тензор,
— метрический
тензор, ![]() —космологическая
постоянная,
а
—космологическая
постоянная,
а ![]() представляет
собой тензор
энергии-импульса материи,
(
представляет
собой тензор
энергии-импульса материи,
(![]() —
число пи, c — скорость
света в
вакууме, G — гравитационная
постоянная Ньютона).
Так как все входящие в уравнения
тензорысимметричны,
то в четырёхмерном пространстве-времени
эти уравнения равносильны
4·(4+1)/2=10 скалярным уравнениям.
—
число пи, c — скорость
света в
вакууме, G — гравитационная
постоянная Ньютона).
Так как все входящие в уравнения
тензорысимметричны,
то в четырёхмерном пространстве-времени
эти уравнения равносильны
4·(4+1)/2=10 скалярным уравнениям.
Одним из существенных свойств уравнений Эйнштейна является их нелинейность, приводящая к невозможности использования при их решении принципа суперпозиции.
Билет 68
Атом (от греческого atomos - неделимый) — одноядерная, химически неделимая частица химического элемента, носитель свойства вещества. Из атомов состоят вещества. Сам атом состоит из положительно заряженного ядра и отрицательно заряженного электронного облака. В целом атом электронейтрален. Размер атома полностью определяется размером его электронного облака, поскольку размер ядра ничтожно мал по сравнению с размером электронного облака. Ядро состоит из Z положительно заряженных протонов (заряд протона соответствует +1 в условных единицах) и N нейтронов, которые не несут на себе заряда (протоны и нейтроны называют нуклонами). Таким образом заряд ядра определятся только количеством протонов и равен порядковому номеру элемента в таблице Менделеева. Положительный заряд ядра компенсируется отрицательно заряженными электронами (заряд электрона -1 в условных единицах), которые формируют электронное облако. Таким образом количество электронов равно количеству протонов. Массы протонов и нейтронов равны (соответственно 1 и 1 а.е.м.). Масса атома определятся массой его ядра, поскольку масса электрона примерно в 1850 раз меньше массы протона и нейтрона и в расчетах редко учитывается. Количество нейтронов можно узнать по разности между массой атома количеством протонов (N=A-Z).Вид атомов какого-либо химического элемента с ядром, состоящим из строго определённого числа протонов (Z) и нейтронов (N) называется нуклидом
элементарная частица |
заряд (условные единицы) |
заряд (Кл) |
масса (а.е.м.) |
масса (г) |
протон |
+1 |
1,6·10×10-19 |
1 |
1,7·10×10-24 |
нейтрон |
0 |
0 |
1 |
1,7·10×10-24 |
электрон |
-1 |
-1,6·10×10-19 |
0 |
9,1·10×10-28 |
Поскольку в ядре атома сосредоточена практически вся масса, но его размеры ничтожно малы по сравнению с общим объемом атома, то ядро условно принимается материальной точкой покоящейся в центре атома, а сам атом рассматривается как система электронов. При химической реакции ядро атома не затрагивается (кроме ядерных реакций), как и внутренние электронные уровни, а участвуют только электроны внешней электронной оболочки. По этой причине необходимо знать свойства электрона и правила формирования электронных оболочек атомов.
Ядерная модель атома Резерфорда получила свое дальнейшее развитие благодаря работам Нильс Бора, в которых учение о строении атома неразрывно связывается с учением о происхождении спектров. Линейчатые спектры получаются при разложении света испускаемого раскаленными парами или газами. Каждому элементу отвечает свой спектр, отличающийся от спектров других элементов. Большинство металлов дает очень сложные спектры, содержащие огромное число линий (в железе до 5000), но встречаются и сравнительно простые спектры. Развивая ядерную теорию Резерфорда, ученые пришли к мысли, что сложная структура линейчатых спектров обусловлена происходящими внутри атомов колебаниями электронов. По теории Резерфорда, каждый электрон вращается вокруг ядра, причем сила притяжения ядра уравновешивается центробежной силой, возникающей при вращении электрона. Вращение электрона совершенно аналогично его быстрым колебаниям и должно вызвать испускание электромагнитных волн.
Поэтому можно предположить, что вращающийся электрон излучает свет определенной длины волны, зависящий от частоты обращения электрона по орбите. Но, излучая свет, электрон теряет часть своей энергии, в следствие чего нарушается равновесие между ним и ядром; для восстановления равновесия электрон должен постепенно передвигаться ближе к ядру, причем так же постепенно будет изменяться частота обращения электрона и характер испускаемого им света. В конце концов, исчерпав всю энергию, электрон должен «упасть» на ядро, и излучение света прекратится. Если бы на самом деле происходило такое непрерывное изменение движения электрона, то и спектр получался бы всегда непрерывный, а не с лучами определенной длины волны. Кроме того, «падение» электрона на ядро означало бы разрушение атома и прекращения его существования.
Таким образом, теория Резерфорда была бессильна объяснить не только закономерности в распределении линий спектра, ни и само существование линейчатых спектров. В 1913 г. Бор предложил сою теорию строения атома, в которой ему удалось с большим искусством согласовать спектральные явления с ядерной моделью атома, применив к последней так называемую квантовую теорию излучения, введенную в науку немецким ученым-физиком Планком. Сущность теории квантов сводится к тому, что лучистая энергия испускается и поглощается не непрерывно, как принималось раньше, а отдельными малыми, но вполне определенными порциями квантами энергии. Запас энергии излучающего тела изменяется скачками, квант за квантом; дробное число квантов тело не может ни испускать, ни поглощать. Величина кванта энергии зависит от частоты излучения: чем больше частота излучения, тем больше величина кванта. Обозначая квант энергии через, можно написать: = где - постоянная величина, так называемая константа Планка, равная 6, 625 10 эрг сек. Кванты лучистой энергии называются также фотонами. Применив квантовые представления к вращению электронов вокруг ядра, Бор положил в основу своей теории очень смелые предположения, или постулаты. Хотя эти постулаты и противоречат законам классической электродинамики, но они находят свое оправдание в тех поразительных результатах, к которым приводят, и в том полнейшем согласии, которое обнаруживается между теоретическими результатами и огромным числом экспериментальных фактов. Постулаты Бора заключаются в следующем: Электрон может двигаться вокруг не по любым орбитам, а только по таким, которые удовлетворяют определенными условиям, вытекающим из теории квантов. Эти орбиты получили название устойчивых или квантовых орбит. Когда электрон движется по одной из возможных для него устойчивых орбит, то он не излучает. Переход электрона с удаленной орбиты на более близкую сопровождается потерей энергии. Потерянная атомом при каждом переходе энергия превращается в один квант лучистой энергии. Частота излучаемого при этом света определяется радиусами тех двух орбит, между которыми совершается переход электрона. Обозначив запас энергии атома при положении электрона на более удаленной от ядра орбите через Е, а на более близкой через Е и разделив потерянную атомом энергию Е - Е на постоянную Планка, получим искомую частоту.
Чем больше расстояние от орбиты, на которой находится электрон, до той, на которую он переходит, тем больше частота излучения. Простейшим из атомов является атом водорода; вокруг ядра которого вращается только один электрон. Исходя из приведенных постулатов, Бор рассчитал радиусы возможных орбит для этого электрона и нашел, что они относятся, как квадраты натуральных чисел: 1: 2: 3:. n Величина n получила название главного квантового числа. Радиус ближайшей к ядру орбиты в атоме водорода равняется 0, 53 ангстрема. Вычисленные отсюда частоты излучений, сопровождающих переходы электрона с одной орбиты на другую, оказались в точности совпадающими с частотами, найденными на опыте для линий водородного спектра Тем самым была доказана правильность расчета устойчивых орбит, а вместе с тем и приложимость постулатов Бора для таких расчетов. В дальнейшем теория Бора была распространена и на атомную структуру других элементов, хотя это было связанно с некоторыми трудностями из-за ее новизны. Теория Бора позволила разрешить очень важный вопрос о расположении электронов в атомах различных элементов и установить зависимость свойств элементов от строения электронных оболочек их атомов. В настоящее время разработаны схемы строения атомов всех химических элементов. Однако, иметь ввиду, что все эти схемы это лишь более или менее достоверная гипотеза, позволяющая объяснить многие физические и химические свойства элементов. Как раньше уже было сказано, число электронов, вращающихся вокруг ядра атома, соответствует порядковому номеру элемента в периодической системе.
Изображение атомов углерода на поверхности графита, полученное с помощью туннельного микроскопа. Оранжевые линии - изображение электронных орбит, черные области - положение ядер атомов графита. |
Явления, свидетельствующие о сложной структуре атома Слово "атом" означает "неделимый". В течение длительного времени атом считался наименьшей частице вещества. Но в начале 19 века наука открыла явление, обнаруживающие сложность строения и свойств "неделимой" частицы. Название же "атом" сохранилось в естествознании для описания химического состава молекул. Какие же явления разрушили представления о "неделимости" атома?
Ясно, что возможность описания всех спектральных линий излучения атомарного водорода одной простой формулой не могла быть случайностью. Закономерности в спектре излучения атома обусловлены особенностями структуры атома водорода. Опыты Резерфорда |
||||||
|
В 1913 г. английский физик Резерфорд проделал классические опыты по рассеянию -частиц тонкими слоями различных веществ. -частицы, испускаемые радиоактивными веществами, являются подходящими пробными зарядами для исследования внутриатомных электрических полей. Они представляют собой полностью ионизированные атомы гелия, имеют положительный заряд, равный удвоенному элементарному заряду (q = 3.2·10-19 Кл), массу m = 6.67·10-27кг, обладают высокой энергией (а значит и скоростью), достаточной для проникновения в атомы вещества. Схема опытов Резерфорда и его учеников Гейгера и Марсдена изображена на рис.1.Внутри герметичной камеры, в которой был создан высокий вакуум, находился свинцовый контейнер с радиоактивным элементом, испускавшим частицы. Узкий пучок частиц падал перпендикулярно на поверхность металлической (золотой) фольги, толщиной около 1 мкм (10-6м). Регистрация частиц производилась по вспышкам света (сцинтилляциям), вызываемыми ими на экране, покрытом люминофором. Экран был укреплен перед объективом на корпусе микроскопа, с помощью которого визуально наблюдали сцинтилляции и подсчитывали их число. Так определяли количество частиц, движущихся по данному направлению после их взаимодействия с атомами вещества. Микроскоп вместе с экраном мог вращаться вокруг вертикальной оси, походящей через центр камеры, для регистрации рассеянных атомами фольги частиц.
На рисунке: 1- атом золота, 2- -частицы Результаты опытов Резерфорда: 1.большинство частиц проходит через атомы вещества. не рассеиваясь (как через "пустоту"); 2.с увеличением угла рассеяния число отклонившихся от первоначального направления частиц резко уменьшается; 3.имеются отдельные частицы, отбрасываемые атомами назад, против их первоначального движения (как мяч от стенки). |
||||||
|
Резерфорд вывел формулу, по которой можно рассчитать количествочастиц, рассеянных под определенными углами. В эту формулу входит характеристический параметр "d ", являющийся поперечным размером образований, отклоняющих частицы. Для совпадения расчетов с результатами опытов это параметр должен быть порядка 10-13 см. Атомы имеют диаметр 10-8 см, т.е. на пять порядков выше. Следовательно, в атоме имеется область занимающая ничтожно малую часть атома, которая и отклоняет частицы на большие углы вплоть до 1800. |
В основе боровской теории атома лежат два основных положения (постулата):
1. Электроны могут двигаться в атоме только по определенным орбитам, находясь на которых они, несмотря на наличие у них ускорения, не излучают.
Бор предположил, что произведение модуля импульса на радиус орбиты кратно постоянной Планка:
![]()
где n = 1,2,3,… это и есть правило квантования. С помощью правила квантования можно получить выражение для возможных радиусов орбит:
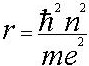
2. Атом излучает или поглащает квант электромагнитной энергии при переходе электрона из одного стационарного состояние в другое.
Радиусов допустимых (стационарных) орбит электрона в атоме водорода:
![]()
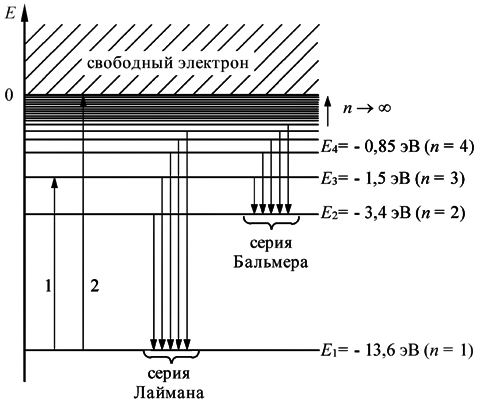
Ряд значений энергий стационарных состояний атома водорода
Если вы хотите отдохнуть в солнечной Абхазии, тогда лучшего места, чем курорт Пицунда вам не найти. Курорт Пицунда - это красивая природа, свежий воздух и приятные доброжелательные жители. Самшитовая роща в Пицунде является комфортабельным пансионатом на побережье Абхазии.
Билет 69
Естественная радиоактивность.
Естественной радиоактивностью называется самопроизвольное превращение ядер неустойчивых изотопов одного химического элемента в ядра других химических элементов. Естественная радиоактивность сопровождается испусканием определенных частиц: альфа-, бета- излучений, антинейтрино, а также электромагнитного излучения(гамма-излучение). Естественная радиоактивность наблюдается у тяжелых ядер элементов, располагающихся в периодческой системе Д.И.Менделеева за свинцом. Существуют и легкие
радиоактивные ядра: изотоп калия 19К40 , изотоп углерода 6С14 и другие.
Состав радиоактивных излучений установлен по их отклонению в магнитном поле.
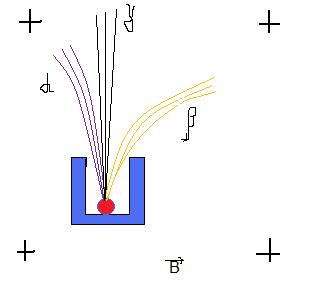
Было известно, что магнитное поле отклоняет только заряженные летящие частицы, причем положительные и отрицательные в разные стороны. По направлению отклонения убедились в том, что отклоняемые -лучи заряжены отрицательно. Дальнейшие опыты показали, что они представляют собой поток электронов.
При использовании более сильных магнитов оказалось, что -лучи тоже отклоняются, только значительно слабее, чем -лучи, причем в другую сторону. Отсюда следовало, что они заряжены положительно и имеют значительно бoльшую массу, и определили, что - лучи представляет собой поток ядер гелия.
Когда же в 1900 французский физик Поль Вийар (1860–1934) исследовал более подробно отклонение - и -лучей, он обнаружил в излучении радия и третий вид лучей, не отклоняющихся в самых сильных магнитных полях, это открытие вскоре подтвердил и Беккерель. Этот вид излучения, по аналогии с альфа- и бета-лучами, был назван гамма-лучами, обозначение разных излучений первыми буквами греческого алфавита предложил Резерфорд. Гамма-лучи оказались сходными с лучами Рентгена, т.е. они представляют собой электромагнитное излучение, но с более короткими длинами волн и соответственно с большей энергией.
Свойства радиоактивных излучений, установленные по их взаимодействию с веществом:
а)все радиоактивные излучения обладают химическими действиями, в частности вызывают почернение фотопластинок
б) радиоактивные излучения вызывают ионизацию газов, а иногда и твердых и жидких тел
в) радиоактивные излучения вызывают люминесценцию ряда жидких и твердых тел
Превращение радиоактивных ядер, которые сопровождаются испусканием -,-излучений, называется соответственно -,-распадом.
Правила смещения радиоактивного распада.
Для альфа распада : ZXA ---- 2 He4 + Z-2YA-4.
Для бета – распада : ZXA ------ -1e0 + Z+1YA. Здесь Х – символ химического элемента, соответствующего материнскому ядру; Y - то жедля дочернего ядра; 2He4 – ядро изотопа гелия; -1e0 – обозначение электрона. Альфа-распадуменьшает массовое число на 4, а заряд ядра на 2 элементарных положительных заряда, т.е. смещает химический элемент на две клетки влево в периодической системе Менделеева. При бета-распаде массовое число не изменяется, а заряд ядра увеличивается на 1 положительный единичный заряд. Химический элемент смещается вправо на одну клетку в периодической системе Менделеева
Закон радиоактивного распада — физический закон, описывающий зависимость интенсивности радиоактивного распада от времени и количества радиоактивных атомов в образце. Открыт Фредериком Содди и Эрнестом Резерфордом, каждый из которых впоследствии был награжден Нобелевской премией. Они обнаружили его экспериментальным путём и опубликовали в 1903 году в работах «Сравнительное изучение радиоактивности радия и тория»[1] и «Радиоактивное превращение»[2], сформулировав следующим образом[3]:
Во всех случаях, когда отделяли один из радиоактивных продуктов и исследовали его активность независимо от радиоактивности вещества, из которого он образовался, было обнаружено, что активность при всех исследованиях уменьшается со временем по закону геометрической прогрессии.
из чего с помощью теоремы Бернулли учёные сделали вывод[источник не указан 675 дней]:
Скорость превращения всё время пропорциональна количеству систем, еще не подвергнувшихся превращению.
Существует несколько формулировок закона, например, в виде дифференциального уравнения:
![]()
которое означает, что число распадов −dN, произошедшее за короткий интервал времени dt, пропорционально числу атомов N в образце.
Билет 70
Атом состоит из ядра и окружающего его электронного "облака". Находящиеся в электронном облаке электроны несут отрицательный электрический заряд. Протоны, входящие в состав ядра, несутположительный заряд.
В любом атоме число протонов в ядре в точности равно числу электронов в электронном облаке, поэтому атом в целом – нейтральная частица, не несущая заряда.
Атом может потерять один или несколько электронов или наоборот – захватить чужие электроны. В этом случае атом приобретает положительный или отрицательный заряд и называется ионом.
Практически вся масса атома сосредоточена в его ядре, так как масса электрона составляет всего лишь 1/1836 часть массы протона. Плотность вещества в ядре фантастически велика – порядка 1013 - 1014 г/см3. Спичечный коробок, наполненный веществом такой плотности, весил бы 2,5 миллиарда тонн!
Внешние размеры атома – это размеры гораздо менее плотного электронного облака, которое примерно в 100000 раз больше диаметра ядра.
Кроме протонов, в состав ядра большинства атомов входят нейтроны, не несущие никакого заряда. Масса нейтрона практически не отличается от массы протона. Вместе протоны и нейтроны называютсянуклонами (от латинского nucleus – ядро).
Электроны, протоны и нейтроны являются главными "строительными деталями" атомов и называются субатомными частицами. Их заряды и массы в кг и в специальных “атомных” единицах массы (а.е.м.) показаны в таблице 2-1.
Таблица 2-1. Субатомные частицы.
Частица |
Заряд |
Масса: |
|
|
|
кг |
а.е.м. |
Протон |
+1 |
1,67·10-27 |
1,00728 |
Нейтрон |
0 |
1,67·10-27 |
1,00867 |
Электрон |
-1 |
9,11·10-31 |
0,000549 |
Из таблицы 2-1 видно, что массы субатомных частиц чрезвычайно малы. Показатель степени (например, десять в минус двадцать седьмой степени) показывает, сколько нулей после запятой нужно записать, чтобы получилась десятичная дробь, выражающая массу субатомной частицы в килограммах. Это ничтожнейшая часть килограмма, поэтому массу субатомных частиц удобнее выражать ватомных единицах массы (сокращенно – а.е.м.). За атомную единицу массы принята ровно 1/12 часть массы атома углерода, в ядре которого содержится 6 протонов и 6 нейтронов. Схематическое изображение такого "эталонного" атома углерода приведено на рис. 2-5 (б). Атомную единицу массы можно выразить и в граммах: 1 а.е.м. = 1,660540·10-24 г.
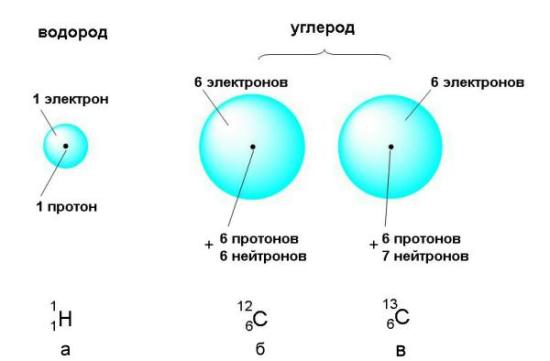 <=""
p="">
<=""
p="">
Рис. 2-5. Атомы состоят из положительно заряженного ядра и электронного облака. а) В состав ядра атома водорода входит только 1 протон, а электронное облако заполняется одним электроном. б) В ядре атома углерода 6 протонов и 6 нейтронов, а в электронном облаке – 6 электронов. в) Существует также изотопный углерод, ядре которого на 1 нейтрон больше. Содержание этого изотопа в природном углероде составляет чуть более 1% (об изотопах см. ниже). Линейные размеры атомов очень малы: их радиусы составляют от 0,3 до 2,6 ангстрема (1 ангстрем = 10–8 см). Радиус ядра около 10–5ангстрема, то есть 10–13 см. Это в 100000 раз меньше размеров электронной оболочки. Поэтому правильно показать относительные пропорции ядер и электронных оболочек на рисунке невозможно. Если бы атом увеличился до размеров Земли, то ядро имело бы всего около 60 м в диаметре и могло бы поместиться на футбольном поле.
Масса атома, выраженная в килограммах или граммах, называется абсолютной атомной массой. Чаще пользуются относительной атомной массой, которая выражается в атомных единицах массы (а.е.м.). Относительная атомная масса представляет собой отношение массы какого-нибудь атома к массе 1/12 части атома углерода. Иногда говорят более коротко: атомный вес. Последний термин вовсе не устаревший, как иногда пишут в учебниках – он широко используются в современной научной литературе, поэтому мы тоже будем его применять. Относительная атомная масса и атомный вес, фактически, безразмерные величины (масса какого-либо атома делится на массу части атома углерода), поэтому обозначение "а.е.м." после численного значения обычно опускают (но можно и написать, в этом не будет ошибки). Термины “относительная атомная масса”, “атомная масса”, “атомный вес” в научном химическом языке обычно используются равноправно и между ними просто не делают различий. В Международном союзе химиков (IUPAC) существует Комиссия по относительной распространенности изотопов и атомным весам (Commission on Isotopic Abundances and Atomic Weights или сокращенно – CIAAW), но не "Комиссия по относительным атомным массам". Однако все химики прекрасно понимают, что речь идет об одном и том же.
В российских учебниках и заданиях ЕГЭ пользуются термином относительная атомная масса, которую обозначают символом Ar. Здесь "r" – от английского "relative" – относительный. Например, Ar = 12,0000 – относительная атомная масса углерода 126C равна 12,0000. В современной научной литературе относительная атомная масса и атомный вес – синонимы.
** Из курса физики вы помните, что вес физического тела является переменной величиной. Например, на Земле и на Луне одно и то же физическое тело имеет разный вес, но масса тела – величина постоянная. Поэтому термин “относительная атомная масса” считается более строгим. Для многих вычислений удобно массы протона и нейтрона в шкале а.е.м. считать округленно равными единице.
На рис. 2-5 показаны атомы двух разных видов. Может возникнуть вопрос: почему двух, а не трех видов – ведь на рисунке изображены три атома? Дело в том, что атомы (б) и (в) относятся к одному и тому же химическому элементу углероду, в то время как атом (а) – совсем другой элемент (водород). Что же такое химические элементы и чем они отличаются друг от друга?
Водород и углерод отличаются числом протонов в ядре и, следовательно, числом электронов в электронной оболочке. Число протонов в ядре атома называют зарядом ядра атома и обозначают буквой Z. Это очень важная величина. Когда мы перейдем к изучению Периодического закона, то увидим, что число протонов в ядре совпадает с порядковым номером атома в Периодической таблице Д.И.Менделеева.
Как мы уже говорили, заряд ядра (число протонов) совпадает с числом электронов в атоме. Когда атомы сближаются, то в первую очередь они взаимодействуют друг с другом не ядрами, а электронами. Число электронов определяет способность атома образовывать связи с другими атомами, то есть его химические свойства. Поэтому атомы с одинаковым зарядом ядра (и одинаковым числом электронов) ведут себя в химическом отношении практически одинаково и рассматриваются как атомы одного химического элемента.
ЭЛЕМЕНТОМ называется вещество, состоящее из атомов с одинаковым ЗАРЯДОМ ЯДРА.
На рис. 2-5 водород (один протон в ядре) и углерод (шесть протонов в ядре) – это разные химические элементы. А вот атомы (б) и (в), у которых по 6 протонов в ядре (хотя и разное количество нейтронов!), принадлежат одному и тому же химическому элементу (углероду).
** Слово "элемент" существовало в обиходе химиков задолго до того, как стало что-нибудь известно о строении атома. Средневековые алхимики и ученые-химики до начала XIХ века ничего не знали об атомном ядре и, тем более, о протонах и электронах. Но о существовании элементов естествоиспытатели догадывались давно и затратили немало сил для того, чтобы выяснить – что же считать элементом?
Очень хорошее (и вполне современное!) определение элемента дал еще древнегреческий философ Аристотель (384-322 до н.э.):
"Все окружающее представляет собой элементы либо состоит из элементов... Элемент представляет собой то, на что можно разложить другие тела, но не может быть разложено само ни на что более простое или отличное от самого себя".
Эта догадка опиралась на здравый смысл и у большинства химиков не вызывала сомнений, но при ответе на вопрос – что же считать элементом – возникало чисто практическое затруднение. Если какое-либо вещество не разлагается на более простые вещества, то не ясно – является ли оно элементом, или мы просто не умеем его разложить? В 1857 году немецкий химик Юстус Либих написал: "Элементы рассматриваются как простые вещества не потому, что мы знаем это, а лишь потому, что не знаем о них противоположного".
Например, долгое время воду считали элементом, и только в 1784 году англичанин Генри Кавендиш показал, что вода состоит из более простых веществ – водорода и кислорода. Водород, кстати, был открыт Г.Кавендишем, но вместо своего нынешнего названия имел гораздо более длинное: "воспламеняемый, горючий воздух из металлов" (дело в том, что водород получали, действуя кислотами на цинк, железо и некоторые другие металлы). Название ВОДО-РОД (то есть – рождающий воду) просто еще не могло существовать, поскольку никто не догадывался, что этот легкий газ и вода имеют друг к другу близкое отношение.
Однажды другой английский исследователь – Джозеф Пристли – в присутствии Кавендиша провел простой, хотя и небезопасный опыт – взорвал смесь водорода с кислородом. Пристли (он является первооткрывателем кислорода) впоследствии вспоминал об этом, как о "случайном эксперименте для развлечения нескольких философствующих друзей". Наблюдательный Кавендиш повторил этот опыт, но уже не взрывая, а сжигая водород в кислороде. Ему удалось довольно точно измерить объем взаимодействующих газов (объем водорода в этом опыте относился к объему кислорода как 2 : 1) и показать, что вода является продуктом реакции между этими двумя газами. Отсюда следовало, что вода – не элемент, а химическое соединение водорода и кислорода.
Более практическое определение элементу дал английский физик и химик Роберт Бойль:
Элемент – это вещество, которое при химическом превращении всегда увеличивает свой вес.
Например, при ржавлении куска железа его вес всегда увеличивается. Ржавление – это химическая реакция железа с водой и кислородом воздуха, поэтому в массу ржавого железа включается и масса прореагировавших с ним веществ. Химикам были известны и другие реакции, в которых железо увеличивало вес, но не существовало ни одной реакции, в которой железо разлагалось бы на более легкие продукты. Из этого заключалось, что железо, вероятно, является элементом.

О |
Можно представить себе те трудности, с которыми сталкивались естествоиспытатели до появления теории строения атома. Тем не менее, еще до XIX века были правильно установлены многие элементы: углерод, сера, медь, золото, серебро, железо, свинец, олово, ртуть, цинк, мышьяк, сурьма, висмут, платина, фосфор, кобальт, никель, водород, кислород, азот, марганец.
Сумма тяжелых частиц (нейтронов и протонов) в ядре атома какого-либо элемента называется массовым числом и обозначается буквой А. Из названия этой величины видно, что она тесно связана с округленной до целого числа атомной массой элемента.
A = Z + N
Здесь A – массовое число атома (сумма протонов и нейтронов), Z – заряд ядра (число протонов в ядре), N – число нейтронов в ядре.
Природа устроена так, что один и тот же элемент может существовать в виде двух или нескольких изотопов. Изотопы отличаются друг от друга только числом нейтронов в ядре (числом N). Поскольку нейтроны практически не влияют на химические свойства элементов, все изотопы одного и того же элемента химически неотличимы. На рис. 2-5б показан изотоп углерода с массовым числом 12 (6 протонов + 6 нейтронов = 12), а на рис. 2-5в – изотоп углерода с массовым числом 13 (6 протонов + 7 нейтронов = 13).
Изотопами
называются вещества, состоящие из
атомов с одинаковым зарядом ядра (то
есть с одинаковым числом протонов), но
с разным числом нейтронов в я дре.
Изотопы отличаются друг от друга только
массовым числом. Все элементы состоят
из одного или нескольких изотопов.
дре.
Изотопы отличаются друг от друга только
массовым числом. Все элементы состоят
из одного или нескольких изотопов.
Например, алмаз состоит из элемента углерода. Если бы удалось изготовить два совершенно одинаковых брильянта из углерода с массовым числом 12 и углерода с массовым числом 13, то оба кристалла в химическом отношении были бы одним и тем же элементом углеродом (заряд ядра + 6), но их масса была бы немного разной. Правда, стоимость брильянтов из чистого углерода-12 и чистого углерода-13 была бы во много раз выше, чем у обычных. Дело в том, что разделять изотопы чрезвычайно трудно из-за того, что их химические и физические свойства очень близки.
** Лишь немногие изотопы в природе неустойчивы и поэтому постепенно распадаются с излучением субатомных частиц и электромагнитных волн. Это явление называется радиоактивностью, о которой мы уже упоминали в этой главе. Вопреки распространенному мнению термин изотоп совсем не обязательно связан с радиоактивностью – большинство природных (но не искусственных!) изотопов устойчиво и мы просто не замечаем их присутствие в том или ином элементе, поскольку не различаем их химические и физические свойства. Таковы изотопы железа, меди, хлора, кальция и многих других элементов, с которыми мы познакомимся немного позже.
Важнейшую роль во всей ядерной физике играет понятие энергии связи ядра. Энергия связи позволяет объяснить устойчивость ядер, выяснить, какие процессы ведут к выделению ядерной энергии. Нуклоны в ядре прочно удерживаются ядерными силами. Для того чтобы удалить нуклон из ядра, надо совершить довольно большую работу, т. е. сообщить ядру значительную энергию.
Под энергией связи ядра понимают ту энергию, которая необходима для полного расщепления ядра на отдельные нуклоны. На основе закона сохранения энергии можно также утверждать, что энергия связи ядра равна той энергии, которая выделяется при образовании ядра из отдельных частии.
Энергия связи атомных ядер очень велика. Но как ее определить?
В
настоящее время рассчитать энергию
связи теоретически, подобно тому как
это можно сделать для электронов в
атоме, не удается. Выполнить соответствующие
расчеты можно, лишь применяя соотношение
Эйнштейна между массой и энергией:
Е
= mс2.
(13.3)
Точнейшие измерения масс
ядер показывают, что масса покоя ядра
М21 всегда меньше суммы масс входящих
в его состав протонов и нейтронов:
Мя<
Zmp +
Nmn.
(13.4)
Существует, как
говорят, дефект масс: разность масс
![]() М
= Zmp +
Nmn -
Мя
положительна.
В частности, для гелия масса ядра на
0,75% меньше суммы масс двух протонов и
двух нейтронов. Соответственно для
гелия в количестве вещества один моль
M
= 0,03 г.
М
= Zmp +
Nmn -
Мя
положительна.
В частности, для гелия масса ядра на
0,75% меньше суммы масс двух протонов и
двух нейтронов. Соответственно для
гелия в количестве вещества один моль
M
= 0,03 г.
Уменьшение
массы при образовании ядра из нуклонов
означает, что при этом уменьшается
энергия этой системы нуклонов на
значение энергии связи Есв:
Есв =
Мс2 =
(Zmp +
Nmn -
Mя)
с2.
(13.5)
Но куда при этом
исчезают энергия Есв и
масса
M?
При
образовании ядра из частиц последние
за счет действия ядерных сил на малых
расстояниях устремляются с огромным
ускорением друг к другу. Излучаемые
при этом
![]() -кванты
как раз обладают енергией Есв
и массой
-кванты
как раз обладают енергией Есв
и массой
![]() .
.
Энергия связи — это энергия, которая выделяется при образовании ядра из отдельных частиц, и соответственно это та энергия, которая необходима для расщепления ядра на составляющие его частицы.
О том, как велика энергия связи, можно судить по такому примеру: образование 4 г гелия сопровождается выделением такой же энергии, что и при сгорании 1,5—2 вагонов каменного угля.
Важную информацию о свойствах ядер содержит зависимость удельной энергии связи от массового числа А.
Удельной
энергией связи называют
энергию связи, приходящуюся на один
нуклон ядра. Ее определяют экспериментально.
Из рисунка 13.11 хорошо видно, что, не
считая самых легких ядер, удельная
энергия связи примерно постоянна и
равна 8 МэВ/нуклон. Отметим, что энергия
связи электрона и ядра в атомеводорода,
равная энергии ионизации, почти в
миллион раз меньше этого значения.
Кривая на рисунке 13.11 имеет слабо
выраженный максимум.
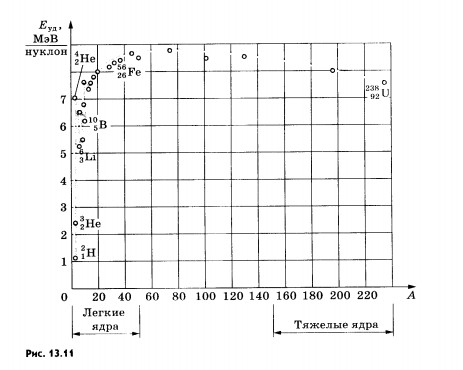 Максимальную
удельную энергию связи (8,6 МэВ/нуклон)
имеют элементы с массовыми числами от
50 до 60, т. е. железо и близкие к нему но
порядковому номеру элементы. Ядра этих
элементов наиболее устойчивы.
Максимальную
удельную энергию связи (8,6 МэВ/нуклон)
имеют элементы с массовыми числами от
50 до 60, т. е. железо и близкие к нему но
порядковому номеру элементы. Ядра этих
элементов наиболее устойчивы.
У тяжелых ядер удельная энергия связи уменьшается за счет возрастающей с увеличением Z кулоновской энергии отталкивания протонов. Кулоновские силы стремятся разорвать ядро.
Частицы в ядре сильно связаны друг с другом. Энергия связи частиц определяется по дефекту масс.
Ядерные силы являются короткодействующими силами. Они проявляются лишь на весьма малых расстояниях между нуклонами в ядре порядка 10–15 м. Длина (1,5 – 2,2)·10–15 м называется радиусом действия ядерных сил.
Я́дерный реа́ктор — это устройство, в котором осуществляется управляемая цепная ядерная реакция, сопровождающаяся выделением энергии. Первый ядерный реактор построен и запущен в декабре 1942 года в СШАпод руководством Э. Ферми. Первым реактором, построенным за пределами США, стал ZEEP, запущенный в Канаде в сентябре 1945 года[1]. В Европе первым ядерным реактором стала установка Ф-1, заработавшая 25 декабря 1946 года в Москве под руководством И. В. Курчатова.[2]
К 1978 году в мире работало уже около сотни ядерных реакторов различных типов. Составными частями любого ядерного реактора являются: активная зона с ядерным топливом, обычно окруженная отражателем нейтронов, теплоноситель, система регулирования цепной реакции, радиационная защита, система дистанционного управления. Корпус реактора подвержен износу (особенно под действием ионизирующего излучения)[3]. Основной характеристикой ядерного реактора является его мощность. Мощность в 1 МВт соответствует цепной реакции, в которой происходит 3·1016 актов деления в 1 сек.


 Изображение
атомов солнечной батареи, полученное
с помощью туннельного микроскопа.
Изображение
атомов солнечной батареи, полученное
с помощью туннельного микроскопа. (рис.1)
(рис.1)
 бразцы
пяти химических элементов из книги
П.Эткинса "Молекулы". Желтая
глыба – сера (S). Правее – медь (Cu).
Красная жидкость в колбе – бром (Br2).
В часовых стеклах – элементы иод
(фиолетовые кристаллы I2)
и ртуть (жидкий металл Hg).
бразцы
пяти химических элементов из книги
П.Эткинса "Молекулы". Желтая
глыба – сера (S). Правее – медь (Cu).
Красная жидкость в колбе – бром (Br2).
В часовых стеклах – элементы иод
(фиолетовые кристаллы I2)
и ртуть (жидкий металл Hg).