
- •Вопрос 2
- •Вопрос 3
- •Специфические и общие пути катаболизма
- •Вопрос 6
- •Вопрос 7
- •Вопрос 8
- •I комплекс
- •II комплекс
- •III комплекс
- •IV комплекс
- •Вопрос 9
- •Вопрос 10Тканевое дыхание – процесс окисления водорода кислородом до воды ферментами цепи тканевого дыхания. Оно протекает по следующей схеме:
- •Вопрос 11
- •Вопрос 12
- •Вопрос 13
- •Вопрос 14
- •Вопрос 15
Вопрос 11
Ферментативный катализ – каталитические реакции, протекающие с участием ферментов – биологических катализаторов белковой природы. Ферментативный катализ имеет две характерные особенности:
1. Высокая активность, на несколько порядков превышающая активность неорганических катализаторов, что объясняется очень значительным снижением энергии активации процесса ферментами. реакция в присутствии фермента протекает в миллион раз быстрее.
2. Высокая специфичность - наиболее важное свойство ферментов, определяющее биологическую значимость ферментов. Различают субстратную и каталитическую специфичности фермента, которые определяются строением активного центра. Под субстратной специфичностью понимается способность каждого фермента взаимодействовать лишь с одним или несколькими определенными субстратами.
Различают:
- абсолютную субстратную специфичность, если активный центр фермента комплементарен только одному субстрату;
- групповую субстратную специфичность, если фермент катализирует однотипную реакцию с небольшим количеством (группой) структурно похожих субстратов;
- стереоспецифичность, если фермент проявляет абсолютную специфичность только к одному из существующих стереоизомеров субстрата.
Каталитическая специфичность, обеспечивает преобразование одного и того же субстрата под действием разных ферментов. Это обеспечивается строением каталитических участков активных центров соответствующих ферментов. Например, молекула глюкозо-6-фосфата в клетках печени человека является субстратом четырех различных ферментов: фосфоглюкомутазы, глюкозо-6-фосфатфосфатазы, фосфоглюкоизомеразы и глюкозо-6-фосфатдегидрогеназы. Однако за счет особенностей строения каталитических участков этих ферментов происходят различные превращения глюкозо-6-фосфата с образованием четырех различных продуктов
Э Т А П Ы Ф Е Р М Е Н Т А Т И В Н О Г О К А Т А Л И З А
1. Присоединение субстрата к ферменту
2. Преобразование фермент-субстратного комплекса в один или несколько переходных комплексов в одну или несколько стадий.
3. Отделение конечных продуктов от фермента.
Согласно общепринятым представлениям о механизме ферментативного катализа, субстрат S и фермент F находятся в равновесии с очень быстро образующимся фермент-субстратным комплексом FS, который сравнительно медленно распадается на продукт реакции P с выделением свободного фермента; т.о., стадия распада фермент-субстратного комплекса на продукты реакции является скоростьопределяющей (лимитирующей).
F + S <––> FS ––> F + P
Исследование зависимости скорости ферментативной реакции от концентрации субстрата при неизменной концентрации фермента показали, что с увеличением концентрации субстрата скорость реакции сначала увеличивается, а затем перестает изменяться и зависимость скорости реакции от концентрации субстрата описывается следующим уравнением:

Здесь Кm – константа Михаэлиса, численно равная концентрации субстрата при V = ½Vmax. Константа Михаэлиса служит мерой сродства между субстратом и ферментом: чем меньше Кm, тем больше их способность к образованию фермент-субстратного комплекса. Если Кm высока, то сродство фермента к такому субстрату низкое и реакция протекает медленно.
Когда скорость ферментативной реакции равна половине максимальной скорости ракции, то константа Михаэлиса численно равна концентрации субстрата.
![]()
Характерной особенностью действия ферментов является также высокая чувствительность активности ферментов к внешним условиям – рН среды и температуре. Ферменты активны лишь в достаточно узком интервале рН и температуры, причем для ферментов характерно наличие в этом интервале максимума активности при некотором оптимальном значении рН или температуры; по обе стороны от этого значения активность ферментов быстро снижается.

Зависимость скорости ферментативной реакции от концентрации субстрата.
При низких концентрациях субстрата скорость реакции возрастает пропорционально увеличению концентрации субстрата(реакция первого порядка)
![]()
При высоких концентрациях субстрата скорость реакции достигает своего максимального значения (Vmax)и не зависит от концентрации субстрата (реакция нулевого порядка): [S]˃˃Km, то V=Vmax.
Влияние температуры
Каждый фермент имеет оптимальную температуру. Для ферментов животного происхождения 37-40С°, а растительного 40-50С° . исключение: альфа-амилаза из проросшего зерна имеет оптимальную температуру при 60С°, а каталаза- в пределах 0-10С° . до этого интервала с повышением температуры скорость катализируемой реакции повышается из-за ускорения движения молекул и увеличения вероятности их столкновения. Выше оптимальной температуры активность инактивируется, из-за денатурации. При температуре выше 80°С большинство ферментов полностью теряют свою каталитическую активность. поэтому важным показателем является термолабильность, т.е. скорость инактивации самого фермента при повышении температуры. При низких температурах (0°С и ниже) каталитическая активность ферментов падает почти до нуля, но денатурации не происходит. С повышением температуры их каталитическая активность восстанавливается.
Температура обеспечивающая наибольшую скорость реакции-оптимальная.
Закон о повышении скорости реакции в 2-4 раза при повышении температуры на 10°С справедлив, но только в пределах до 55-60°С, т.е. до температур денатурации белков.

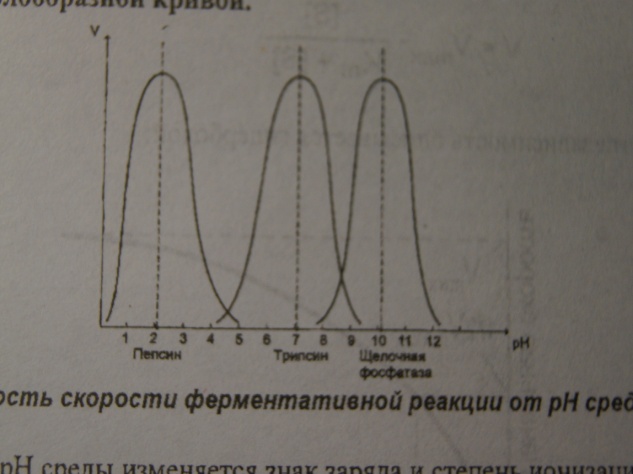
Влияние рН
Для каждого фермента существует определенный интервал рН среды, при котором его активность максимальна. Например, оптимальные значения рН для пепсина 1,5-2,5, трипсина 8,0-8,5, амилазы слюны 7,2, аргиназы 9,7, кислой фосфатазы 4,5-5,0. За переделами оптимальной зоны рН, т.е. при отклонениях в сторону снижения или повышения от этого значения, скорость ферментативной реакции снижается. Зависимость скорости от рН чаще всего описывается колоколообразной кривой. При изменении рН среды изменяется и знак заряда и степень ионизации аминокислотных остатков фермента, что приводит к изменению конформации его активного центра, нарушению комплементарности и снижению скорости реакции.
Зависимость от количества фермента
|
В условиях избытка субстрата скорость будет зависеть прямо пропорционально от концентрации фермента.
При увеличении количества молекул фермента скорость реакции возрастает непрерывно и прямо пропорционально количеству фермента, т.к. большее количество молекул фермента производит большее число молекул продукта.

