
- •Предмет и задачи биологической химии
- •Функции белков в организме. Строение белков.
- •Физико-химические свойства белков. Ионизация белков в
- •4) Физико-химические свойства белков: гидратация и растворимость
- •Осаждение белков из растворов. Виды осаждения белков (обратимое и
- •Денатурация белков: факторы, вызывающие денатурацию белков:
- •Классификация белков. Простые и сложные белки
- •Дезоксирибонуклеиновые кислоты (днк): состав, строение, свойства,
- •Биосинтез днк (репликация генов): общий принцип матричного синтеза,
- •11)Строение и функции различных типов рнк (т-рнк, р-рнк, м-рнк).
- •12) Биосинтез рнк (транскрипция): условия, необходимые для транскрипции,
- •13) Биосинтез белков: (трансляция). Биологический код и его свойства.
- •15) Регуляция биосинтеза белков на уровне транскрипции (представление об
- •16) Регуляция биосинтеза белка на этапе транскрипции по механизму
- •17) Химическая природа ферментов. Проферменты, изоферменты,
- •18) Холоферменты: определение понятия, строение. Кофакторы ферментов:
- •19) Зависимость активности ферментов от реакции среды и
- •20) Структурно-функциональная организация ферментных белков:
- •21) Регуляторные (аллостерические) центры ферментов. Аллостерические
- •22)Активаторы и ингибиторы ферментов: химическая природа, виды
- •23) Специфичность действия ферментов. Виды специфичности ферментов,
- •24) Механизм действия ферментов. Зависимость активности ферментов от
- •25) Номенклатура и классификация ферментов. Характеристика отдельных
- •26) Определение активности ферментов в диагностике заболеваний.
- •27) Витамины. Классификация и номенклатура витаминов. Роль витаминов в
- •28) Витамин b1 (тиамин, антиневритиый): химическая природа, свойства,
- •29) Витамин в2 (рибофлавин): строение, свойства, признаки гиповитаминоза,
- •30) Витамин рр (ниацин, антипеллагрический): строение, признаки
- •31) Витамин с, (аскорбиновая кислота, антицинготный): химическое строение,
- •32) Витамин в6, (пиридоксин, антидерматитный): химическая природа,
- •33) Витамин а, (ретинол, антиксерофтальмический); химическая природа, признаки гиповитаминоза, источники, потребность. Участие витамина а в
- •34) Витамин д (кальциферолы, антирахитический витамин). Химическое
- •35) Обмен веществ и энергии. Анаболизм и катаболизм. Понятие о
- •36) Характеристика катаболизма: общая схема катаболизма основных
- •37) Понятие о биологическом окислении. Фазы биологического окисления, их
- •38) Ферменты биологического окисления. Пиридинзависимые дегидрогеназы:
- •39)Флавинзависимые дегидрогеназы
- •40.) Характеристика цитохромов: химическая природа коферментов, функции,
- •41.) Структурная организация цепей транспорта электронов I и II типа.
- •Электронтранспортные цепи митохондрий эукариот
- •Ингибиторы дыхательной цепи
- •42) Полное и неполное восстановление кислорода. Образование свободно-
- •Супероксид-анион (радикал)
- •Oh (гидроксил, гидроксид - радикалы.)
- •Гипохлорит-анион
- •Радикал
- •Механизмы возникновения афк
- •43) Окислительное фосфорилирование - главный механизм синтеза атф в
- •Хемиосмотическая теория Митчела
- •44) Разобщение тканевого дыхания и окислительного фосфорилирования,
- •45) Механизмы образования со2 в процессе биологического окисления.
- •46) Окисление ацетил-КоА в цикле трикарбоновых кислот:
- •48) Физиологическая роль углеводов. Потребности и источники
- •Обмен ув
- •49) Пути использования глюкозы в организме: общая схема поступления
- •50. Роль печени в обмене углеводов: глюкостатическая функция печени.
- •51) Роль печени в обмене углеводов: механизм гликогенолиза – основного
- •52. Общая характеристика внутриклеточного окисления глюкозы: пути распада
- •Катаболизм глюкозы.
- •53. Анаэробный гликолиз: определение, этапы гликолиза, химизм
- •54) Внутриклеточный обмен углеводов: Распад гликогена в мышцах в
- •56. Глюконеогенез: определение, субстраты глюконеогенеза. Обходные
- •Глюконеогенез.Аэробное окисление глюкозы.
- •55. Аэробный распад глюкозы - основной путь катаболизма глюкозы.
- •Аэробное окисление глюкозы.
- •57. Взаимосвязь гликолиза и глюконеогенеза (цикл Кори). Роль
Электронтранспортные цепи митохондрий эукариот
Комплекс I (НАДН дегидрогеназа) окисляет НАД-Н, отбирая у него два электрона и перенося их на растворимый в липидахубихинон, который внутри мембраны диффундирует к комплексу III. Вместе с этим, комплекс I перекачивает 4 протона из матрикса в межмембранное пространство митохондрии.
Комплекс II (Сукцинат дегидрогеназа) не перекачивает протоны, но обеспечивает вход в цепь дополнительных электронов за счёт окисления сукцината.
Комплекс III (Цитохром bc1 комплекс) переносит электроны с убихинона на два водорастворимых цитохрома с, расположенных на внутренней мембране митохондрии. Убихинон передаёт 2 электрона, а цитохромы за один цикл переносят по одному электрону. При этом туда также переходят 2 протона убихинона и перекачиваются комплексом.
Комплекс IV (Цитохром c оксидаза) катализирует перенос 4 электронов с 4 молекул цитохрома на O2 и перекачивает при этом 4 протона в межмембранное пространство. Комплекс состоит из цитохромов a и a3, которые, помимо гема, содержат ионы меди.
Кислород, поступающий в митохондрии из крови, связывается с атомом железа в геме цитохрома a3 в форме молекулы O2. Каждый из атомов кислорода присоединяет по два электрона и два протона и превращается в молекулу воды.
Ингибиторы дыхательной цепи
Некоторые вещества блокируют перенос электронов через комплексы I, II, III, IV .
Ингибиторы I комплекса — барбитураты, ротенон, пиерицидин
Ингибитор II комплекса — малонат.
Ингибитор III комплекса — антимицин А, миксотиазол, стигматтелин
Ингибиторы IV комплекса — сероводород, цианиды, угарный газ, оксид азота.
Дыхательная цепь является частью процесса окислительного фосфорилирования (см. с. 126). Компоненты дыхательной цепи катализируют перенос электронов от НАДН + Н+ или восстановленного убихинона (QH2) на молекулярный кислород. Из-за большой разности окислительно-восстановительных потенциалов донора (НАДН + Н+ и, соответственно, QH2) и акцептора (О2) реакция является высокоэкзергонической (см. с.24). Большая часть выделяющейся при этом энергии используется для создания градиента протонов (см. с. 128) и, наконец, для образования АТФ с помощью АТФ-синтазы.
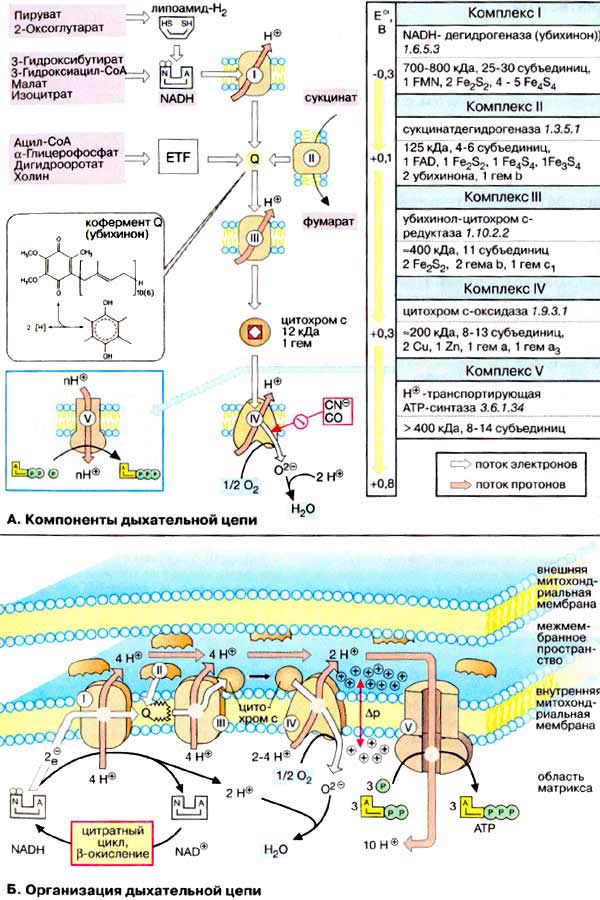
А. Компоненты дыхательной цепи
Дыхательная цепь включает три белковых комплекса (комплексы I, III и IV), встроенных во внутреннюю митохондриальную мембрану, и две подвижные молекулы-переносчики — убихинон (кофермент Q) и цитохром с. Сукцинатдегидрогеназа, принадлежащая собственно к цитратному циклу, также может рассматриваться как комплекс II дыхательной цепи. АТФ-синтаза (см. с. 144) иногда называется комплексом V, хотя она не принимает участия в переносе электронов.
Комплексы дыхательной цепи построены из множества полипептидов и содержат ряд различных окислительно-восстановительных коферментов, связанных с белками (см. сс. 108, 144). К ним принадлежат флавин [ФМН (FMN) или ФАД (FAD), в комплексах I и II], железо-серные центры (в I, II и III) и группы гема (в II, III и IV). Детальная структура большинства комплексов еще не установлена.
Электроны поступают в дыхательную цепь различными путями. При окислении НАДН + Н+ комплекс I переносит электроны через ФМН и Fe/S-центры на убихинон. Образующиеся при окислении сукцината, ацил-КоА и других субстратов электроны переносятся на убихинон комплексом II или другой митохондриальной дегидрогеназой через связанный с ферментом ФАДН2 или флавопротеин (см. с. 166), При этом окисленная форма кофермента Q восстанавливается в ароматический убигидрохинон. Последний переносит электроны в комплекс III, который поставляет их через два гема b, один Fe/S-центр и гем с1 на небольшой гемсодержащий белок цитохром с. Последний переносит электроны к комплексу IV, цитохром с-оксидазе.Цитохром с-оксидаза содержит для осуществления окислительно-восстановительных реакций два медьсодержащих центра (CuA и CuB) и гемы а и а3, через которые электроны, наконец, поступают к кислороду. При восстановлении О2 образуется сильный основной анион О2-, который связывает два протона и переходит а воду. Поток электронов сопряжен с образованным комплексами I, III и IV протонным градиентом.
Б. Организация дыхательной цепи
Перенос протонов комплексами I, III и IV протекает векторно из матрикса в межмембранное пространство. При переносе электронов в дыхательной цепи повышается концентрация ионов H+, т. е. понижается значение рН. В интактных митохондриях по существу только АТФ-синтаза (см. с. 144) позволяет осуществить обратное движение протонов в матрикс. На этом основано важное в регуляторном отношении сопряжение электронного переноса с образованием АТФ (см. с. 146).
Как уже упоминалось, все комплексы с I по V интегрированы во внутренней мембране митохондрий, тем не менее обычно они не контактируют друг с другом, так как электроны переносятся убихиноном и цитохромом с. Убихинон благодаря неполярной боковой цепи свободно перемещается вмембране. Водорастворимый цитохром с находится на внешней стороне внутренней мембраны.
Окисление НАДН (NADH) комплексом I происходит на внутренней стороне мембраны, а также в матриксе, где происходит также цитратный цикл и β-окисление — самые важные источники НАДН. В матриксе протекают, кроме того, восстановление O2 и образование АТФ (ATP). Полученный АТФпереносится по механизму антипорта (против АДФ) в межмембранное пространство (см. с. 214), откуда через порины проникает в цитоплазму.
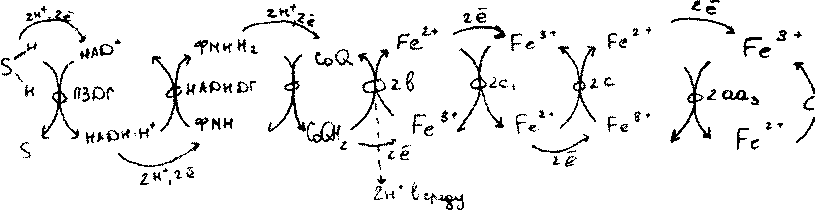 ЦТЭ1
ЦТЭ1
Современное представление о стру-ре дых.путей.
В наст.время ЦТЭ рассм-я как сложный мульти/ комплекс,^ локализован во внутренней митохондрианальной мембране и состоит из 5 комплексов
комплекс Н А ЯН - убихинон-ред уктаза осуществляет перенос протонов и ё
HAflH*+CoQ—>НАД*+СоС>Н2
Сложнай флавопротеидный комплекс,состоит из 25 полипептидных цепей,НАДН связ-йй центр обращён в сторону матрикса. Катализирует суум-ю р-ию восстан-я СоСКидёт в несколько стадий)При этом атомы Н от НАДН переносятся на ФМН,затем на железосерные белки далее на убихинон.
комплекс-сукцинат-убихинон-редуктаза
Осуществляет перенос протонов и ё от ФАДН2 на CoQ ч\з железосерные белки
убихинон-цитохромС-редуктаза.Осуществляет перенос ё от воос-ого CoQ на цитохром С,при этом происходит трансмембранный перенос протонов в митох.матриксе,а из него наружу.
комплекс цитохром-оксидаза.Катализирует окисление цитохрома С,мол-и
02.
АТФ-синтетаза
