- •Предмет и задачи биологической химии
- •Функции белков в организме. Строение белков.
- •Физико-химические свойства белков. Ионизация белков в
- •4) Физико-химические свойства белков: гидратация и растворимость
- •Осаждение белков из растворов. Виды осаждения белков (обратимое и
- •Денатурация белков: факторы, вызывающие денатурацию белков:
- •Классификация белков. Простые и сложные белки
- •Дезоксирибонуклеиновые кислоты (днк): состав, строение, свойства,
- •Биосинтез днк (репликация генов): общий принцип матричного синтеза,
- •11)Строение и функции различных типов рнк (т-рнк, р-рнк, м-рнк).
- •12) Биосинтез рнк (транскрипция): условия, необходимые для транскрипции,
- •13) Биосинтез белков: (трансляция). Биологический код и его свойства.
- •15) Регуляция биосинтеза белков на уровне транскрипции (представление об
- •16) Регуляция биосинтеза белка на этапе транскрипции по механизму
- •17) Химическая природа ферментов. Проферменты, изоферменты,
- •18) Холоферменты: определение понятия, строение. Кофакторы ферментов:
- •19) Зависимость активности ферментов от реакции среды и
- •20) Структурно-функциональная организация ферментных белков:
- •21) Регуляторные (аллостерические) центры ферментов. Аллостерические
- •22)Активаторы и ингибиторы ферментов: химическая природа, виды
- •23) Специфичность действия ферментов. Виды специфичности ферментов,
- •24) Механизм действия ферментов. Зависимость активности ферментов от
- •25) Номенклатура и классификация ферментов. Характеристика отдельных
- •26) Определение активности ферментов в диагностике заболеваний.
- •27) Витамины. Классификация и номенклатура витаминов. Роль витаминов в
- •28) Витамин b1 (тиамин, антиневритиый): химическая природа, свойства,
- •29) Витамин в2 (рибофлавин): строение, свойства, признаки гиповитаминоза,
- •30) Витамин рр (ниацин, антипеллагрический): строение, признаки
- •31) Витамин с, (аскорбиновая кислота, антицинготный): химическое строение,
- •32) Витамин в6, (пиридоксин, антидерматитный): химическая природа,
- •33) Витамин а, (ретинол, антиксерофтальмический); химическая природа, признаки гиповитаминоза, источники, потребность. Участие витамина а в
- •34) Витамин д (кальциферолы, антирахитический витамин). Химическое
- •35) Обмен веществ и энергии. Анаболизм и катаболизм. Понятие о
- •36) Характеристика катаболизма: общая схема катаболизма основных
- •37) Понятие о биологическом окислении. Фазы биологического окисления, их
- •38) Ферменты биологического окисления. Пиридинзависимые дегидрогеназы:
- •39)Флавинзависимые дегидрогеназы
- •40.) Характеристика цитохромов: химическая природа коферментов, функции,
- •41.) Структурная организация цепей транспорта электронов I и II типа.
- •Электронтранспортные цепи митохондрий эукариот
- •Ингибиторы дыхательной цепи
- •42) Полное и неполное восстановление кислорода. Образование свободно-
- •Супероксид-анион (радикал)
- •Oh (гидроксил, гидроксид - радикалы.)
- •Гипохлорит-анион
- •Радикал
- •Механизмы возникновения афк
- •43) Окислительное фосфорилирование - главный механизм синтеза атф в
- •Хемиосмотическая теория Митчела
- •44) Разобщение тканевого дыхания и окислительного фосфорилирования,
- •45) Механизмы образования со2 в процессе биологического окисления.
- •46) Окисление ацетил-КоА в цикле трикарбоновых кислот:
- •48) Физиологическая роль углеводов. Потребности и источники
- •Обмен ув
- •49) Пути использования глюкозы в организме: общая схема поступления
- •50. Роль печени в обмене углеводов: глюкостатическая функция печени.
- •51) Роль печени в обмене углеводов: механизм гликогенолиза – основного
- •52. Общая характеристика внутриклеточного окисления глюкозы: пути распада
- •Катаболизм глюкозы.
- •53. Анаэробный гликолиз: определение, этапы гликолиза, химизм
- •54) Внутриклеточный обмен углеводов: Распад гликогена в мышцах в
- •56. Глюконеогенез: определение, субстраты глюконеогенеза. Обходные
- •Глюконеогенез.Аэробное окисление глюкозы.
- •55. Аэробный распад глюкозы - основной путь катаболизма глюкозы.
- •Аэробное окисление глюкозы.
- •57. Взаимосвязь гликолиза и глюконеогенеза (цикл Кори). Роль
23) Специфичность действия ферментов. Виды специфичности ферментов,
биологическое значение специфичности действия ферментов
Специфичность ферментов: субстратная; действия.
Субстратная специфичность — способность фермента
катализировать превращения только одного
определенного субстрата или же группы сходных по
строению субстратов. Определяется структурой адсорбционного
участка активного центра фермента.
Типы субстратной специфичности:
••абсолютная — способность фермента катализировать
превращение только одного, строго определенного
субстрата;
••относительная — способность фермента катализировать
превращения нескольких сходных по строению
субстратов;
••стереоспецифичность — способность фермента катализировать
превращения определенных стереоизомеров.
Специфичность действия — способность фермента
катализировать только определенный тип химической
реакции. В соответствии со специфичностью
действия все ферменты делятся на 6 классов.
Классы ферментов обозначаются латинскими цифрами.
Название каждого класса ферментов соответствует
этой цифре.
Классификация ферментов.
I класс — оксидоредуктазы — ферменты, катализирующие
окислительно-восстановительные реакции.
При окислении происходит либо отнятие водорода
от окисляемого вещества, либо присоединение
кислорода к окисляемому веществу. В зависимости
от способа окисления различают следующие подклассы:
1) дегидрогеназы — катализируют реакции, при которых
происходит отнятие водорода от окисляемого
вещества;
2) оксигеназы — катализируют включение кислорода
в окисляемое вещество:
••монооксигеназы — включают 1 атом кислорода в
окисляемое вещество;
••диоксигеназы — включают 2 атома кислорода в
окисляемое вещество. Часто это сопровождается
разрывом циклической структуры. По месту разрыва
связи присоединяются атомы кислорода.
II класс — трансферазы — катализируют реакции
переноса химических групп с молекулы одного вещества
на молекулу другого вещества.
III класс — гидролазы — катализируют реакции
разрушения химических связей с участием воды.
IV класс — лиазы — катализируют реакции разрушения
химических связей без участия воды.
V класс — изомеразы — катализируют реакции
изомерных превращений.
VI класс — лигазы (сингазы, синтетазы) — катализируют
реакции синтеза.
24) Механизм действия ферментов. Зависимость активности ферментов от
концентрации субстрата и фермента.
Концентрация субстрата
Одним из наиболее существенных факторов, определяющих скорость
ферментативной реакции, является концентрация субстрата (или субстратов)
и продукта (продуктов). В случае постоянной концентрации фермента ско-
рость реакции постепенно увеличивается, достигая определенного максиму-
ма (рис. 14.15), при котором дальнейшее увеличение количества субстрата
практически не оказывает влияния на скорость ферментативной реакции. В
таких случаях принято считать, что субстрат находится в избытке, а фермент
полностью насыщен, т. е. все молекулы фермента связаны с субстратом.
Фактором, ограничивающим скорость реакции, при этом становится концен-
трация фермента.
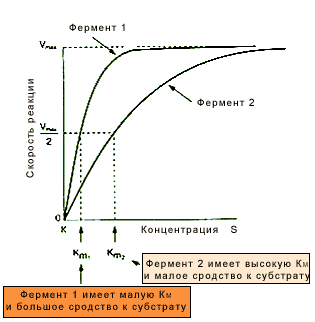
Концентрацияфермента
Скорость любой ферментативной реакции непосредственно зависит от
концентрации фермента (рис.14.16). Линейная зависимость между этими ве-
личинами, когда скорость реакции прямо пропорциональна количеству при-
сутствующего фермента, справедлива только в определенных условиях, на-
пример в начальный период ферментативной реакции, т. к. в этот период
практически не происходит обратной реакции, а концентрация продукта ока-
зывается недостаточной для обратимости реакции. Именно в этом случае
скорость реакции (точнее, начальная скорость реакции v) будет пропорцио-
нальна концентрации фермента