
- •Предмет и задачи биологической химии
- •Функции белков в организме. Строение белков.
- •Физико-химические свойства белков. Ионизация белков в
- •4) Физико-химические свойства белков: гидратация и растворимость
- •Осаждение белков из растворов. Виды осаждения белков (обратимое и
- •Денатурация белков: факторы, вызывающие денатурацию белков:
- •Классификация белков. Простые и сложные белки
- •Дезоксирибонуклеиновые кислоты (днк): состав, строение, свойства,
- •Биосинтез днк (репликация генов): общий принцип матричного синтеза,
- •11)Строение и функции различных типов рнк (т-рнк, р-рнк, м-рнк).
- •12) Биосинтез рнк (транскрипция): условия, необходимые для транскрипции,
- •13) Биосинтез белков: (трансляция). Биологический код и его свойства.
- •15) Регуляция биосинтеза белков на уровне транскрипции (представление об
- •16) Регуляция биосинтеза белка на этапе транскрипции по механизму
- •17) Химическая природа ферментов. Проферменты, изоферменты,
- •18) Холоферменты: определение понятия, строение. Кофакторы ферментов:
- •19) Зависимость активности ферментов от реакции среды и
- •20) Структурно-функциональная организация ферментных белков:
- •21) Регуляторные (аллостерические) центры ферментов. Аллостерические
- •22)Активаторы и ингибиторы ферментов: химическая природа, виды
- •23) Специфичность действия ферментов. Виды специфичности ферментов,
- •24) Механизм действия ферментов. Зависимость активности ферментов от
- •25) Номенклатура и классификация ферментов. Характеристика отдельных
- •26) Определение активности ферментов в диагностике заболеваний.
- •27) Витамины. Классификация и номенклатура витаминов. Роль витаминов в
- •28) Витамин b1 (тиамин, антиневритиый): химическая природа, свойства,
- •29) Витамин в2 (рибофлавин): строение, свойства, признаки гиповитаминоза,
- •30) Витамин рр (ниацин, антипеллагрический): строение, признаки
- •31) Витамин с, (аскорбиновая кислота, антицинготный): химическое строение,
- •32) Витамин в6, (пиридоксин, антидерматитный): химическая природа,
- •33) Витамин а, (ретинол, антиксерофтальмический); химическая природа, признаки гиповитаминоза, источники, потребность. Участие витамина а в
- •34) Витамин д (кальциферолы, антирахитический витамин). Химическое
- •35) Обмен веществ и энергии. Анаболизм и катаболизм. Понятие о
- •36) Характеристика катаболизма: общая схема катаболизма основных
- •37) Понятие о биологическом окислении. Фазы биологического окисления, их
- •38) Ферменты биологического окисления. Пиридинзависимые дегидрогеназы:
- •39)Флавинзависимые дегидрогеназы
- •40.) Характеристика цитохромов: химическая природа коферментов, функции,
- •41.) Структурная организация цепей транспорта электронов I и II типа.
- •Электронтранспортные цепи митохондрий эукариот
- •Ингибиторы дыхательной цепи
- •42) Полное и неполное восстановление кислорода. Образование свободно-
- •Супероксид-анион (радикал)
- •Oh (гидроксил, гидроксид - радикалы.)
- •Гипохлорит-анион
- •Радикал
- •Механизмы возникновения афк
- •43) Окислительное фосфорилирование - главный механизм синтеза атф в
- •Хемиосмотическая теория Митчела
- •44) Разобщение тканевого дыхания и окислительного фосфорилирования,
- •45) Механизмы образования со2 в процессе биологического окисления.
- •46) Окисление ацетил-КоА в цикле трикарбоновых кислот:
- •48) Физиологическая роль углеводов. Потребности и источники
- •Обмен ув
- •49) Пути использования глюкозы в организме: общая схема поступления
- •50. Роль печени в обмене углеводов: глюкостатическая функция печени.
- •51) Роль печени в обмене углеводов: механизм гликогенолиза – основного
- •52. Общая характеристика внутриклеточного окисления глюкозы: пути распада
- •Катаболизм глюкозы.
- •53. Анаэробный гликолиз: определение, этапы гликолиза, химизм
- •54) Внутриклеточный обмен углеводов: Распад гликогена в мышцах в
- •56. Глюконеогенез: определение, субстраты глюконеогенеза. Обходные
- •Глюконеогенез.Аэробное окисление глюкозы.
- •55. Аэробный распад глюкозы - основной путь катаболизма глюкозы.
- •Аэробное окисление глюкозы.
- •57. Взаимосвязь гликолиза и глюконеогенеза (цикл Кори). Роль
20) Структурно-функциональная организация ферментных белков:
активный центр, его свойства. Контактный и каталитические участки
активного центра
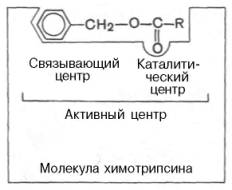
Активный центр фермента — участок поверхности
молекулы фермента, непосредственно взаимодействующий
с молекулой субстрата. Образован из
остатков аминокислот, находящихся в составе различных
участков полипептидной цепи или различных
полипептидных цепей, пространственно сближенных.
Возникает на уровне третичной структуры белка-фермента.
В его пределах различают три области:
1) каталитический центр — область (зона) активного
центра фермента, непосредственно участвующая
в химических преобразованиях субстрата. Формируется
за счет радикалов 2–3 аминокислот, расположенных
в разных местах полипептидной цепи
фермента, но пространственно сближенных между
собой за счет изгибов этой цепи. Если фермент —
сложный белок, то в формировании каталитического
центра нередко участвует простетическая группа
молекулы фермента — кофермент (например, все
водорастворимые витамины и жирорастворимый
витамин K);
2) адсорбционный центр — участок активного
центра молекулы фермента, на котором происходит
сорбция (связывание) молекулы субстрата. Формируется
1, 2, чаще 3 радикалами аминокислот, расположенными
рядом с каталитическим центром. Главная
функция — связывание молекулы субстрата и передача
этой молекулы каталитическому центру в
наиболее удобном положении (для каталитического
центра). Сорбция происходит только за счет слабых
типов связей и потому обратима. По мере формирования
этих связей происходит конформационная перестройка
адсорбционного центра, которая приводит
к более тесному сближению субстрата и активного
центра фермента, более точному соответствию между
их пространственными конфигурациями. Именно
структура адсорбционного центра определяет субстратную
специфичность фермента;
3) аллостерические центры — такие участки молекулы
фермента вне его активного центра, которые
способны связываться слабыми типами связей (значит
— обратимо) с тем или иным веществом (лигандом).
Это связывание приводит к такой конформационной
перестройке молекулы фермента, которая
распространяется и на активный центр, облегчая либо
затрудняя (замедляя) его работу. Соответственно
такие вещества называются аллостерическими активаторами,
или аллостерическими ингибиторами данного
фермента. Аллостерические центры найдены не
у всех ферментов.__
21) Регуляторные (аллостерические) центры ферментов. Аллостерические
модуляторы ферментов. Зависимость активности ферментов от
конформации белков.
аллостерические центры — такие участки молекулы
фермента вне его активного центра, которые
способны связываться слабыми типами связей (значит
— обратимо) с тем или иным веществом (лигандом).
Это связывание приводит к такой конформационной
перестройке молекулы фермента, которая
распространяется и на активный центр, облегчая либо
затрудняя (замедляя) его работу. Соответственно
такие вещества называются аллостерическими активаторами,
или аллостерическими ингибиторами данного
фермента. Аллостерические центры найдены не
у всех ферментов.
Помимо активного центра, в молекуле фермента может присутствовать также аллостерический центр (или центры) (от греч. allos – другой, иной и steros – пространственный, структурный), представляющий собой участок молекулы фермента, с которым связываются определенные, обычно низкомолекулярные, вещества (эффекторы, или модификаторы), молекулы которых отличаются по структуре от субстратов. Присоединение эффектора к аллостерическому центру изменяет третичную и часто также четвертичную структуру молекулы фермента и соответственно конфигурацию активного центра, вызывая снижение или повышение энзимати-ческой активности. Ферменты, активность каталитического центра которых подвергается изменению под влиянием аллостерических эффекторов, связывающихся с аллостерическим центром, получили название аллосте-рических ферментов.
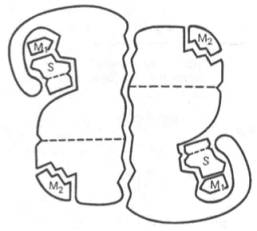
Рис. 4.4. Схематическое изображение аллостерического фермента, состоящего из двух протомеров, соединенных по типу гетерологи-ческой («голова»-«хвост») ассоциации (по Кошленду). S – субстрат; М1 – модификатор, связывающийся в активном центре; М2 – модификатор, связывающийся в аллосте-рическом центре (эффектор).
Отличительной особенностью ряда аллостерических ферментов является наличие в молекуле олигомерного фермента нескольких активных центров и нескольких аллостерических регуляторных центров, пространственно удаленных друг от друга. В аллостерическом ферменте каждый из двух симметрично построенных протомеров содержит один активный центр, связывающий субстрат S, и один аллостерический центр, связывающий эффектор М2, т.е. 2 центра в одной молекуле фермента (рис. 4.4)
