
- •Предмет и задачи биологической химии
- •Функции белков в организме. Строение белков.
- •Физико-химические свойства белков. Ионизация белков в
- •4) Физико-химические свойства белков: гидратация и растворимость
- •Осаждение белков из растворов. Виды осаждения белков (обратимое и
- •Денатурация белков: факторы, вызывающие денатурацию белков:
- •Классификация белков. Простые и сложные белки
- •Дезоксирибонуклеиновые кислоты (днк): состав, строение, свойства,
- •Биосинтез днк (репликация генов): общий принцип матричного синтеза,
- •11)Строение и функции различных типов рнк (т-рнк, р-рнк, м-рнк).
- •12) Биосинтез рнк (транскрипция): условия, необходимые для транскрипции,
- •13) Биосинтез белков: (трансляция). Биологический код и его свойства.
- •15) Регуляция биосинтеза белков на уровне транскрипции (представление об
- •16) Регуляция биосинтеза белка на этапе транскрипции по механизму
- •17) Химическая природа ферментов. Проферменты, изоферменты,
- •18) Холоферменты: определение понятия, строение. Кофакторы ферментов:
- •19) Зависимость активности ферментов от реакции среды и
- •20) Структурно-функциональная организация ферментных белков:
- •21) Регуляторные (аллостерические) центры ферментов. Аллостерические
- •22)Активаторы и ингибиторы ферментов: химическая природа, виды
- •23) Специфичность действия ферментов. Виды специфичности ферментов,
- •24) Механизм действия ферментов. Зависимость активности ферментов от
- •25) Номенклатура и классификация ферментов. Характеристика отдельных
- •26) Определение активности ферментов в диагностике заболеваний.
- •27) Витамины. Классификация и номенклатура витаминов. Роль витаминов в
- •28) Витамин b1 (тиамин, антиневритиый): химическая природа, свойства,
- •29) Витамин в2 (рибофлавин): строение, свойства, признаки гиповитаминоза,
- •30) Витамин рр (ниацин, антипеллагрический): строение, признаки
- •31) Витамин с, (аскорбиновая кислота, антицинготный): химическое строение,
- •32) Витамин в6, (пиридоксин, антидерматитный): химическая природа,
- •33) Витамин а, (ретинол, антиксерофтальмический); химическая природа, признаки гиповитаминоза, источники, потребность. Участие витамина а в
- •34) Витамин д (кальциферолы, антирахитический витамин). Химическое
- •35) Обмен веществ и энергии. Анаболизм и катаболизм. Понятие о
- •36) Характеристика катаболизма: общая схема катаболизма основных
- •37) Понятие о биологическом окислении. Фазы биологического окисления, их
- •38) Ферменты биологического окисления. Пиридинзависимые дегидрогеназы:
- •39)Флавинзависимые дегидрогеназы
- •40.) Характеристика цитохромов: химическая природа коферментов, функции,
- •41.) Структурная организация цепей транспорта электронов I и II типа.
- •Электронтранспортные цепи митохондрий эукариот
- •Ингибиторы дыхательной цепи
- •42) Полное и неполное восстановление кислорода. Образование свободно-
- •Супероксид-анион (радикал)
- •Oh (гидроксил, гидроксид - радикалы.)
- •Гипохлорит-анион
- •Радикал
- •Механизмы возникновения афк
- •43) Окислительное фосфорилирование - главный механизм синтеза атф в
- •Хемиосмотическая теория Митчела
- •44) Разобщение тканевого дыхания и окислительного фосфорилирования,
- •45) Механизмы образования со2 в процессе биологического окисления.
- •46) Окисление ацетил-КоА в цикле трикарбоновых кислот:
- •48) Физиологическая роль углеводов. Потребности и источники
- •Обмен ув
- •49) Пути использования глюкозы в организме: общая схема поступления
- •50. Роль печени в обмене углеводов: глюкостатическая функция печени.
- •51) Роль печени в обмене углеводов: механизм гликогенолиза – основного
- •52. Общая характеристика внутриклеточного окисления глюкозы: пути распада
- •Катаболизм глюкозы.
- •53. Анаэробный гликолиз: определение, этапы гликолиза, химизм
- •54) Внутриклеточный обмен углеводов: Распад гликогена в мышцах в
- •56. Глюконеогенез: определение, субстраты глюконеогенеза. Обходные
- •Глюконеогенез.Аэробное окисление глюкозы.
- •55. Аэробный распад глюкозы - основной путь катаболизма глюкозы.
- •Аэробное окисление глюкозы.
- •57. Взаимосвязь гликолиза и глюконеогенеза (цикл Кори). Роль
16) Регуляция биосинтеза белка на этапе транскрипции по механизму
репрессии (на примере гистидинового оперона). Понятие о корепрессорах.
См.15
17) Химическая природа ферментов. Проферменты, изоферменты,
мультиферментные комплексы (метаболоны). Привести примеры.
Ферменты (энзимы) — высокоспецифичные белки,
выполняющие функции биологических катализаторов
Изоферменты, или изоэнзимы — это различные по аминокислотной последовательности изоформы или изотипы одного и того же фермента, существующие в одном организме, но, как правило, в разных его клетках, тканях или органах.
Изоферменты, как правило, высоко гомологичны по аминокислотной последовательности и/или подобны по пространственной конфигурации. Особенно консервативны в сохранении строения активные центры молекул изоферментов. Все изоферменты одного и того же фермента выполняют одну и ту же каталитическую функцию, но могут значительно различаться по степени каталитической активности, по особенностям регуляции или другим свойствам.
Примером фермента, имеющего изоферменты, является гексокиназа, имеющая четыре изотипа, обозначаемых римскими цифрами от I до IV. При этом один из изотипов гексокиназы, а именно гексокиназа IV, экспрессируется почти исключительно в печени и обладает особыми физиологическими свойствами, в частности её активность не угнетается продуктом её реакции глюкозо-6-фосфатом.
Ещё одним примером фермента, имеющего изоферменты, является амилаза — панкреатическая амилаза отличается по аминокислотной последовательности и свойствам от амилазы слюнных желёз, кишечника и других органов. Это послужило основой для разработки и применения более надёжного метода диагностики острого панкреатита путём определения не общей амилазы плазмы крови, а именно панкреатической изоамилазы.
Третьим примером фермента, имеющего изоферменты, является креатинфосфокиназа — изотип этого фермента, экспрессируемый в сердце, отличается по аминокислотной последовательности от креатинфосфокиназы скелетных мышц. Это позволяет дифференцировать повреждения миокарда (например, при инфаркте миокарда) от других причин повышения активности КФК, определяя миокардиальный изотип КФК в крови.
Проферменты, или проэнзимы, зимогены, энзимогены — функционально неактивные предшественники ферментов, подвергающиеся тем или иным преобразованиям (обычно расщеплению специфическими эндо- или экзопептидазами или гидролизу), в результате чего образуется каталитически активный продукт — фермент. Относятся к группе протеиназ(сериновые, тиоловые, кислые). Синтез зимогенов осуществляется на рибосомах эндоплазматического ретикулума особыми секреторными клетками в виде зимогенных гранул, которые после завершения процесса мигрируют к поверхности клеток и затем секретируются в окружающую среду. Достигнув места действия они превращаются в активные формы ферментов. К ним относятся пепсиноген, активной формой которого является пепсин (основной протеолитический фермент желудочного сока), трипсиноген — трипсин, химотрипсиноген — химотрипсин, прокарбоксилепептидазы — карбоксипептидазы (ферменты поджелудочной железы) и др. К зимогенам относятся ферменты свёртывания крови (факторы свёртывания крови), компоненты и факторы системы комплемента.
Мууллььттииффееррммееннттнныыее ккооммппллееккссыы
В мультиферментном комплексе несколько ферментов прочно связаны междусобой в
единый комплекс и осуществляют ряд последовательных реакций, в которых продукт
реакции непосредственно передается на следующий фермент и является только его
субстратом. Благодаря таким комплексам значительно ускоряется скорость
превращения молекул.
Строение мульферментного комплекса
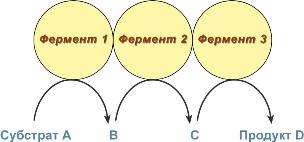
Например,
пируватдегидрогеназный комплекс (пируватдегидрогеназа), превращающий
пируват в ацетил-SКоА,
α-кетоглутаратдегидрогеназный комплекс (в цикле трикарбоновыхкислот)
превращающий α-кетоглутарат в сукцинил-SКоА,
комплекс под названием "синтаза жирных кислот" (или пальмитатсинтаза),
синтезирующий пальмитиновую кислоту.
