
- •Предмет и задачи биологической химии
- •Функции белков в организме. Строение белков.
- •Физико-химические свойства белков. Ионизация белков в
- •4) Физико-химические свойства белков: гидратация и растворимость
- •Осаждение белков из растворов. Виды осаждения белков (обратимое и
- •Денатурация белков: факторы, вызывающие денатурацию белков:
- •Классификация белков. Простые и сложные белки
- •Дезоксирибонуклеиновые кислоты (днк): состав, строение, свойства,
- •Биосинтез днк (репликация генов): общий принцип матричного синтеза,
- •11)Строение и функции различных типов рнк (т-рнк, р-рнк, м-рнк).
- •12) Биосинтез рнк (транскрипция): условия, необходимые для транскрипции,
- •13) Биосинтез белков: (трансляция). Биологический код и его свойства.
- •15) Регуляция биосинтеза белков на уровне транскрипции (представление об
- •16) Регуляция биосинтеза белка на этапе транскрипции по механизму
- •17) Химическая природа ферментов. Проферменты, изоферменты,
- •18) Холоферменты: определение понятия, строение. Кофакторы ферментов:
- •19) Зависимость активности ферментов от реакции среды и
- •20) Структурно-функциональная организация ферментных белков:
- •21) Регуляторные (аллостерические) центры ферментов. Аллостерические
- •22)Активаторы и ингибиторы ферментов: химическая природа, виды
- •23) Специфичность действия ферментов. Виды специфичности ферментов,
- •24) Механизм действия ферментов. Зависимость активности ферментов от
- •25) Номенклатура и классификация ферментов. Характеристика отдельных
- •26) Определение активности ферментов в диагностике заболеваний.
- •27) Витамины. Классификация и номенклатура витаминов. Роль витаминов в
- •28) Витамин b1 (тиамин, антиневритиый): химическая природа, свойства,
- •29) Витамин в2 (рибофлавин): строение, свойства, признаки гиповитаминоза,
- •30) Витамин рр (ниацин, антипеллагрический): строение, признаки
- •31) Витамин с, (аскорбиновая кислота, антицинготный): химическое строение,
- •32) Витамин в6, (пиридоксин, антидерматитный): химическая природа,
- •33) Витамин а, (ретинол, антиксерофтальмический); химическая природа, признаки гиповитаминоза, источники, потребность. Участие витамина а в
- •34) Витамин д (кальциферолы, антирахитический витамин). Химическое
- •35) Обмен веществ и энергии. Анаболизм и катаболизм. Понятие о
- •36) Характеристика катаболизма: общая схема катаболизма основных
- •37) Понятие о биологическом окислении. Фазы биологического окисления, их
- •38) Ферменты биологического окисления. Пиридинзависимые дегидрогеназы:
- •39)Флавинзависимые дегидрогеназы
- •40.) Характеристика цитохромов: химическая природа коферментов, функции,
- •41.) Структурная организация цепей транспорта электронов I и II типа.
- •Электронтранспортные цепи митохондрий эукариот
- •Ингибиторы дыхательной цепи
- •42) Полное и неполное восстановление кислорода. Образование свободно-
- •Супероксид-анион (радикал)
- •Oh (гидроксил, гидроксид - радикалы.)
- •Гипохлорит-анион
- •Радикал
- •Механизмы возникновения афк
- •43) Окислительное фосфорилирование - главный механизм синтеза атф в
- •Хемиосмотическая теория Митчела
- •44) Разобщение тканевого дыхания и окислительного фосфорилирования,
- •45) Механизмы образования со2 в процессе биологического окисления.
- •46) Окисление ацетил-КоА в цикле трикарбоновых кислот:
- •48) Физиологическая роль углеводов. Потребности и источники
- •Обмен ув
- •49) Пути использования глюкозы в организме: общая схема поступления
- •50. Роль печени в обмене углеводов: глюкостатическая функция печени.
- •51) Роль печени в обмене углеводов: механизм гликогенолиза – основного
- •52. Общая характеристика внутриклеточного окисления глюкозы: пути распада
- •Катаболизм глюкозы.
- •53. Анаэробный гликолиз: определение, этапы гликолиза, химизм
- •54) Внутриклеточный обмен углеводов: Распад гликогена в мышцах в
- •56. Глюконеогенез: определение, субстраты глюконеогенеза. Обходные
- •Глюконеогенез.Аэробное окисление глюкозы.
- •55. Аэробный распад глюкозы - основной путь катаболизма глюкозы.
- •Аэробное окисление глюкозы.
- •57. Взаимосвязь гликолиза и глюконеогенеза (цикл Кори). Роль
13) Биосинтез белков: (трансляция). Биологический код и его свойства.
Основные компоненты белоксинтезирующей системы. Роль м-РНК, т-РНК,
и рибосом в биосинтезе белков. Активация аминокислот и образование
аминоацил-т-РНК. Характеристика АРС-азы, т-РНК. Антикодоны.
Синтез белков обеспечивают
рибосомы
Трансляция (синтез белка)
Трансляция (англ. translation – перевод) – это биосинтез белка на матрице мРНК.
После переноса информации с ДНК на матричную РНК начинается синтез белков.
Каждая зрелая мРНК несет информацию только об одной полипептидной цепи. Если
клетке необходимы другие белки, то необходимо транскрибировать мРНК с иных
участков ДНК.
Биосинтез белков или трансляция происходит на рибосомах, внутриклеточных
белоксинтезирующих органеллах, и включает 5 ключевыхэлементов:
матрица – матричная РНК,
растущая цепь – полипептид,
субстрат для синтеза – 20 протеиногенных аминокислот,
источник энергии – ГТФ,
рибосомальные белки, рРНК и белковые факторы.
Выделяют три основныхстадии трансляции: инициация, элонгация, терминация.
Инициация
Для инициации необходимы мРНК, ГТФ, малая и большая субъединицы рибосомы, три
белковых фактора инициации (ИФ-1, ИФ-2, ИФ-3), метионин и тРНК для метионина.
В начале этой стадии формируются два тройныхкомплекса:
первый комплекс – мРНК + малая субъединица + ИФ-3,
второй комплекс – метионил-тРНК + ИФ-2 + ГТФ.
После формирования тройные комплексы объединяются с большой субъединицей
рибосомы. В этом процессе активно участвуют белковые факторы инициации,
источником энергии служит ГТФ. После сборки комплекса инициирующая метионил-
тРНК связывается с первым кодоном АУГ матричной РНК и располагается в П-центре
(пептидильный центр) большой субъединицы. А-центр (аминоацильный центр) остается
свободным, он будет задействован на стадии элонгации для связывания аминоацил-
тРНК.
События стадии инициации
После присоединения большой субъединицы начинается стадия элонгации.
Элонгация
Для этой стадии необходимы все 20 аминокислот, тРНК для всех аминокислот,
белковые факторы элонгации, ГТФ. Удлинение цепи происходит со скоростью примерно
20 аминокислот в секунду.
Элонгация представляет собой циклический процесс. Первый цикл (и следующие
циклы) элонгации включает три шага:
1. Присоединение аминоацил-тРНК (еще второй) к кодонумРНК (еще
второму), аминокислота при этом встраивается в А-центр рибосомы. Источником
энергии служит ГТФ.
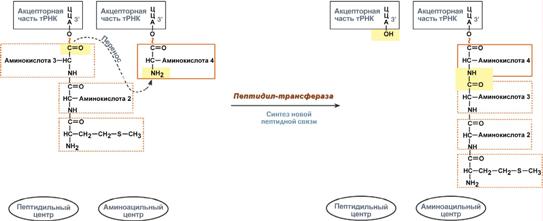
2. Фермент пептидилтрансфераза осуществляет перенос метионина с метионил-
тРНК (в П-центре) на вторую аминоацил-тРНК (в А-центре) с образованием
пептидной связи междуметионином и второй аминокислотой. При этом уже
активированная СООН-группа метионина связывается со свободной NH2
-группой
второй аминокислоты. Здесь источником энергии служит макроэргическая связь
между аминокислотой и тРНК.
3. Фермент транслоказа перемещает мРНК относительно рибосомы таким образом,
что первый кодон АУГ оказывается вне рибосомы, второй кодон (на рисунке )
становится напротив П-центра, напротив А-центра оказывается третий кодон (на
рисунке ). Для этих процессов необходима затрата энергии ГТФ. Так как вместе с
мРНК перемещаются закрепленные на ней тРНК, то инициирующая первая тРНК
выходит из рибосомы, вторая тРНК с дипептидом помещается в П-центр.
Последовательность событий стадии элонгации
Второе повторение цикла – начинается с присоединения третьей аминоацил-тРНК к
третьемукодонумРНК, аминокислота-3 становится в А-центр. Далее трансферазная
реакции повторяется и образуется трипептид, занимающий А-центр, после чего он
смещается в П-центр в транслоказной реакции..
В пустой А-центр входит четвертая аминоацил-тРНК и начинается третий цикл элонгации
Цикл элонгации (реакции 1,2,3) повторяется столько раз, сколько аминокислот
необходимо включить в полипептидную цепь.
Терминация
Синтез белка продолжается до тех пор, пока рибосома не достигнет на мРНК особых
терминирующихкодонов – стоп-кодонов УАА, УАГ, УГА. Данные триплеты не кодируют ни
одной из аминокислот, ихтакже называют нонсенс-кодоны. При вхождении этих
кодонов внутрь рибосомы происходит активация белковых факторов терминации,
которые последовательно катализируют:
1. Гидролитическое отщепление полипептида от конечной тРНК.
2. Отделение от П-центра последней, уже пустой, тРНК.
3. Диссоциацию рибосомы.
Источником энергии для завершения трансляции является ГТФ
Генети́ческий код — свойственный всем живым организмам способ кодирования аминокислотной последовательности белков при помощи последовательности нуклеотидов.
В ДНК используется четыре азотистых основания — аденин (А), гуанин (G), цитозин (С), тимин (T), которые в русскоязычной литературе обозначаются буквами А, Г, Ц и Т. Эти буквы составляют алфавит генетического кода. В РНК используются те же нуклеотиды, за исключением тимина, который заменён похожим нуклеотидом — урацилом, который обозначается буквой U (У в русскоязычной литературе). В молекулах ДНК и РНК нуклеотиды выстраиваются в цепочки и, таким образом, получаются последовательности генетических букв.

Генетический код
Белки практически всех живых организмов построены из аминокислот всего 20 видов. Эти аминокислоты называют каноническими. Каждый белок представляет собой цепочку или несколько цепочек аминокислот, соединённых в строго определённой последовательности. Эта последовательность определяет строение белка, а следовательно все его биологические свойства.
Реализация генетической информации в живых клетках (то есть синтез белка, кодируемого геном) осуществляется при помощи двух матричных процессов: транскрипции (то есть синтеза мРНК на матрице ДНК) и трансляции генетического кода в аминокислотную последовательность (синтез полипептидной цепи на мРНК). Для кодирования 20 аминокислот, а также сигнала «стоп», означающего конец белковой последовательности, достаточно трёх последовательных нуклеотидов. Набор из трёх нуклеотидов называется триплетом. Принятые сокращения, соответствующие аминокислотам и кодонам,
Свойства
Триплетность — значащей единицей кода является сочетание трёх нуклеотидов (триплет, или кодон).
Непрерывность — между триплетами нет знаков препинания, то есть информация считывается непрерывно.
Неперекрываемость — один и тот же нуклеотид не может входить одновременно в состав двух или более триплетов (не соблюдается для некоторых перекрывающихся геноввирусов, митохондрий и бактерий, которые кодируют несколько белков, считывающихся со сдвигом рамки).
Однозначность (специфичность) — определённый кодон соответствует только одной аминокислоте (однако, кодон UGA у Euplotes crassus кодирует две аминокислоты —цистеин и селеноцистеин)[11]
Вырожденность (избыточность) — одной и той же аминокислоте может соответствовать несколько кодонов.
Универсальность — генетический код работает одинаково в организмах разного уровня сложности — от вирусов до человека (на этом основаны методы генной инженерии; есть ряд исключений, показанный в таблице раздела «Вариации стандартного генетического кода» ниже).
Помехоустойчивость — мутации замен нуклеотидов, не приводящие к смене класса кодируемой аминокислоты, называют консервативными; мутации замен нуклеотидов, приводящие к смене класса кодируемой аминокислоты, называют радикальными.
14) . Рибосомальный этап биосинтеза полипептидов. Строение рибосом и их
функционирование. Характеристика этапов биосинтеза белка.
Посттрансляционные изменения белков.
Синтез белка на рибосомах клетки Прикрепившись к рибосоме, матричная РНК продвигается вдоль нее, начиная с того конца, на котором находится инициирующий кодон. По мере движения матричной РНК вдоль рибосомы постепенно формируется молекула белка. Этот процесс получил название трансляции. Рибосома считывает кодоны матричной РНК примерно так же, как воспроизводящая магнитная головка «читает» запись на движущейся по ней магнитофонной ленте. После того как терминирующий кодон открепится от рибосомы, синтез молекулы белка прекращается, и она оказывается свободно лежащей в цитоплазме. Полирибосомы. Одна матричная РНК может осуществлять синтез белковых молекул сразу на нескольких рибосомах, поскольку к ее инициирующему кодону могут поочередно прикрепляться одна рибосома за другой. При этом на каждой рибосоме будут находиться молекулы одного и того же белка на разных стадиях синтеза. На одной цепи матричной РНК могут находиться от 3 до 10 рибосом, такие группы рибосом называют полирибосомами. Важно подчеркнуть, что матричная РНК может осуществлять синтез белка на любой рибосоме. Другими словами, рибосомы неспецифичны по отношению к конкретному белку. Образно говоря, рибосомы — это производственные предприятия, на которых проводят химические реакции. Рибосомы в большом количестве связываются с мембраной эндоплазматического ретикулума. Это обусловлено тем, что начальные отрезки синтезируемых белковых молекул несут аминокислотные последовательности, быстро связывающиеся со специфическими рецепторами на мембране ретикулума, благодаря чему эти молекулы белка проходят через мембрану эндоплазматического ретикулума и оказываются в его просвете. Участки ретикулума, на которых идет синтез и транспортировка молекул белка через мембрану, имеют зернистую поверхность. Нужно подчеркнуть, что трансляция одной цепи матричной РНК осуществляется сразу на нескольких рибосомах и образующийся белок попадает внутрь эндоплазматического ретикулума, проходя через его мембрану. Следует также отметить, что большинство синтезированных на рибосомах белков (ферментов и внутриклеточных структурных белков) попадают непосредственно в цитозоль, а не в просвет ретикулума (исключение составляют лишь железистые клетки, где белок накапливается в большом количестве секреторных гранул). Стадии синтеза белка включают три этапа: (1) активация аминокислот при взаимодействии с АТФ и образование комплекса с аденозинмонофосфатом; на каждую такую реакцию затрачивается энергия двух макроэргических фосфатных связей; (2) связывание активированных аминокислот, обладающих избытком энергии, со специфическими транспортными РНК и образование комплекса аминокислота-мРНК с одновременным высвобождением аденозинмонофосфата; (3) прикрепление антикодона транспортной РНК, несущей аминокислоту, к кодону матричной РНК на рибосоме с выстраиванием определенной аминокислотной последовательности, образующей молекулу белка. Под действием фермента пептидилтрансферазы (одного из рибосомальных белков) между соседними аминокислотами образуются пептидные связи, благодаря которым аминокислотная последовательность постепенно удлиняется. Эти реакции требуют дополнительной энергии, высвобождающейся при разрыве двух макроэргических фосфатных связей, поэтому для прикрепления каждой аминокислоты к растущей пептидной цепи в общей сложности используются четыре фосфатные связи. Таким образом, синтез белка— один из самых энергоемких внутриклеточных процессов. Суть этой реакции заключается в отщеплении иона гидроксила (ОН~) от СООН-конца первой аминокислоты и иона водорода (Н+) от NH2-конца другой аминокислоты. Отщепленные ионы гидроксила и водорода взаимодействуют с образованием воды, а химически активные участки соседних аминокислот связываются друг с другом, превращаясь в единую молекулу. Такой вид соединения аминокислот называют пептидной связью. С прикреплением каждой новой аминокислоты к растущей полипептидной цепи добавляется одна пептидная связь. Тысячи ферментов, синтез которых осуществляется изложенным способом, участвуют практически во всех остальных реакциях, протекающих в клетке. Ферменты опосредуют синтез липидов, гликогена, пуринов, пиримидинов и сотен других веществ. Благодаря этим веществам клетка способна выполнять множество своих функций.
Рибосо́ма — важнейший немембранный органоид живой клетки сферической или слегка эллипсоидной формы, диаметром от 15—20нанометров (прокариоты) до 25—30 нанометров (эукариоты), состоящий из большой и малой субъединиц. Рибосомы служат для биосинтеза белка из аминокислот по заданной матрице на основе генетической информации, предоставляемой матричной РНК, или мРНК. Этот процесс называется трансляцией.
В эукариотических клетках рибосомы располагаются на мембранах эндоплазматической сети, хотя могут быть локализованы и в неприкрепленной форме в цитоплазме. Нередко с одной молекулой мРНК ассоциировано несколько рибосом, такая структура называетсяполирибосомой (полисомой). Синтез рибосом у эукариот происходит в специальной внутриядерной структуре — ядрышке.
ППооссттттррааннсслляяццииооннннааяя ммооддииффииккаацциияя ббееллккоовв
К основным реакциям процессинга относятся:
1. Удаление с N-конца метионина или даже нескольких аминокислот специфичными
аминопептидазами.
2. Образование дисульфидных мостиков между остатками цистеина.
3. Частичный протеолиз – удаление части пептидной цепи, как в случае с инсулином
или протеолитическими ферментами ЖКТ.
4. Присоединение химической группы к аминокислотным остаткам белковой цепи:
фосфорной кислоты – например, фосфорилирование по аминокислотам Серину,
Треонину, Тирозину используется при регуляции активности ферментов или для
связывания ионов кальция,
карбоксильной группы – например, при участии витамина К происходит γ-
карбоксилирование глутамата в составе протромбина, проконвертина, фактора
Стюарта, Кристмаса, что позволяет связывать ионы кальция при инициации
свертывания крови,
метильной группы – например, метилирование аргинина и лизина в составе
гистонов используется для регуляции активности генома,
гидроксильной группы – например, образование гидроксипролина и
гидроксилизина необходимо для созревания молекул коллагена при участии
витамина С, йода – например, в тиреоглобулине присоединение йода необходимо для
образования предшественников тиреоидныхгормонов йодтиронинов,
5. Включение простетической группы:
углеводных остатков – например, гликирование требуется при синтезе
гликопротеинов.
гема – например, при синтезе гемоглобина, миоглобина, цитохромов, каталазы,
витаминных коферментов – биотина, ФАД, пиридоксальфосфата и т.п.
6. Объединение протомеров в единый олигомерный белок, например, гемоглобин,
коллаген, лактатдегидрогеназа, креатинкиназа.
