
- •Предмет и задачи биологической химии
- •Функции белков в организме. Строение белков.
- •Физико-химические свойства белков. Ионизация белков в
- •4) Физико-химические свойства белков: гидратация и растворимость
- •Осаждение белков из растворов. Виды осаждения белков (обратимое и
- •Денатурация белков: факторы, вызывающие денатурацию белков:
- •Классификация белков. Простые и сложные белки
- •Дезоксирибонуклеиновые кислоты (днк): состав, строение, свойства,
- •Биосинтез днк (репликация генов): общий принцип матричного синтеза,
- •11)Строение и функции различных типов рнк (т-рнк, р-рнк, м-рнк).
- •12) Биосинтез рнк (транскрипция): условия, необходимые для транскрипции,
- •13) Биосинтез белков: (трансляция). Биологический код и его свойства.
- •15) Регуляция биосинтеза белков на уровне транскрипции (представление об
- •16) Регуляция биосинтеза белка на этапе транскрипции по механизму
- •17) Химическая природа ферментов. Проферменты, изоферменты,
- •18) Холоферменты: определение понятия, строение. Кофакторы ферментов:
- •19) Зависимость активности ферментов от реакции среды и
- •20) Структурно-функциональная организация ферментных белков:
- •21) Регуляторные (аллостерические) центры ферментов. Аллостерические
- •22)Активаторы и ингибиторы ферментов: химическая природа, виды
- •23) Специфичность действия ферментов. Виды специфичности ферментов,
- •24) Механизм действия ферментов. Зависимость активности ферментов от
- •25) Номенклатура и классификация ферментов. Характеристика отдельных
- •26) Определение активности ферментов в диагностике заболеваний.
- •27) Витамины. Классификация и номенклатура витаминов. Роль витаминов в
- •28) Витамин b1 (тиамин, антиневритиый): химическая природа, свойства,
- •29) Витамин в2 (рибофлавин): строение, свойства, признаки гиповитаминоза,
- •30) Витамин рр (ниацин, антипеллагрический): строение, признаки
- •31) Витамин с, (аскорбиновая кислота, антицинготный): химическое строение,
- •32) Витамин в6, (пиридоксин, антидерматитный): химическая природа,
- •33) Витамин а, (ретинол, антиксерофтальмический); химическая природа, признаки гиповитаминоза, источники, потребность. Участие витамина а в
- •34) Витамин д (кальциферолы, антирахитический витамин). Химическое
- •35) Обмен веществ и энергии. Анаболизм и катаболизм. Понятие о
- •36) Характеристика катаболизма: общая схема катаболизма основных
- •37) Понятие о биологическом окислении. Фазы биологического окисления, их
- •38) Ферменты биологического окисления. Пиридинзависимые дегидрогеназы:
- •39)Флавинзависимые дегидрогеназы
- •40.) Характеристика цитохромов: химическая природа коферментов, функции,
- •41.) Структурная организация цепей транспорта электронов I и II типа.
- •Электронтранспортные цепи митохондрий эукариот
- •Ингибиторы дыхательной цепи
- •42) Полное и неполное восстановление кислорода. Образование свободно-
- •Супероксид-анион (радикал)
- •Oh (гидроксил, гидроксид - радикалы.)
- •Гипохлорит-анион
- •Радикал
- •Механизмы возникновения афк
- •43) Окислительное фосфорилирование - главный механизм синтеза атф в
- •Хемиосмотическая теория Митчела
- •44) Разобщение тканевого дыхания и окислительного фосфорилирования,
- •45) Механизмы образования со2 в процессе биологического окисления.
- •46) Окисление ацетил-КоА в цикле трикарбоновых кислот:
- •48) Физиологическая роль углеводов. Потребности и источники
- •Обмен ув
- •49) Пути использования глюкозы в организме: общая схема поступления
- •50. Роль печени в обмене углеводов: глюкостатическая функция печени.
- •51) Роль печени в обмене углеводов: механизм гликогенолиза – основного
- •52. Общая характеристика внутриклеточного окисления глюкозы: пути распада
- •Катаболизм глюкозы.
- •53. Анаэробный гликолиз: определение, этапы гликолиза, химизм
- •54) Внутриклеточный обмен углеводов: Распад гликогена в мышцах в
- •56. Глюконеогенез: определение, субстраты глюконеогенеза. Обходные
- •Глюконеогенез.Аэробное окисление глюкозы.
- •55. Аэробный распад глюкозы - основной путь катаболизма глюкозы.
- •Аэробное окисление глюкозы.
- •57. Взаимосвязь гликолиза и глюконеогенеза (цикл Кори). Роль
Предмет и задачи биологической химии
Биохимия – Наука о молекулярной сущности жизни. Она занимается: 1)Изучением химического состава живых существ; 2)исследует превращения этих химических веществ в организме; 3)связь превращений веществ с деятельностью клеток, тканей, органов и организма в целом. Главной задачей биохимии является установление связи между молекулярной структурой и биологической функцией химических компонентов живых органов. В зависимости от объекта исследования биохимию условно подразделяют на биохимию человека и животных, биохимию растений, биохимию микроорганизмов. Становление биохимии проходило постепенно, и развитие ее укладывается в следующую логическую цепочку: 1)статистическая биохимия; 2)динамическая биохимия; 3)физиологическая биохимия. Основное назначение биохимии сводится к тому, чтобы решать на молекулярном уровне общебиологические задачи.
Функции белков в организме. Строение белков.
Белок или протеин – высокомолекулярное азотосодержащее вещество органическое вещество, молекулы которых построены из аминокислот.
В природе обнаружено
![]() белков, все из них построены из двадцати
λ-аминокислот. Все аминокислоты линейно
последовательны в белках, линейная
последовательность аминокислот
закодирована в ДНК.
белков, все из них построены из двадцати
λ-аминокислот. Все аминокислоты линейно
последовательны в белках, линейная
последовательность аминокислот
закодирована в ДНК.
Функции белков: 1)каталитическая – способность белков ускорять достижение равновесия химической реакции; 2)транспортная – участие белков в переносе молекул различной степени сложности; 3)защитная – белки нейтрализуют агрессивное воздействие веществ; 4)сократительная – способность специализированных белков изменять свои линейные параметры, или длину; 5)структурная (пластическая) – формирование структуры каждой клетки и ее органеллы, формирование основ ткани и органов; 6)гормональная (регуляторная) – обеспечение регуляторных воздействий в клетках и тканях; 7)питательная – белки могут быть использованы в виде трофического источника; 8)энергетическая – белковая молекула, отработав свой ресурс, подвергается деполяризации и освободившиеся аминокислоты вовлекаются в окислительный распад; энергетическая ценность 1 гр. Белка = 4,1 кКалл.
Белки представляют собой сложные полипептиды, в которых отдельные аминокислоты связаны друг с другом пептидными связями, возникающими при взаимодействии –COOH и NH2-.
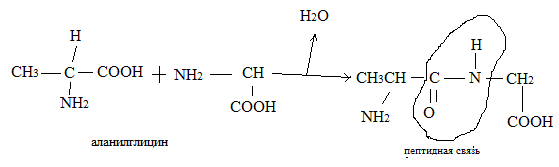
1)запись начинается с N-концевой аминокислоты, т.е. с той, которая имеет свободную аминогруппу, другой конец представлен С-концевой аминокислотой; 2)название полипептида начинается с названия N-концевой аминокислоты, далее добавляется последовательно С-концевая; конец первой меняется с «ин» на «ил».
Структурная организация белков:
1) первичная структура — последовательность аминокислот в пептидной цепочке, стабилизированная ковалентными пептидными связями, она задана генетически (инсулин, пепсин, химотрипсин);
2) вторичная структура — пространственная структура белка, когда остатки аминокислот внутри большой структуры достигают повторяюшейся зависимости одна от другой — a-спираль либо b-складчатость. Создаются водородные связи;
3) третичная структура — глобулярные и фибриллярные белки. Стабилизируются водородными связями, электростатическими силами (СОО–, NН3+), гидрофобными силами, сульфидными мостиками, определяются первичной структурой. Глобулярные белки — все ферменты, гемоглобин, миоглобин. Фибриллярные белки — коллаген, миозин, актин;
4) четвертичная структура — построена из нескольких пептидов (протомеров), каждый из которых имеет свою первичную, вторичную, третичную структуру. Несколько протомеров соединяются вместе в одну молекулу и функционируют только в совокупности (гемоглобин = a-глобула + b-глобула).
