- •1. Кислотные и основные гидроксиды. Соли
- •2. Кислотные и оснόвные оксиды
- •4. Бинарные соединения
- •1. Реакции соединения
- •2. Реакции разложения
- •3. Реакции замещения
- •4. Реакции обмена
- •1. Протолитические реакции.
- •2. Окислительно-восстановительные реакции.
- •3. Лиганднообменные реакции.
- •4. Реакции атомно-молекулярного обмена.
- •Никакие два электрона в одном атоме не могут характеризоваться одинаковым набором всех четырех квантовых чисел n, l, m, s.
- •Распределение электронов по орбиталям в водородоподобных и многоэлектронных атомах
- •Формулировка правила Клечковского
- •Исключения из правила Клечковского
Исключения из правила Клечковского
Эмпирическое правило Клечковского и вытекающее из него схема очерёдностей несколько противоречат реальной энергетической последовательности атомных орбиталей только в двух однотипных случаях: у атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au[1] имеет место “провал” электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома, а именно: после заполнения двумя электронами орбитали 6s следующий электрон появляется на орбитали 5d, а не 4f, и только затем происходит заселение четырнадцатью электронами 4f орбиталей, затем продолжается и завершается заселение десятиэлектронного состояния 5d. Аналогичная ситуация характерна и для орбиталей 7s, 6d и 5f.
Ответ 8
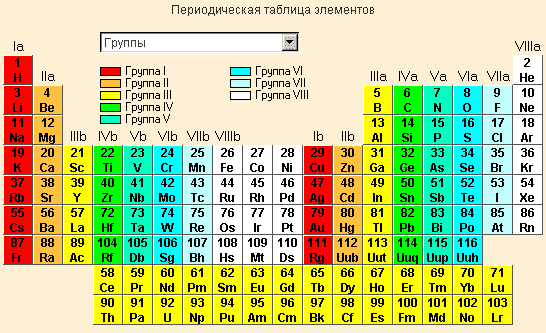
Периодическая система химических элементов
На основе Периодического закона Д.И. Менделеев создал Периодическую систему химических элементов, которая состояла из 7 периодов и 8 групп (короткопериодный вариант таблицы). В настоящее время чаще используется длиннопериодный вариант Периодической системы (7 периодов, 18 групп, отдельно показаны элементы - лантаноиды и актиноиды).
Периоды - это горизонтальные ряды таблицы, они подразделяются на малые и большие. В малых периодах находится 2 элемента (1-й период) или 8 элементов (2-й, 3-й периоды), в больших периодах - 18 элементов (4-й, 5-й периоды) или 32 элемента (6-й, 7-й период). Каждый период начинается стипичного металла, а заканчивается неметаллом (галогеном) и благородным газом.
Группы - это вертикальные последовательности элементов, они нумеруется римской цифрой от I до VIII и русскими буквами А и Б. Короткопериодный вариант Периодической системы включал подгруппы элементов (главную и побочную).
Подгруппа - это совокупность элементов, являющихся безусловными химическими аналогами; часто элементы подгруппы обладают высшей степенью окисления, отвечающей номеру группы.
В А-группах химические свойства элементов могут меняться в широком диапазоне от неметаллических к металлическим (например, в главной подгруппе V группы азот - неметалл, а висмут - металл).
В Периодической системе типичные металлы расположены в IА группе (Li-Fr), IIА (Mg-Ra) и IIIА (In, Tl). Неметаллы расположены в группах VIIА (F-Al), VIА (O-Te), VА (N-As), IVА (C, Si) и IIIА (B). Некоторые элементы А-групп (бериллий Ве, алюминий Al, германий Ge, сурьма Sb, полоний Po и другие), а также многие элементы Б-групп проявляют и металлические, и неметаллические свойства (явление амфотерности).
Для некоторых групп применяют групповые названия: IА (Li-Fr) - щелочные металлы, IIА (Ca-Ra) - щелочноземельные металлы, VIА (O-Po) -халькогены, VIIА (F-At) - галогены, VIIIА (He-Rn) - благородные газы:
|
|
|
Форма Периодической системы, которую предложил Д.И. Менделеева, называлась короткопериодной или классической. В настоящее время больше используется другая форма Периодической системы - длиннопериодная.
Периодический закон Д.И. Менделеева и Периодическая система химических элементов стали основой современной химии.
Ответ 9
Периодический закон был сформулирован Д. И. Менделеевым в следующем виде (1871): «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».[1]
С развитием атомной физики и квантовой химии Периодический закон получил строгое теоретическое обоснование. Благодаря классическим работам Й. Ридберга (1897), А. Ван-ден-Брука (1911), Г. Мозли (1913) был раскрыт физический смысл порядкового (атомного) номера элемента. Позднее была создана квантово-
механическая модель периодического изменения электронного строения атомов химических элементов по мере возрастания зарядов их ядер (Н. Бор, В. Паули, Э. Шрёдингер, В. Гейзенберг и др.).
В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов».
Особенность Периодического закона среди других фундаментальных законов заключается в том, что он не имеет выражения в виде математического уравнения. Графическим (табличным) выражением закона является разработанная Менделеевым Периодическая система элементов.
Периодический закон универсален для Вселенной: как образно заметил известный русский химик Н. Д. Зелинский, Периодический закон явился «открытием взаимной связи всех атомов в мироздании».
Ответ 10
Исследуя изменение химических свойств элементов в зависимости от величины их относительной атомной массы (атомного веса), Д. И. Менделеев в 1869 г. открыл закон периодичности этих свойств: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомных весов элементов».
Физическая основа периодического закона была установлена в 1922 г. Н. Бором. Поскольку химические свойства обусловлены строением электронных оболочек атома,периодическая система Менделеева – это естественная классификация элементов по электронным структурам их атомов. Простейшая основа такой классификации – число электронов в нейтральном атоме, которое равно заряду ядра. Но при образовании химической связи электроны могут перераспределяться между атомами, а заряд ядра остается неизменным, поэтому современная формулировка периодического закона гласит: «Свойства элементов находятся в периодической зависимости от зарядов ядер их атомов».
Это обстоятельство отражено в периодической системе в виде горизонтальных и вертикальных рядов – периодов и групп.
|
Таблица Менделеева |
Период – горизонтальный ряд, имеющий одинаковое число электронных слоев, номер периода совпадает со значением главного квантового числа n внешнего уровня (слоя); таких периодов в периодической системе семь. Второй и последующие периоды начинаются щелочным элементом (ns1) и заканчивается благородным газом (ns2np6).
По вертикали периодическая система подразделяется на восемь групп, которые делятся на главные – А, состоящие из s- и p-элементов, и побочные – B-подгруппы, содержащие d-элементы. Подгруппа III B, кроме d-элементов, содержит по 14 4f- и 5f-элементов (4f- и 5f-семейства). Главные подгруппы содержат на внешнем электронном слое одинаковое число электронов, которое равно номеру группы.
В главных подгруппах валентные электроны (электроны, способные образовывать химические связи) расположены на s- и p-орбиталях внешнего энергетического уровня, в побочных – на s-орбиталях внешнего и d-орбиталях предвнешнего слоя. Для f-элементов валентными являются (n – 2)f- (n – 1)d- и ns-электроны.
Сходство элементов внутри каждой группы – наиболее важная закономерность в периодической системе. Следует, кроме того, отметить такую закономерность, какдиагональное сходство у пар элементов Li и Mg, Be и Al, B и Si и др. Эта закономерность обусловлена тенденцией смены свойств по вертикали (в группах) и их изменением по горизонтали (в периодах).
Все сказанное выше подтверждает, что структура электронной оболочки атомов элемента изменяется периодически с ростом порядкового номера элемента. С другой стороны, свойства определяются строением электронной оболочки и, следовательно, находятся в периодической зависимости от заряда ядра атома. Далее рассматриваются некоторые периодические свойства элементов.
Связь между электронным строением элементов и их положением в периодической системе представлена в табл. 2.2.
|
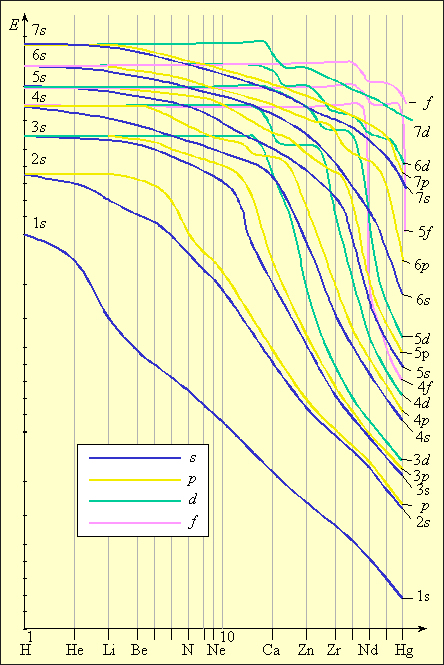
Рисунок 2.3 Зависимость энергии электрона от порядкового номера элемента |
Во втором периоде (n = 2, l = 0, 1) заполняются s- и p-орбитали от Li до Ne. Элементы называются соответсвенно s- и p-элементами.
В третьем периоде появляются пять d-орбиталей (n = 3, l = 0, 1, 2). Пока они вакантны, и третий период, как и второй, содержит восемь p-элементов элементов от Na до Ar.
Следующие за аргоном калий и кальций имеют на внешнем уровне 4s-электроны (четвертый период). Появление 4s-электронов при наличии свободных 3d-орбиталей обусловлено экранированием ядра плотным 3s23p6-электронным слоем. В связи с отталкиванием от этого слоя внешних электронов для калия и кальция реализуются [Ar]4s1- и [Ar]4s2-состояния. Сходство K и Ca с Na и Mg соответственно, кроме чисто «химического» обоснования, подтверждается также электронными спектрами.
При дальнейшем увеличении заряда у следующего за кальцием скандия 3d-состояние становится энергетически более выгодным, чем 4p, поэтому и заселяется 3d-орбиталь (рис. 2.3). Из анализа зависимости энергии электрона от порядкового номера элемента В. М. Клечковский сформулировал правило, согласно которому энергия атомных орбиталей возрастает по мере увеличения суммы (n + l). При равенстве сумм сначала заполняется уровень с меньшим n и большим l, а потом с большим n и меньшим l. Так у K и Ca заполняется 4s-орбиталь (4 + 0 = 4), а потом у Sc заполняется 3d-орбиталь (3 + 2 = 5).
Приведенные рассуждения подтверждаются экспериментальными данными об изменении энергии s-, p-, d-и f-орбиталей в зависимости от порядкового номера элемента. Как следует из рис. 1.3, значения энергии различных состояний зависит от заряда ядра Z, и чем больше Z, тем меньше различаются эти состояния по энергиям. Характер этого различия таков, что кривые, выражающие изменение энергии, пересекаются. Так для элементов K и Ca (Z = 19 и 20) энергия 3d-орбиталей выше, чем 4p, а для элементов с Z ≥ 21 энергия 3d-орбиталей ниже, чем 4p. Начиная со скандия (Z = 21) заполняется 3d-орбиталь, а во внешнем слое остаются4s-электроны. Поэтому в четвертом периоде в ряду от Sc до Zn все десять 3d-элементов – металлы с низшей степенью окисления, как правило, 2, за счет внешних 4s-электронов. Общая электронная формула этих элементов – 3d1–104s1–2. Для хрома и меди наблюдается проскок (или провал) электрона на d-уровень: Cr –3d54s1, Cu – 3d104s1. Такой проскок с ns- на (n – 1)d-уровень наблюдается также у Mo, Ag, Au, Pt и у других элементов и объясняется близостью энергий ns- и (n – 1)d-уровней и стабильностью наполовину и полностью заполненных уровней.
Образование катионов d-элементов связано с потерей прежде всего внеших ns- и только затем (n – 1)d-электронов. Например:
|
|
|
|
|
|
Дальше в четвертом периоде после десяти d-элементов появляются p-элементы от Ga (4s24p1) до Kr (4s24p6).
Пятый период повторяет четвертый – в нем также 18 элементов, и 4d-элементы, как и 3d образуют вставную декаду (4d1–105s0–2).
В шестом периоде после лантана (5d16s2) – аналога скандия и иттрия следуют 14 4f-элементов – лантаноидов. Свойства этих элементов очень близки, поскольку идет заполнение глубоколежащего (n – 2)f-подуровня. Общая формула лантаноидов 4f 2–145d 0–16s 2.
Ионы 4f-элементов образуются следующим образом:
|
|
|
|
|
|
После 4f-элементов заполняются 5d- и 6p-орбитали.
Седьмой период отчасти повторяет шестой. 5f-элементы называются актиноидами. Их общая формула 5f2–146d0–17s2. Далее следуют еще 6 искусственно полученных 6d-элементов незавершенного седьмого периода.

 кристаллический
иод (галоген, VIIА-группа)
кристаллический
иод (галоген, VIIА-группа) IA-группа,
щелочной металл цезий
IA-группа,
щелочной металл цезий VIА-группа
- халькогены: природная сера
VIА-группа
- халькогены: природная сера