
- •1. Кислотные и основные гидроксиды. Соли
- •2. Кислотные и оснόвные оксиды
- •4. Бинарные соединения
- •1. Реакции соединения
- •2. Реакции разложения
- •3. Реакции замещения
- •4. Реакции обмена
- •1. Протолитические реакции.
- •2. Окислительно-восстановительные реакции.
- •3. Лиганднообменные реакции.
- •4. Реакции атомно-молекулярного обмена.
- •Никакие два электрона в одном атоме не могут характеризоваться одинаковым набором всех четырех квантовых чисел n, l, m, s.
- •Распределение электронов по орбиталям в водородоподобных и многоэлектронных атомах
- •Формулировка правила Клечковского
- •Исключения из правила Клечковского
|
Ответ 1 |
Атомы и химические элементы
Атом - это наименьшая химическая частица вещества. При разрушении атом распадается на более мелкие ("элементарные") физические частицы, из которых он построен. Число этих частиц у разных атомов различное. Физические частицы - это электрон e−, протон p+ и нейтрон n0.
Атом электронейтрален; его ядро включает некоторое число протонов и нейтронов и заряжено положительно, а на периферии атома (в электронной оболочке) находятся электроны, общее число которых равно числу протонов в ядре.
Определенный вид атомов называется химическим элементом.
Каждый элемент имеет свое название и символ. Названия и символы всех химических элементов приведены в Периодической системе.
Химические элементы могут проявлять металлические и неметаллические свойства. В Периодической системе 22 элемента считаются неметаллами(это He, Ne, Ar, Kr, Xe, Rn, F, Cl, Br, I, At, O, S, Se, Te, N, P, As, C, Si, B, H), а остальные элементы - металлами.
Все атомы каждого элемента имеют одно и то же число протонов в ядре и число электронов в оболочке.
Относительная атомная масса
Атомы элементов характеризуются определённой (только им присущей) массой. Например, масса атома Н равна 1,67 . 10−23 г, атома С − 1,995 . 10−23 г, атома О − 2,66 . 10−23 г. Пользоваться такими малыми значениями неудобно, поэтому введено понятие об относительной атомной массе Аr − отношении массы атома данного элемента к атомной единице массы (1,6605 . 10−24 г).
Молекулы. Молекулярные формулы. Ковалентные и ионные вещества
М олекула -
наименьшая частица вещества, сохраняющая
химические свойства этого вещества.
Все молекулы построены из атомов и
поэтому также электронейтральны.
олекула -
наименьшая частица вещества, сохраняющая
химические свойства этого вещества.
Все молекулы построены из атомов и
поэтому также электронейтральны.
Состав молекулы передаётся молекулярной формулой, которая отражает и качественный состав вещества (символы химических элементов, входящих в его молекулу), и его количественный состав (нижние числовые индексы, отвечающие числу атомов каждого элемента в молекуле).
Так, формула молекулы воды записывается H2O (2 атома водорода, 1 атом кислорода), молекула хлора Cl2 (2 атома хлора), молекула углекислого газа - CO2 (1 атом углерода, 2 атома кислорода).
Примеры чтения молекулярных формул: N2 - эн-два, NH3 - эн-аш-три, H2O - аш-два-о, H2SO4 - аш-два-эс-о-четыре.
Вещества, состоящие из реальных молекул, называются ковалентными веществами - например, вода H2O, аммиак NH3, азот N2, серная кислота H2SO4, этанол C2H5OH, сахароза C12H22O11.
Большинство неорганических веществ - ионные, они состоят из электронейтральных сочетаний положительных ионов (катионов) и отрицательных ионов (анионов) и не содержат молекул. Их состав передается также молекулярными формулами (условные молекулы), причем сами ионы могут быть одно- и многоэлементными. Так, фторид кальция CaF2 - сочетание одного катиона Ca2+ и двух анионов F−, а сульфат натрия Na2SO4 - сочетание двух катионов Na+ и одного аниона SO42−.
Иногда условные и реальные молекулы в целом, независимо от их ковалентного или ионного строения, называют формульными единицами веществ.
Некоторые вещества в газообразном и жидком состояниях могут образовывать ассоциаты молекул - реальные частицы вещества в конкретных физических условиях. Например, оксид фосфора(V) P2O5 может существовать в виде димера P4O10, оксид азота(IV) NO2 - в виде N2O4. Формулы P2O5 и NO2 называются молекулярными, а P4O10 и N2O4 - истинными.
Ответ 2
Относительная атомная масса. Относительная молекулярная масса
Второй важной характеристикой атома после заряда является его масса. Она называется абсолютной атомной массой – ma.
Масса атома углерода, например, равна 1,99 · 10-26 кг. Однако, выражать значения масс атомов с помощью грамм или килограмм неудобно, т.к. получаются очень малые значения, а ими тяжело пользоваться. Поэтому для вычисления атомных масс за единицу массы принимают 1/12 массы атома углерода-12. Эта единица измерения массы атома называется углеродной единицей (у.е.) или атомной единицей массы (а.е.м.):
1 а.е.м. = 1,667 · 10-27 кг = 1,667 · 10-24 г
Эта величина является основой для химических и физических расчетов.
Таким образом, относительная атомная масса – это масса атома, отнесенная к 1/12 массы атома изотопа углерода 12. Обозначается Ar (индекс «r» - начальная буква английского слова relative – относительный). Найти значение относительной атомной массы можно в таблице Менделеева рядом с каждым химическим элементом. Оно показывает во сколько раз масса данного элемента больше 1/12 массы изотопа углерода-12. Например, относительная атомная масса цинка равна 65. Это означает, что атом цинка в 65 раз тяжелее 1/12 массы атома углерода.
Между абсолютной и относительной атомными массами существует зависимость:
Ar = ma / 1а.е.м.
Следовательно, для данного химического элемента абсолютная атомная масса рассчитывается так:
Например, ma (водорода Н) = Ar(Н) * 1а.е.м. = 1 * 1,667· 10-24 = 1,667 · 10-24 г
ma (О) = Ar(О) * 1а.е.м. = 16 * 1,667· 10-24 = 26 · 10-24 г = 2,6 · 10-23 г
Для характеристики молекул можно пользоваться понятиями абсолютной mМ и относительной молекулярной массы Мr соответственно. Относительная молекулярная масса - это масса молекулы, соотнесенная к 1 а.е.м.:
Мr = mМ / 1а.е.м.
Абсолютная молекулярная масса – это масса молекулы, которая складывается из относительных атомных масс каждого из атомов, присутствующих в этой молекуле. Рассмотрим на примере, рассчитывая по формуле:
mМ (Н2О) = количество атомов (Н)*1а.е.м*Ar (Н) + количество атомов (О)*1а.е.м*Ar (О);
mМ (Н2О) = 2*1,667·10-24*1 + 1*1,667·10-24*16 = (3,334+26)*10-24 ≈ 29,334·10-24 г
Мr (Н2О) = 29,334·10-24 / 1,667·10-24 = 17,6 ≈ 18 г
Намного проще посчитать, посмотрев в периодической системе Д.И. Менделеева относительные атомные массы каждого из атомов этой молекулы и сложить их, учитывая, конечно же, количество атомов. Например, в молекуле воды Н2О 2 атома водорода, значит, мы должны значение относительной атомной массы 1 атома водорода умножить на 2 (ведь таких атомов 2 в молекуле):
Мr (Н2О) = 2*Ar(Н) + 1*Ar(О) = 2*1+16 = 18 г
Мr (Н2SО4) = 2*Ar(Н) + Ar(S) + 4*Ar(О) = 2*1+32+4*16 = 2+32+64 = 98 г
Ответ 3
В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль.
Моль это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное постоянной Авогадро
![]()
Постоянная Авогадро NA определяется как число атомов, содержащееся в 12 г изотопа 12С:
![]()
Таким образом, 1 моль вещества содержит 6,02 • 1023 частиц этого вещества.
Исходя из этого, любое количество вещества можно выразить определенным числом молей ν (ню). Например, в образце вещества содержится 12,04 • 1023 молекул. Следовательно, количество вещества в этом образце составляет:
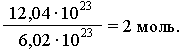
В
общем виде: ![]()
где N – число частиц данного вещества; NA – число частиц, которое содержит 1 моль вещества (постоянная Авогадро).
Молярная масса вещества (M) – масса, которую имеет 1 моль данного вещества. Эта величина, равная отношению массы m вещества к количеству вещества ν, имеет размерность кг/моль или г/моль. Молярная масса, выраженная в г/моль, численно равна относительной относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar). Например, молярная масса метана CH4 определяется следующим образом:
Мr(CH4) = Ar(C) + 4 Ar(H) = 12+4 =16
M(CH4)=16 г/моль, т.е. 16 г CH4 содержат 6,02 • 1023 молекул.
Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) ν, по формуле:
![]()
Соответственно, зная массу и молярную массу вещества, можно рассчитать число его молей:
![]()
или найти массу вещества по числу молей и молярной массе:
m = ν • M
Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т.е. зависит от Mr и Ar. Поэтому разные вещества при одинаковом количестве молей имеют различные массы m.
Пример Вычислить массы метана CH4 и этана С2H6, взятых в количестве ν = 2 моль каждого.
Решение Молярная масса метана M(CH4) равна 16 г/моль; молярная масса этана M(С2Н6) = 2 • 12+6=30 г/моль. Отсюда:
m(CH4) = 2 моль • 16 г/моль = 32 г; m(С2Н6) = 2 моль • 30 г/моль = 60 г.
Таким образом, моль – это порция вещества, содержащая одно и то же число частиц, но имеющая разную массу для разных веществ, т.к. частицы вещества (атомы и молекулы) не одинаковы по массе.
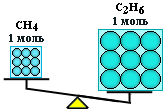 (CH4)
= (С2Н6),
но m(CH4) <
m(С2Н6)
(CH4)
= (С2Н6),
но m(CH4) <
m(С2Н6)
Вычисление ν используется практически в каждой расчетной задаче.
Ответ 4
Общие сведения
Классификация неорганических веществ и их номенклатура основаны на наиболее простой и постоянной во времени характеристике химическом составе, который показывает атомы элементов, образующих данное вещество, в их числовом отношении. Если вещество из атомов одного химического элемента, т.е. является формой существования этого элемента в свободном виде, то его называют простым веществом; если же вещество из атомов двух или большего числа элементов, то его называют сложным веществом. Все простые вещества (кроме одноатомных) и все сложные вещества принято называть химическими соединениями, так как в них атомы одного или разных элементов соединены между собой химическими связями.
Номенклатура неорганических веществ состоит из формул и названий. Химическая формула изображение состава вещества с помощью символов химических элементов, числовых индексов и некоторых других знаков. Химическое название изображение состава вещества с помощью слова или группы слов. Построение химических формул и названий определяется системой номенклатурных правил.
Символы и наименования химических элементов приведены в Периодической системе элементов Д.И. Менделеева. Элементы условно делят на металлыи неметаллы. К неметаллам относят все элементы VIIIА-группы (благородные газы) и VIIА-группы (галогены), элементы VIА-группы (кроме полония), элементы азот, фосфор, мышьяк (VА-группа); углерод, кремний (IVА-группа); бор (IIIА-группа), а также водород. Остальные элементы относят к металлам.
При составлении названий веществ обычно применяют русские наименования элементов, например, дикислород, дифторид ксенона, селенат калия. По традиции для некоторых элементов в производные термины вводят корни их латинских наименований:
Ag аргент |
N нитр |
As арс, арсен |
Ni никкол |
Au аур |
O окс, оксиген |
C карб, карбон |
Pb плюмб |
Cu купр |
S сульф |
Fe ферр |
Sb стиб |
H гидр, гидроген |
Si сил, силик, силиц |
Hg меркур |
Sn станн |
Mn манган |
|
Например: карбонат, манганат, оксид, сульфид, силикат.
Названия простых веществ состоят из одного слова наименования химического элемента с числовой приставкой, например:
Mg (моно)магний |
O3 трикислород |
Hg (моно)ртуть |
P4 тетрафосфор |
O2 дикислород |
S8 октасера |
Используются следующие числовые приставки:
1 моно |
7 гепта |
2 ди |
8 окта |
3 три |
9 нона |
4 тетра |
10 дека |
5 пента |
11 ундека |
6 гекса |
12 додека |
Неопределенное число указывается числовой приставкой n поли.
Для некоторых простых веществ используют также специальные названия, такие, как О3 озон, Р4 белый фосфор.
Химические формулы сложных веществ составляют из обозначения электроположительной (условных и реальных катионов) иэлектроотрицательной (условных и реальных анионов) составляющих, например, CuSO4 (здесь Cu2+ реальный катион, SO42 реальный анион) иPCl3 (здесь P+III условный катион, ClI условный анион).
Названия сложных веществ составляют по химическим формулам справа налево. Они складываются из двух слов названий электроотрицательных составляющих (в именительном падеже) и электроположительных составляющих (в родительном падеже), например:
CuSO4 сульфат меди(II) PCl3 трихлорид фосфора LaCl3 хлорид лантана(III) СО монооксид углерода
Число электроположительных и электроотрицательных составляющих в названиях указывают числовыми приставками, приведенными выше (универсальный способ), либо степенями окисления (если они могут быть определены по формуле) с помощью римских цифр в круглых скобках (знак плюс опускается). В ряде случаев приводят заряд ионов (для сложных по составу катионов и анионов), используя арабские цифры с соответствующим знаком.
Для распространенных многоэлементных катионов и анионов применяют следующие специальные названия:
H2F+ фтороний |
C22 ацетиленид |
H3O+ оксоний |
CN цианид |
H3S+ сульфоний |
CNO фульминат |
NH4+ аммоний |
HF2 гидродифторид |
N2H5+ гидразиний(1+) |
HO2 гидропероксид |
N2H6+ гидразиний(2+) |
HS гидросульфид |
NH3OH+ гидроксиламиний |
N3 азид |
NO+ нитрозил |
NCS тиоционат |
NO2+ нитроил |
O22 пероксид |
O2+ диоксигенил |
O2 надпероксид |
PH4+ фосфоний |
O3 озонид |
VO2+ ванадил |
OCN цианат |
UO2+ уранил |
OH гидроксид |
Для небольшого числа хорошо известных веществ также используют специальные названия:
AsH3 арсин |
HN3 азидоводород |
B2H6 боран |
H2S сероводород |
B4H10 тетраборан(10) |
NH3 аммиак |
HCN циановодород |
N2H4 гидразин |
HCl хлороводород |
NH2OH гидроксиламин |
HF фтороводород |
PH3 фосфин |
HI иодоводород |
SiH4 силан |
1. Кислотные и основные гидроксиды. Соли
Гидроксиды тип сложных веществ, в состав которых входят атомы некоторого элемента Е (кроме фтора и кислорода) и гидроксогруппы ОН; общая формула гидроксидов Е(ОН)n, где n = 1÷6. Форма гидроксидов Е(ОН)n называется орто-формой; при n > 2 гидроксид может находиться также вмета-форме, включающей кроме атомов Е и групп ОН еще атомы кислорода О, например Е(ОН)3 и ЕО(ОН), Е(ОН)4 и Е(ОН)6 и ЕО2(ОН)2.
Гидроксиды делят на две противоположные по химическим свойствам группы: кислотные и основные гидроксиды.
Кислотные гидроксиды содержат атомы водорода, которые могут замещаться на атомы металла при соблюдении правила стехиометрической валентности. Большинство кислотных гидроксидов находится в мета-форме, причем атомы водорода в формулах кислотных гидроксидов ставят на первое место, например H2SO4, HNO3 и H2CO3, а не SO2(OH)2, NO2(OH) и CO(OH)2. Общая формула кислотных гидроксидов НхЕОу, где электроотрицательную составляющую ЕОух называют кислотным остатком. Если не все атомы водорода замещены на металл, то они остаются в составе кислотного остатка.
Названия распространенных кислотных гидроксидов состоят из двух слов: собственного названия с окончанием “ая” и группового слова “кислота”. Приведем формулы и собственные названия распространенных кислотных гидроксидов и их кислотных остатков (прочерк означает, что гидроксид не известен в свободном виде или в кислом водном растворе):
кислотный гидроксид |
кислотный остаток |
HAsO2 метамышьяковистая |
AsO2 метаарсенит |
H3AsO3 ортомышьяковистая |
AsO33 ортоарсенит |
H3AsO4 мышьяковая |
AsO43 арсенат |
|
В4О72 тетраборат |
|
ВiО3 висмутат |
HBrO бромноватистая |
BrO гипобромит |
HBrO3 бромноватая |
BrO3 бромат |
H2CO3 угольная |
CO32 карбонат |
HClO хлорноватистая |
ClO гипохлорит |
HClO2 хлористая |
ClO2 хлорит |
HClO3 хлорноватая |
ClO3 хлорат |
HClO4 хлорная |
ClO4 перхлорат |
H2CrO4 хромовая |
CrO42 хромат |
|
НCrO4 гидрохромат |
H2Cr2О7 дихромовая |
Cr2O72 дихромат |
|
FeO42 феррат |
HIO3 иодноватая |
IO3 иодат |
HIO4 метаиодная |
IO4 метапериодат |
H5IO6 ортоиодная |
IO65 ортопериодат |
HMnO4 марганцовая |
MnO4 перманганат |
|
MnO42 манганат |
|
MоO42 молибдат |
HNO2 азотистая |
NO2 нитрит |
HNO3 азотная |
NO3 нитрат |
HPO3 метафосфорная |
PO3 метафосфат |
H3PO4 ортофосфорная |
PO43 ортофосфат |
|
НPO42 гидроортофосфат |
|
Н2PO4 дигидроотофосфат |
H4P2O7 дифосфорная |
P2O74 дифосфат |
|
ReO4 перренат |
|
SO32 сульфит |
|
HSO3 гидросульфит |
H2SO4 серная |
SO42 сульфат |
|
НSO4 гидросульфат |
H2S2O7 дисерная |
S2O72 дисульфат |
H2S2O6(O2) пероксодисерная |
S2O6(O2)2 пероксодисульфат |
H2SO3S тиосерная |
SO3S2 тиосульфат |
H2SeO3 селенистая |
SeO32 селенит |
H2SeO4 селеновая |
SeO42 селенат |
H2SiO3 метакремниевая |
SiO32 метасиликат |
H4SiO4 ортокремниевая |
SiO44 ортосиликат |
H2TeO3 теллуристая |
TeO32 теллурит |
H2TeO4 метателлуровая |
TeO42 метателлурат |
H6TeO6 ортотеллуровая |
TeO66 ортотеллурат |
|
VO3 метаванадат |
|
VO43 ортованадат |
|
WO43 вольфрамат |
Менее распространенные кислотные гидроксиды называют по номенклатурным правилам для комплексных соединений, например:
IO42 тетраоксоиодат (2 ) |
SO22 диоксосульфат(IV) |
MoO32 триоксомолибдат(IV) |
TeO52 пентаоксотеллурат(IV) |
PoO32 триоксополонат(IV) |
XeO64 гексаоксоксенонат(VIII) |
Названия кислотных остатков используют при построении названий солей.
Основные гидроксиды содержат гидроксид-ионы, которые могут замещаться на кислотные остатки при соблюдении правила стехиометрической валентности. Все основные гидроксиды находятся в орто-форме; их общая формула М(ОН)n, где n = 1,2 (реже 3,4) и М n + катион металла. Примеры формул и названий основных гидроксидов:
NaOH гидроксид натрия |
Ba(OH)2 гидроксид бария |
KOH гидроксид калия |
La(OH)3 гидроксид лантана(III) |
Важнейшим химическим свойством основных и кислотных гидроксидов является их взаимодействие их между собой с образованием солей (реакция солеобразования), например:
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
Ca(OH)2 + 2H2SO4 = Ca(HSO4)2 + 2H2O
2Ca(OH)2 + H2SO4 = Ca2SO4(OH)2 + 2H2O
Соли тип сложных веществ, в состав которых входят катионы Мn+ и кислотные остатки*.
Соли с общей формулой Мх(ЕОу) n называют средними солями, а соли с незамещенными атомами водорода, кислыми солями. Иногда соли содержат в своем составе также гидроксид или(и) оксид ионы; такие соли называют основными солями. Приведем примеры и названия солей:
Ca3(PO4)2 |
ортофосфат кальция |
Ca(H2PO4)2 |
дигидроортофосфат кальция |
CaHPO4 |
гидроортофосфат кальция |
CuCO3 |
карбонат меди(II) |
Cu2CO3(OH)2 |
дигидроксид-карбонат димеди |
La(NO3)3 |
нитрат лантана(III) |
Ti(NO3)2O |
оксид-динитрат титана |
Кислые и основные соли могут быть превращены в средние соли взаимодействием с соответствующим основным и кислотным гидроксидом, например:
Ca(HSO4)2 + Ca(OH) = CaSO4 + 2H2O
Ca2SO4(OH)2 + H2SO4 = 2CaSO4 + 2H2O
Встречаются также соли, содерхащие два разных катиона: их часто называют двойными солями, например:
KAl(SO4)2 |
сульфат алюминия-калия |
CaMg(CO3)2 |
карбонат магния-кальция |
