
- •Оптичні методи аналізу
- •1.1. Фотометричний метод аналізу 1.1.1. Основні закони і формули
- •1.2. Емісійний спектральний аналіз і полум'яна емісійна спектроскопія 1.2.1. Емісійний спектральний аналіз. Основні закони і формули
- •1.2.2. Полум'яна емісійна спектроскопія. Основні закони і формули
- •1.2.3. Розв’язання типових задач з теми «Емісійний спектральний аналіз і полум'яна емісійна спектроскопія»
- •1.2.4. Контрольні питання по темі «Емісійний спектральний аналіз і полум'яна емісійна спектроскопія»
- •1.3. Атомно-абсорбційний аналіз 1.3.1. Основні закони і формули
- •5. Люмінесцентний аналіз 1.5.1. Основні закони і формули
- •2.1.3.Контрольні питання по темі «Потенціометричний аналіз»
- •2.2. Кондуктометричний метод аналізу 2.2.1. Основні закони і формули
- •2.2.2. Рішення типових задач з теми «Кондуктометричний аналіз»
- •2.2.3. Контрольні питання по темі «Кондуктометричний аналіз»
- •2.3. Кулонометричний метод аналізу
- •2.3.1. Основні закони і формули
- •2.3.2. Рішення типових задач по темі "Кулонометричний аналіз"
- •2.3.3. Контрольні питання з теми «Кулонометричний аналіз»
- •2.4. Вольтамперометричний метод аналізу
- •2.4.1. Основні закони и формули
5. Люмінесцентний аналіз 1.5.1. Основні закони і формули
Люмінесценція - світіння речовини після поглинання ним енергії збудження: М* М + h v
Переходячи в більш низький енергетичний стан, порушені частинки випускають квант світла - люмінесціюють. Від випромінювання нагрітих тіл люмінесценція відрізняється нерівноважністю, так як практично не включає теплову енергію. Це надмірне над тепловим випромінювання часто називають холодним світлом. З різних типів люмінесценції найбільше значення для аналітичної хімії має флуоресценція - світіння, затухаючі відразу після припинення порушення. Якісний люмінесцентний аналіз заснований на виникненні або зникнення люмінесцентного випромінювання, тобто використовує сам факт люмінесценції досліджуваного речовини. Кількісний люмінесцентний аналіз заснований на використанні співвідношення, що зв'язує інтенсивність флуоресценції Iл з концентрацією флуоресціюючої речовини з: Iл = k c
У практиці кількісного люмінесцентного аналізу звичайно застосовують метод градуювального графіка. В даний час розроблені методи кількісного люмінесцентного визначення майже всіх елементів періодичної системи при їх вмісті в середньому 0,5 ... 5,0 мкг (при відносній похибки 5 ... 10%). Для вимірювання інтенсивності флуоресценції використовують прилади, що мають наступні основні вузли: джерело порушення, світлофільтри, клітинку з аналізованих речовиною, приймач випромінювання і вимірювальне обладнання. Зазвичай люмінесценцію збуджують опроміненням об'єкта короткохвильовими променями видимого або УФ діапазону спектру. В якості джерел збудження використовують лампи розжарювання або газорозрядні лампи. Останнім часом для цієї мети застосовують лазери. З газорозрядних ламп в люмінесцентному аналізі зазвичай використовують ртутні лампи, що дають лінійчатий спектр. Для вимірювання люмінесценції служать прилади двох типів: флуориметра і спектрофлуориметри. Вони можуть використовуватися, зокрема, для визначення якості харчових продуктів методом люмінесцентного аналізу в лабораторіях санітарної експертизи, СЕС, торгових і переробних підприємствах.
1.5.2.
Рішення типових задач з теми «Люмінесцентний
аналіз»
Завдання.
При аналізі проби масою 0,9816 г на вміст
кобальту хемілюмінесцентний фотографічним
м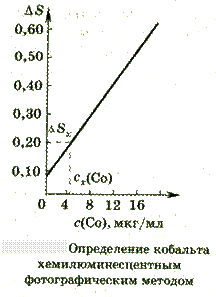 етодом
на одну фотопластинку знімали світіння
проби аналізованого розчину, стандартів
і холостого досвіду. У комірки кювети
поміщали по 0,5 мл розчину солі кобальту,
додавали саліцилат натрію (для усунення
дії, що заважає катіонів міді і заліза)
та однакову кількість перекису водню.
Потім кювету витримували до повного
припинення світіння; платівку
фотометрирували на мікрофотометр МФ-2.
Значення ΔS
стандартних розчинів, що містять 4,0;
8,0; 12,0; 16,0 мкг / мл кобальту, склали 0,17;
0,28; 0,40; 0,53 відповідно. Обчисліть масову
частку (%) кобальту в пробі, якщо ΔSх
= 0,20.
етодом
на одну фотопластинку знімали світіння
проби аналізованого розчину, стандартів
і холостого досвіду. У комірки кювети
поміщали по 0,5 мл розчину солі кобальту,
додавали саліцилат натрію (для усунення
дії, що заважає катіонів міді і заліза)
та однакову кількість перекису водню.
Потім кювету витримували до повного
припинення світіння; платівку
фотометрирували на мікрофотометр МФ-2.
Значення ΔS
стандартних розчинів, що містять 4,0;
8,0; 12,0; 16,0 мкг / мл кобальту, склали 0,17;
0,28; 0,40; 0,53 відповідно. Обчисліть масову
частку (%) кобальту в пробі, якщо ΔSх
= 0,20.
Розв’язок. У хемілюмінесцентному фотографічному методі використовується залежність ΔS - різниці почорніння плям в їх центрах і фону холостої проби від концентрації визначуваного елементу. При дотриманні ряду умов ця залежність близька до лінійної. Будуємо градуйований графік в координатах ΔS-с і за графіком визначаємо концентрацію кобальту, рівну 5,0 мкг / мл. Масовую частку (%) кобальту в пробі знаходимо за формулою: ωСо=(mCo•10-6•100)/m=(5,0•0,5•10-6•100)/0,9816=2,55•10-4%. де mCo - маса кобальту, мкг; m - наважка проби, г. Відповідь: Масова частка кобальту в пробі дорівнює 2,55•10-4%. 1.5.3. Контрольні питання по темі «Люмінесцентний аналіз» 1. Що називають люмінесцентним випромінюванням і яка його природа? 2. Сформулюйте основні закономірності люмінесценції. 3. Які види люмінесценції розрізняють залежно від способу збудження? 4. Що таке флуоресценція? 5. Що таке квантовий вихід в люмінесценції і як він впливає на чутливість аналізу? 6. Наведіть принципову схему приладу для вимірювання інтенсивності флуоресценції. З чим пов'язана необхідність використання двох світлофільтрів і де їхнє місце у схемі? 7. Чому для вимірювання флуоресценції використовують тільки розбавлені розчини концентрацією 10-3... 10-4моль / л і менше? 8. Як пов'язана інтенсивність флуоресценції з концентрацією? Які прийоми флуоресцентного аналізу засновані на використанні цієї залежності? 9. Назвіть фактори, що впливають на інтенсивність люмінесценції. 10. Наведіть приклади якісних визначень методом люмінесценції в техніці, сільському господарстві, медицині і т.д. 11. Назвіть основні вузли приладів для люмінесцентного аналізу. Наведіть принципову схему. 12. Вкажіть переваги і недоліки люмінесцентного аналізу.
Прослухати
Наприклад: введіть "privet" і натисніть пробіл, щоб отримати "привет".
Наприклад: введіть "privet" і натисніть пробіл, щоб отримати "привет".
|
2. Електрохімічні методи аналізу Електрохімічні методи аналізу і дослідження засновані на вивченні і використанні процесів, що протікають на поверхні електрода або вприелектродному просторі. Будь-який електричний параметр (потенціал, сила струму, опір та ін), функціонально зв'язаний з концентрацією аналізованого розчину і піддається правильному вимірюванню, може служити аналітичним сигналом. Розрізняють прямі і непрямі електрохімічні методи. У прямих методах використовують залежність сили струму (потенціалу і т.д.) від концентрації визначуваного компонента. У непрямих методах силу струму (потенціал і т. д.) вимірюють з метою знаходження кінцевої точки титрування, який визначає необхідний компонент титранту, тобто використовують залежність вимірюваного параметра від обсягу титранту. Для будь-якого роду електрохімічних вимірювань необхідна електрохімічна ланцюг або електрохімічна комірка, складовою частиною якої є аналізований розчин. 2.1. Потенціометричний метод аналізу 2.1.1. Основні закони і формули Потенціометричні методи засновані на вимірі різниці потенціалів індикаторного електрода і електрода порівняння або, точніше, електрорушійних сил (ЕРС) різних ланцюгів, оскільки експериментально вимірюється саме ЕРС, яка є різницею потенціалів. Рівноважний потенціал індикаторного електрода пов'язаний з активністю та концентрацією речовин, що беруть участь в електродному процесі, рівнянням Нернста: Е = Е° + R T/(n F) ln (аокис/авідн.)
Е = Е° + R T /(n F) ln (окис. үокис. /(відн. үвідн)),
R - універсальна газова постійна, рівна 8,31 Дж / (моль. К), Т - абсолютна температура; F-постійна Фарадея (96500 Кл / моль); n - число електронів, які беруть участь у електродної реакції; аокис і авідн.- активності відповідно окисленої і відновленої форм редокс-системи; - їх молярні концентрації; үокис. і үвідн – коефіцієнти активності; Е ° - стандартний потенціал редокс-системи. Підставляючи Т = 298,15 К і числові значення констант в рівняння, отримуємо: Е = Е° + (0,059 / n) lg (аокис/авідн.)
Е = Е° + (0,059 / n) lg (окис. үокис./відн. үвідн.))
Методи прямої потенціометрії засновані на застосуванні рівняння Нернста для знаходження активності або концентрації учасника електродної реакції по експериментально виміряної ЕРС ланцюга або потенціалу електрода. Найбільшого поширення серед прямих потенціометричних методів отримав метод визначення рН, але створення останнім часом надійно працюючих іоноселективних електродів значно розширило практичні можливості прямих методів. Показник рН визначають і методом потенціометричного титрування. Для визначення рН найчастіше використовують скляний електрод. Основними достоїнствами скляного електрода є простота роботи, швидке встановлення рівноваги та можливість визначення рН в окисно-відновних системах. До недоліків відносяться крихкість матеріалу електрода і складність роботи при переході до сільнолужних і сильнокислих розчинів. Крім концентрації іонів водню, прямим потенціометричним методом з іоноселективних електродів можна визначити зміст кількох десятків різних іонів. Потенціометричне титрування засноване на визначенні точки еквівалентності за результатами потенціометричних вимірювань. Поблизу точки еквівалетності відбувається різка зміна (стрибок) потенціалу індикаторного електрода. Так само, як і в інших титриметричних методах, реакції потенціометричного титрування повинні протікати суворо стехіометрично, мати високу швидкість і йти до кінця. Для потенціометричного титрування збирають ланцюг з індикаторного електрода в аналізованому розчині і електрода порівняння. В якості електродів порівняння найчастіше використовують каломельний або хлорсеребряного електроди. Тип застосовуваного індикаторного електрода при потенциометрическом титруванні залежить від властивостей титриметричний суміші та її взаємодії з електродом.В кислотно-основному титруванні використовують скляний електрод, в окислювально-відновному - інертний (платиновий) електрод або електрод, оборотний по відношенню до одного з іонів, що містяться в тітріметріметріческой суміші; в осадительному - срібний електрод; в комплексонометричний - металевий електрод, оборотний до титруемой іону металу. Для знаходження точки еквівалентності часто будують диференціальну криву в координатах Е/V – V .На точку еквівалентності вказує максимум отриманої кривої, а відлік по осі абсцис, відповідає цьому максимуму, дає обсяг титранту, витраченого на титрування до точки еквівалентності. Визначення точки еквівалентності до диференціальної кривої значно точніше, ніж з простої залежності Е - V. Основними перевагами методу потенціометричного титрування є висока точність і можливість проводити визначення в розведених розчинах, в мутних і забарвлених середовищах, а також визначати кілька речовин в одному розчині без попереднього розділення. Значно розширюється область практичного застосування потенціометричного титрування при використанні неводних розчинників. Вони дозволяють аналізувати багатокомпонентні системи, які у водному розчині визначити не вдається, провести аналіз речовин, нерозчинних або розкладаються у воді, і т. д. Потенціометричне титрування легко може бути автоматизоване. Промисловість випускає кілька типів автотитрантів, що використовують потенціометричні датчики. До недоліків потенціометричного титрування можна віднести не завжди швидке встановлення потенціалу після додавання титранту і необхідність у багатьох випадках проводити при титруванні велика кількість відліків. У потенціометричному аналізі основними вимірювальними приладами є потенціометри різних типів. Вони призначені для вимірювання ЕРС електродної системи. Так як ЕРС залежить від активності відповідних іонів у розчині, багато потенціометри дозволяють безпосередньо вимірювати також величину рХ - від'ємний логарифм активності іона Х. Такі потенціометри в комплекті з відповідним іоноселективних електродів носять названіеіономеров. Якщо потенціометр і електродна система призначені для вимірювання активності тільки водневих іонів, прилад називається рН-метром.
2.1.2. Рішення типових задач з теми «Потенциометрический аналіз» Завдання. Обчисліть електродний потенціал мідного електрода, опущеного в розчин солі міді з концентрацією Сu2+ дорівнює 0,1 моль/л; Е°Cu2+/ Cu° = 0,34 В.
Розв’язок: E = 0,34 + (0,058 / 2) lg 10-1 = 0,311 В
Відповідь: 0,311 В.
Завдання. Розрахуйте концентрацію NH4VO3 в аналізованому розчині, якщо при потенціометричному титруванні 20,0 мл розчину NH4VO3 0,1 моль-екв / л розчином FeSO4 були отримані наступні дані: V (мл) 10,0 13,0 13,5 14,0 14,5 15,0 15,5 16,0 E (мв) 730 700 680 650 550 500 480 470 Розв’язок: Точка еквівалентності, знайдена за графіком відповідає 14,35 мл розчину FeSO4 витраченого на титрування аналізованого розчину NH4VO3 С (NH4VO3 ) = 14,35 (0,1 / 20,0) = 0,0717 моль-екв / л Відповідь: 0,0717 моль-екв / л.
Прослухати
2.1.2 . Rishennya typovykh zadach z temy « Potentsyometrycheskyy̆ analiz » Zavdannya . Obchyslitʹ elektrodnyy̆ potentsial midnoho elektroda , opushchenoho v rozchyn soli midi z kontsentratsiyeyu Su2 + dorivnyuye 0,1 molʹ / l ; E ° Cu2 + / Cu ° = 0,34 V. Rishennya : E = 0,34 + ( 0,058 / 2 ) lg 10-1 = 0,311 U Vidpovidʹ : 0,311 V. Zavdannya . Rozrakhuy̆te kontsentratsiyu NH4VO3 v analizovanomu rozchyni , yakshcho pry potentsyometrycheskom tytruvanni 20,0 ml rozchynu NH4VO3 0,1 molʹ - ekv / l rozchynom FeSO4 buly otrymani nastupni dani : V ( ml ) 10,0 13,0 13,5 14,0 14,5 15,0 15,5 16,0 E ( mv ) 730 700 680 650 550 500 480 470 Rishennya : Tochka ekvivalentnosti , znay̆dena za hrafikom vidpovidaye 14,35 ml rozchynu FeSO4 , vytrachenoho na tytruvannya analizovanoho rastvoraNH4VO3 . S ( NH4VO3 ) = 14,35 ( 0,1 / 20,0 ) = 0,0717 molʹ - ekv / l Vidpovidʹ : 0,0717 molʹ - ekv / l .
Словник
Прослухати
2. Elektrokhimichni metody analizu Elektrokhimichni metody analizu i doslidzhennya zasnovani na vyvchenni i vykorystanni protsesiv, shcho protikayutʹ na poverkhni elektroda abo vprielektrodnom prostori. Budʹ-yakyy̆ elektrychnyy̆ parametr (potentsial, syla strumu, opir ta in), funktsionalʹno zv'yazanyy̆ z kontsentratsiyeyu analizovanoho rozchynu i piddayetʹsya pravylʹnomu vymiryuvannyu, mozhe sluzhyty analitychnym syhnalom. Rozriznyayutʹ pryami i nepryami elektrokhimichni metody. U pryamykh metodakh vykorystovuyutʹ zalezhnistʹ syly strumu (potentsialu i t.d.) vid kontsentratsiï vyznachuvanoho komponenta. U nepryamykh metodakh sylu strumu (potentsial i t. d.) vymiryuyutʹ z metoyu znakhodzhennya kintsevoï tochky tytruvannya vyznachayetʹsya komponentapodkhodyashchim tytrantu, tobto vykorystovuyutʹ zalezhnistʹ vymiryuvanoho parametra vid obsyahu tytrantu. Dlya budʹ-yakoho rodu elektrokhimichnykh vymiryuvanʹ neobkhidna elektrokhimichna lantsyuh abo elektrokhimichna komirka, skladovoyu chastynoyu yakoï ye analizovanyy̆ rozchyn. 2.1. Potentsyometrycheskyy̆ metod analizu 2.1.1. Osnovni zakony i formuly Potentsiometrychni metody zasnovani na vymiri riznytsi potentsialiv indykatornoho elektroda i elektroda porivnyannya abo, tochnishe, elektrorushiy̆nykh syl (ERS) riznykh lantsyuhiv, oskilʹky eksperymentalʹno vymiryuyetʹsya same ERS, yaka ye riznytseyu potentsialiv. Rivnovazhnyy̆ potentsial indykatornoho elektroda pov'yazanyy̆ z aktyvnistyu ta kontsentratsiyeyu rechovyn, shcho berutʹ uchastʹ v elektrodnomu protsesi, rivnyannyam Nernsta: E = E ° + RT / (n F) ln (aokis / avosst) vosst үokisl / ( okysly E = E ° + RT / (n F) ln ( үvosst)), R - universalʹna hazova postiy̆na, rivna 8,31 Dzh / (molʹ. K), T - absolyutna temperatura; F-postiy̆na Faradeya (96500 Kl / molʹ); n - chyslo elektroniv, yaki berutʹ uchastʹ u elektrodnoï reaktsiï; aokis, avosst - okysly aktyvnosti vidpovidno okyslenoï i vidnovlenoï form redoks-systemy; - ïkh molyarni kontsentratsiï; үokis, үvosst - koefitsiyenty vosst i aktyvnosti; E ° - standartnyy̆ potentsial redoks-systemy. Pidstavlyayuchy T = 298,15 K i chyslovi znachennya konstant v rivnyannya, otrymuyemo: E = E ° + (0,059 / n) lg (aokis / avosst) E = E ° + үvosst)) vosst үokisl / okysly (0,059 / n) lg ( Metody pryamoï potentsiometriï zasnovani na zastosuvanni rivnyannya Nernsta dlya znakhodzhennya aktyvnosti abo kontsentratsiï uchasnyka elektrodnoï reaktsiï po eksperymentalʹno vymiryanoï ERS lantsyuha abo potentsialu elektroda. Nay̆bilʹshoho poshyrennya sered pryamykh potentsiometrychnykh metodiv otrymav metod opredeleniyarN, ale stvorennya ostannim chasom nadiy̆no pratsyuyuchykh ionoselektyvnykh elektrodiv znachno rozshyrylo praktychni mozhlyvosti pryamykh metodiv. Pokaznyk rNizmeryayut i metodom potentsiometrychnoho tytruvannya. Dlya vyznachennya rN nay̆chastishe vykorystovuyutʹ sklyanyy̆ elektrod. Osnovnymy dostoïnstvamy sklyanoho elektroda ye prostota roboty, shvydke vstanovlennya rivnovahy ta mozhlyvistʹ vyznachennya rN v okysno-vidnovnykh systemakh. Do nedolikiv vidnosyatʹsya krykhkistʹ materialu elektroda i skladnistʹ roboty pry perekhodi do silʹnoshchelochnykh i sylʹnokyslomu rozchyniv. Krim kontsentratsiï ioniv vodnyu, pryamym potentsiometrychnym metodom z ionoselektyvnykh elektrodiv mozhna vyznachyty zmist kilʹkokh desyatkiv riznykh ioniv. Potentsiometrychne tytruvannya zasnovane na vyznachenni tochky ekvivalentnosti za rezulʹtatamy potentsiometrychnykh vymiryuvanʹ. Poblyzu tochkiekvivaletnosti vidbuvayetʹsya rizka zmina (strybok) potentsialu indykatornoho elektroda. Tak samo, yak i v inshykh tytrymetrycheskym metodakh, reaktsiï potentsiometrychnoho tytruvannya povynni protikaty suvoro stekhiometrychni, maty vysoku shvydkistʹ i y̆ty do kintsya. Dlya potentsiometrychnoho tytruvannya zbyrayutʹ lantsyuh z indykatornoho elektroda v analizovanomu rozchyni i elektroda porivnyannya. V yakosti elektrodiv porivnyannya nay̆chastishe vykorystovuyutʹ kalomelʹnyy̆ abo khlorserebryanoho elektrody. Typ zastosovuvanoho indykatornoho elektroda pry potentsyometrycheskom tytruvanni zalezhytʹ vid vlastyvostey̆ tytrymetrychnyy̆ sumishi ta ïï vzayemodiï z elektrodom.V kyslotno-osnovnomu tytruvanni vykorystovuyutʹ sklyanyy̆ elektrod, v okyslyuvalʹno-vidnovnomu - inertnyy̆ (platynovyy̆) elektrod abo elektrod, oborotnyy̆ po vidnoshennyu do odnoho z ioniv, shcho mistyatʹsya v titrimetrimetricheskoy̆ sumishi; v osadytelʹnomu - sribnyy̆ elektrod; v kompleksonometrychnyy̆ - metalevyy̆ elektrod, oborotnyy̆ do tytruemoy̆ ionu metalu. Dlya znakhodzhennya tochky ekvivalentnosti chasto V - V. Na tochku E / buduyutʹ dyferentsialʹnu kryvu v koordynatakh ekvivalentnosti vkazuye maksymum otrymanoï kryvoï, a vidlik po osi abstsys, vidpovidaye tsʹomu maksymumu, daye obsyah tytrantu, vytrachenoho na tytruvannya do tochky ekvivalentnosti. Vyznachennya tochky ekvivalentnosti do dyferentsialʹnoï kryvoï znachno tochnishe, nizh z prostoï zalezhnosti E - V. Osnovnymy perevahamy metodu potentsiometrychnoho tytruvannya ye vysoka tochnistʹ i mozhlyvistʹ provodyty vyznachennya v rozvedenykh rozchynakh, v mutnykh i zabarvlenykh seredovyshchakh, a takozh vyznachaty kilʹka rechovyn v odnomu rozchyni bez poperednʹoho rozdilennya. Znachno rozshyryuyetʹsya oblastʹ praktychnoho zastosuvannya potentsiometrychnoho tytruvannya pry vykorystanni nevodnykh rozchynnykiv. Vony dozvolyayutʹ analizuvaty bahatokomponentni systemy, yaki u vodnomu rozchyni vyznachyty ne vdayetʹsya, provesty analiz rechovyn, nerozchynnykh abo rozkladayutʹsya u vodi, i t. d. Potentsiometrychne tytruvannya lehko mozhe buty avtomatyzovane. Promyslovistʹ vypuskaye kilʹka typiv avtotitratorov, shcho vykorystovuyutʹ potentsiometrychni datchyky. Do nedolikiv potentsiometrychnoho tytruvannya mozhna vidnesty ne zavzhdy shvydke vstanovlennya potentsialu pislya dodavannya tytrantu i neobkhidnistʹ u bahatʹokh vypadkakh provodyty pry tytruvanni velyka kilʹkistʹ vidlikiv. U potentsyometrycheskom analizi osnovnymy vymiryuvalʹnymy pryladamy ye potentsiometry riznykh typiv. Vony pryznacheni dlya vymiryuvannya ERS elektrodnoï systemy. Tak yak ERS zalezhytʹ vid aktyvnosti vidpovidnykh ioniv u rozchyni, bahato potentsiometry dozvolyayutʹ bezposerednʹo vymiryuvaty takozh velychynu RKH - vid'yemnyy̆ loharyfm aktyvnosti iona KH. Taki potentsiometry v komplekti z vidpovidnym ionoselektyvnykh elektrodiv nosyatʹ nazvanieionomerov. Yakshcho potentsiometr i elektrodna systema pryznacheni dlya vymiryuvannya aktyvnosti tilʹky vodnevykh ioniv, prylad nazyvayetʹsya rN-metrom.
Словник
Прослухати
.5. Lyuminestsentnyy̆ analiz 1.5.1. Osnovni zakony i formuly Lyuminestsentsiya - svichennya rechovyny pislya pohlynannya nym enerhiï zbudzhennya: M + h vM * Perekhodyachy v bilʹsh nyzʹke enerhetychnyy̆ stan, porusheni chastynky vypuskayutʹ kvant svitla - lyumynestsyruyut. Vid vyprominyuvannya nahritykh til lyuminestsentsiya vidriznyayetʹsya neravnovesnostʹyu, tak yak praktychno ne vklyuchaye teplovu enerhiyu. Tse nadmirne nad teplovym vyprominyuvannya chasto nazyvayutʹ kholodnym svitlom. Z riznykh typiv lyuminestsentsiï nay̆bilʹshe znachennya dlya analitychnoï khimiï maye fluorestsentsiya - svitinnya, zatukhayuchi vidrazu pislya prypynennya porushennya. Yakisnyy̆ lyuminestsentnyy̆ analiz zasnovanyy̆ na vynyknenni abo znyknennya lyuminestsentnoho vyprominyuvannya, tobto vykorystovuye sam fakt lyuminestsentsiï doslidzhuvanoho rechovyny. Kilʹkisnyy̆ lyuminestsentnyy̆ analiz zasnovanyy̆ na vykorystanni spivvidnoshennya, shcho zv'yazuye intensyvnistʹ fluorestsentsiï il z kontsentratsiyeyu fluorestsiyuyuchoï rechovyny z: Il = k c U praktytsi kilʹkisnoho lyuminestsentnoho analizu zvychay̆no zastosovuyutʹ metod hraduyuvalʹnoho hrafika. V danyy̆ chas rozrobleni metody kilʹkisnoho lyuminestsentnoho vyznachennya may̆zhe vsikh elementiv periodychnoï systemy pry ïkh vmisti v serednʹomu 0,5 ... 5,0 mk·h (pry vidnosniy̆ pokhybky 5 ... 10%). Dlya vymiryuvannya intensyvnosti fluorestsentsiï vykorystovuyutʹ prylady, shcho mayutʹ nastupni osnovni vuzly: dzherelo porushennya, svitlofilʹtry, klitynku z analizovanykh rechovynoyu, pryy̆mach vyprominyuvannya i vymiryuvalʹne obladnannya. Zazvychay̆ lyuminestsentsiyu zbudzhuyutʹ oprominennyam ob'yekta korotkokhvylʹovymy promenyamy vydymoho abo UF diapazonu spektru. V yakosti dzherel zbudzhennya vykorystovuyutʹ lampy rozzharyuvannya abo hazorozryadni lampy. Ostannim chasom dlya tsiyeï mety zastosovuyutʹ lazery. Z hazorozryadnykh lamp v lyuminestsentnomu analizi zazvychay̆ vykorystovuyutʹ rtutni lampy, shcho dayutʹ liniy̆chatyy̆ spektr. Dlya vymiryuvannya lyuminestsentsiï sluzhatʹ prylady dvokh typiv: fluorymetra i spektrofluorimetry. Vony mozhutʹ vykorystovuvatysya, zokrema, dlya vyznachennya yakosti kharchovykh produktiv metodom lyuminestsentnoho analizu v laboratoriyakh sanitarnoï ekspertyzy, SES, torhovykh i pererobnykh pidpryyemstvakh.
Словник
Прослухати
1.4.2 . Rishennya typovykh zadach z temy « nefelometrychni i turbidimetrychnykh analiz » Zavdannya . Iz navazhky Pb ( C2H3O2 ) 2 • 3N2O masoyu 0,3260 h pryhotuvaly 100,0 ml rozchynu . U mirni kolby mistkistyu 50,0 ml vmistyly po V ( ml ) otrymanoho rozchynu , dodaly do nykh stabilizuyuchyy̆ koloïd i sirchanu kyslotu dlya utvorennya PbSO4 , dovely do mitky dystylʹovanoyu vodoyu i vymiryaly uyavnu optychnu shchilʹnistʹ: V , ml 2,00 4,00 6,00 8,00 10,00 Akazhu 0,65 0,40 0,32 0,27 0,22 Probu ob'yemom 50,0 ml analizovanoï vody rozbavyly do 200,0 ml i 10,00 ml otrymanoho rozchynu obrobyly tak samo , yak i standartni rozchyny . Vyznachte kontsentratsiyu ( h / l ) svyntsyu u vodi , yakshcho zdayetʹsya optychna shchilʹnistʹ sklala 0,53 . Rishennya : Rozrakhovuyemo kontsentratsiï standartnykh rozchyniv pislya rozbavlennya i buduyemo hraduyuvalʹnyy̆ hrafik v koordynatakh akazhu -s . Za hrafikom znakhodymo kontsentratsiyu svyntsyu z ( Pb ) = 1,00 • 10-4 h / ml . Rozrakhovuyemo masu svyntsyu v 1 l analizovanoï vody : s ( Pb ) = ( 1,00 • 10-4 • 200,0 • 50,0 • 1000 ) / ( 10,00 • 50,0 ) = 2,00 h / l Vidpovidʹ : Kontsentratsiya svyntsyu u vodi dorivnyuye 2,00 h / l .
Словник
Прослухати
1.4. Nefelometrychni i turbidimetrychnykh analiz 1.4.1. Osnovni zakony i formuly U nefelometrychni i turbidimetrychnykh analizi vykorystovuyetʹsya yavyshche rozsiyuvannya svitla tverdymy chastynkamy, shcho znakhodyatʹsya v rozchyni v pidvishenomu stani. Probu vysvitlyuyutʹ potokom svitla z intensyvnistyu I0, a potim, tak samo yak v molekulyarniy̆ absorbtsiy̆noï spektroskopiï, vymiryuyutʹ intensyvnistʹ mynuloho vyprominyuvannya It abo vyznachayutʹ intensyvnistʹ vyprominyuvannya, rozsiyanoho pid pevnym kutom (napryklad, I90 pry 90o). Z rostom chysla chastok suspenziï stavlennya It/I0 zmenshuyetʹsya, a vidnosyny vydu I90/I0uvelichivayut·sya, u vsyakomu razi, do pomirnykh kontsentratsiy̆. Dlya duzhe rozbavlenykh suspenziy̆ vymir pid kutom nabahato chutlyvishi, nizh vymiryuvannya, koly dzherelo i pryy̆mach vyprominyuvannya znakhodyatʹsya na odniy̆ liniï, oskilʹky pry tsʹomu mozhna sposterihaty slabkyy̆ rozsiyane svitlo na temnomu tli. Metod, v yakomu vykorystovuyutʹ intensyvnistʹ mynuloho svitla It, nazyvayutʹ Mutnomir, a metod z vymiryuvannyam pid kutom 90o (abo yakym-nebudʹ inshym) - nefelometriya. Pry turbidimetrychnykh vymirakh velychyna, yaka nazyvayetʹsya mutnistyu, vidpovidaye optychnoï shchilʹnosti i mozhe buty vyznachena zi spivvidnoshennya, analohichnoho osnovnomu zakonu svetopohlosheniya: S = lg (I0 / I) = k b N, de S - kalamutnistʹ; k - koefitsiyent proportsiy̆nosti, zvanyy̆ koefitsiyentom kalamutnosti; b - dovzhyna shlyakhu, N - chyslo rozsiyuyuchykh chastynok v odynytsi ob'yemu. Dlya turbidimetrychnykh vymiriv mozhna vykorystovuvaty budʹ-yakyy̆ fotometr abo spektrofotometr. Yakshcho rozchynnyk i rozsiyuyutʹ chastky bezbarvni, maksymalʹna chutlyvistʹ dosyahayetʹsya pry vykorystanni vyprominyuvannya blakytnyy̆ abo blyzhniy̆ ulʹtrafioletoviy̆ oblasti. Dlya zabarvlenykh system optymalʹnu dovzhynu khvyli neobkhidno pidbyraty eksperymentalʹno. Vykorystovuvane v nefelometriï rozrakhunkove spivvidnoshennya nastupne: c I0,I = K - empirychna konstantade K - kut, pid yakym provodyatʹ vymiryuvannya); s -systemy ( kontsentratsiya. Konstruktsiï pryladiv dlya nefelometrychni i lyuminestsentnykh vymiryuvanʹ identychni, tomu budʹ-yakyy̆ fluorymetr mozhna vykorystovuvaty v yakosti nefelometr. Oskilʹky dovzhyna khvyli pry rozsiyuvanni ne zminyuyetʹsya, neobkhidnistʹ u druhomu monokhromator abo svitlofilʹtri vidpadaye, ale yakshcho vony ye v pryladi, to ïkh slid nalashtuvaty na dovzhynu khvyli padayuchoho svitla. Bahato seriy̆ni fluorymetra zabezpecheni spetsialʹnymy prystosuvannyamy dlya nefelometrychni vymiryuvanʹ. Zastosuvannya metodiv, zasnovanykh na vymiri rozsiyuvannya svitla, dosytʹ obmezhena, persh za vse tomu, shcho na vymiryuvanyy̆ syhnal sylʹno vplyvaye rozmir chastok. Tomu neobkhidno suvore dotrymannya identychnosti umov pobudovy hraduyuvalʹnoho hrafika ta analizu doslidzhuvanoho rozchynu. Mozhna skazaty, shcho i nefelometriya, i Mutnomir mozhutʹ buty korysnymy dlya selektyvnykh analitychnykh reaktsiy̆, v rezulʹtati yakykh utvoryuyetʹsya tverde z'yednannya. Opysano metodyky vyznachennya amiaku y̆odydom rtuti (reaktyv Nesslera), fosfatu u vyhlyadi malorozchynnoï z'yednannya z molibdenom i strykhninom, sulʹfatu bariyu z mezhamy vyyavlennya desyatomu-soti chastky mikrohrama v mililitri ta in Bilʹsh tsikavo zastosuvannya metodiv, zasnovanykh na rozsiyuvanni svitla, dlya vyznachennya serednʹoï molekulyarnoï masy polimeriv v rozchynakh. Shche odyn napryamok praktychnoho vykorystannya takykh metodiv - tse zastosuvannya lazeriv dlya dystantsiy̆noho vyznachennya chastok, shcho mistyatʹsya v povitryanomu prostori.
Словник
Прослухати
1.3.3. Kontrolʹni pytannya po temi «Atomno-absorbtsiy̆nyy̆ analiz» 1. Na chomu zasnovanyy̆ atomno-absorbtsiy̆nyy̆ analiz: a) na reyestratsiï pohlynannya svitla atomamy rechovyny; b) na reyestratsiï svitu, pohlynenoho molekulamy rechovyny; v) na reyestratsiï svitla, shcho vypuskayetʹsya zbudzhenymy molekulamy? 2. Yaki sposoby atomizatsiï vykorystovuyutʹsya v atomno-absorbtsiy̆nomu analizi? 3. Yaki horyuchi sumishi vykorystovuyutʹsya dlya otrymannya polum'ya v atomno-absorbtsiy̆noï analizi? 4. Z yakykh osnovnykh vuzliv skladayetʹsya atomno-absorbtsiy̆nyy̆ spektrofotometr? 5. Yaki dzherela vyprominyuvannya vykorystovuyutʹ v atomno-absorbtsiy̆nomu spektrofotometri? Yakym vymoham povynen zadovolʹnyaty dzherelo vyprominyuvannya? 6. Yaki metody vyznachennya kontsentratsiï rechovyn u rozchyni vykorystovuyutʹ v atomno-absorbtsiy̆nomu analizi? 7. Nazvitʹ oblasti zastosuvannya atomno-absorbtsiy̆noho analizu. 8. Chomu metod atomno-absorbtsiy̆noï spektroskopiï praktychno ne vykorystovuyutʹ dlya vyznachennya luzhnykh metaliv? 9. Chy mozhna metodom atomno-absorbtsiy̆noï spektroskopiï vyznachyty odnochasno 2-3 elementa v ïkh sumishi? Shcho dlya tsʹoho neobkhidno? 10. Naveditʹ pryntsypovu skhemu atomno-absorbtsiy̆noho spektrofotometra.
Словник
Прослухати
Читати фонетично
Словник
