
СИ*
I.
^ _ ? ч
соон
N
с
ода
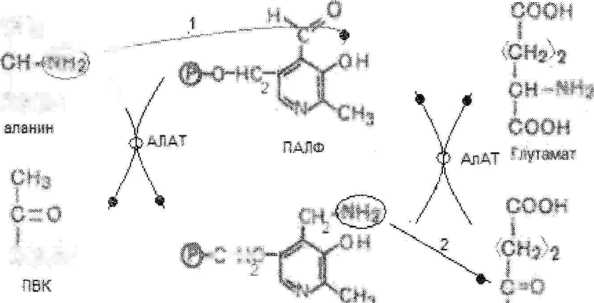
Тридоксо эу инфосфят паиф
после потери аминогруппы образуется временный комплекс а.к.- ПАЛФ—«-конформационное изменение-^образуется ПАМФ и ПВК.
образование нового промежуточного комплекса КК+ПАМФ,
Реакция катализирующая фермент АСАТ.
АТ имеет 2-а ыентра связывания: ® для а.к.
для и-КГ
мэосг-си* • сн-соон ПАЛФ \ м мвоо~а% ••^:мг»си-оооь
авшртат
АсАТ
Л-
Г
АсАТ
fc*rfl»M9T
Чп.




/
>
-С
■•‘CQOH
щук
-СЬ»'
*CHj
-с
с &0Й
I
«•Kirerjayrapat
ПАМФ


Акцепторами аминогрупп,отщепляющих от а-а.к. могут быть кетокислоты:
пируват
ЩУК
а-КГ
Осповным(главным)акцептором а-аминогрупп является а-КГ’,который выполняет коллекторную функцию в реакциях переаминирования. При этом он превращается в глутамат,который в последующем выделяет аминогруппу в виде конечного продукта NH3,TeM самым поддерживает азотистый баланс.
Схема коллекторной функции а-КГ:
\AjiAT
/ oL -КГ
II 17
..oAj1 Н / \ * HtyKJ Ьп V; 28
I I 29
NH2
Биологическая роль переаминирования:
в ходе реакции не происходит образование свободн.МНЗ(токсичный продукт)
вввысвобождается безазотистый остаток а.к.,который является реакционноспособным ,и быстро включается в процесс метаболизма.
в ходе реакции синтезируется заменимая а.к.
ааамфиболическая роль —> реакция катаболизма а.к. с др^-синтезируются новые
а.к.
в ходе реакции происходит перераспределение аминного азота-^в результате кол- во а.к. не меняется.
Клиникодиагностическое значение определения активности АлАТ и АсАТ.
Оба фермента -органоспецифичные: АлАТ - в большом кол-ве - в печени,а АсАТ-в сердечной мышце. В норме их активность не высока.При заболевании печени :| Ал АТ,а при инфарктмиокарда-АсАТ
Коэффициент Де Ритиса = 1337+\Д42
ЛГ1г\ I
Разъяснение:
«В сыворотке крови здоровых людей активность этих трансаминаз в тысячи раз ниже, чем в паренхиматозных органах. Поэтому органические поражения при острых и хронических заболеваниях, сопровождающиеся деструкцией клеток, приводят к выходу трансаминаз из очага поражения в кровь. Так, уже через 3-5 ч после развития инфаркта миокарда уровень АсАТ в сыворотке крови резко повышается (в 20-30 раз). Максимум активности обеих трансаминаз крови приходится на конец первых суток, а уже через 2-3 дня при благоприятном исходе болезни уровень сывороточных трансаминаз возвращается к норме. Напротив, при затяжном процессе или наступлении повторного инфаркта миокарда наблюдается новый пик повышения активности этих ферментов в крови. Этим объясняется тот факт, что в клинике трансаминазный тест используется не только для постановки диагноза, но и для прогноза и проверки эффективности лечения . При поражениях клеток печени, например при гепатитах, также наблюдается гипертрансаминаземия (за счет преимущественного повышения уровня АлАТ), но она имеет более умеренный и затяжной характер, а повышение активности трансаминазы в сыворотке крови происходит медленно. При различного рода коронарной недостаточности (стенокардия, пороки сердца и др., кроме инфаркта миокарда) гипертрансаминаземия или не наблюдается, или незначительна. Определение активности трансаминаз в сыворотке крови при заболеваниях сердца следует отнести к дифференциально-диагностическим лабораторным тестам. Повышение уровня трансаминаз в сыворотке крови отмечено, кроме того, при некоторых заболеваниях мышц, в частности при обширных травмах, гангрене конечностей и прогрессивной мышечной дистрофии.»
ТРАНСДЕЗАМИНИРОВАНИЕ.
Трансдезаминирование-это сочетание 2-х процессов:
это переаминирование в ходе которого а-аминогруппа от а.к. перебрасывается на а-КГ с образованием глутамата.Эту стадию катализирует фермент АТ с кофактором ПАЛФ.
окислительное дезаминирование глутамата с образованием свободной NH3 и а- КГ.катачизирует ГДГ с кофактором НАД+
«оос-сн.-.-л-с
*0* ИИ • НАДФВ’и'
ТДгПАЛФ) (J) ГДГ
Я
НЩ+
§Ш
■О S3
«■€»шшшт oi 'щщш
Биологическая роль:
Большинство а.к. которые прямым путём могут выд-ть а-аминогруппу в виде NH3 выделяют её нейтральным путём,используя коллекторную функцию а- КГ—^поддерживается азотистый баланс.
В качестве акцептора аминогруппы в реакциях трансдезаминирования могут выступать и другие кетокислоты, но конечным акцептором всегда является -а-КГ.
ОБМЕН АММИАКА.
Источники NH3 в клетке:
трдасдезамшмровдамя АК
Обезвреживание биогенных адамов
д&зашшроваж*е fipwyx т
Л
/
овет«теп.«ное
гаиеше
a.i.
а
кмаечше
ПЗЮ
Аммиак это высокотоксичное соединение,которое в норме содержится в крови в очень небольших кол-ах 0,4-0,7 мг\л или 25-40 ммоль\л
Причины токсичности:
аммиак связывает а-КГ в клетках головного мозга—>в результате концентрация <х- КГ в клетке { —^торможение работы ЦТК. Итопнарушается регенерация ЩУК-^накапливается ацетил-коА—>кетоз—^нарушение Е-ого обмена.
| концентрации а-КГ за счёт связывания его NH3 —> нарушения процесса катаболизма а.к.,т.к нарушаются процессы переаминирования и трансдезаминирования.
NH3 связывается с глугоматом—>глутамия.В больших концентрациях ето в-во Т осмотическое давление в клетке и вызывает отёк клеток головного мозга.
I концентрации глутамата в клетке —>мало ГАМК(гаммааминомаслянная кислота)—>■ преобладают процессы возбуждения—>-судороги.
большое число аммиака в виде NH4+,oh в клетку не проходит,а свободный аммиак легко проходит ч\з мембрану и в цитозоле образуют N114+,который накапливается возле мембраны—^нарушается трансмембранный перенос натрия и калия.
большая [NH3] в крови —^явление алколоза-^|сродства гемоглобина с кислородом и кислород в ткани не идёт—^гипоксия.
Клинически отравления аммиаком проявляется в виде тремора, нечленораздельной речи.
затуманивания сознания, кома, судороги, смерть.
Пути обезвреживания Аммиака:
емггез «чевшы е лечен»
X.
ч
образование
амидов
{глуташна
т
асгтрапша)
««тез
аланина
ч


синтез
вурйновах в пирншдян-овых азотистых
оснований
Местные(временное связывание NH3)
восстановительное аминирование а-КГ
образование амидов » синтез аланина
Общие (конечное обезвреживание NH3)
синтез мочевины
аммоногенез
СУДЬБА УГЛЕРОДНОГО СКЕЛЕТА
Безазотистые остатки а.к,- углеродные скелеты являются амфиболическими метаболитами: используются для процессов катаболизма,а также могут участвовать в процессах анаболизма.
те а.к. углеродный скелет которых превращается в ацетил-коА и используется для синтеза липидов-кетогенные а.к.(1а.к.-лейцин).
те а.к. углеродный скелет которых представлен ПВКДЦУК -идёт на синтез глюкозы(ГНГ)-гликогенные их 13 (гли,ала,сер)
те а.к. углеродный скелет которых используется для синтеза глюкозы и липидов- смешанные их 5(изолейцин,лизин,фенилаланин,тирозин,триптофан).
углеродные скелеты могут выполнять анаплеротическую функцию(в процессе катаболизма а.к. превращаются в метаболиты ЦТК и участвуют в работе пути: аспарагин и аспартат -ЩУК
ФА и тирозин-ацетил коА метионин,треонин-сукцинилко А глутамин и глутамат -а-КГ’
углеродные скелеты а.к. используются для синтеза заменимых а.к.:р-ии переаминирования и восстановительного аминирования а-КГ.
ДЕКАРБОКСИЛИРОВАНИЕ(ПРЕВРАЩЕНИЕ ПО а-КАРБОКСИЛЬНОЙ ГРУППЕ)
Декарбоксилирование - это ферментативная реакция ,в ходе которой а-карбоксильная группа отщепляется с образованием С-02 и биогенных аминов.
Эти реакции катализируют ферменты -декарбоксилазы(4 класс-лиаз) Это холофермент
,кофакгор которого является производное вит. В6-ПАЛФ
Биогенные амины,образовавшиеся в реакциях,являются БАВ,функции которых:
нейромедиаторов
гормонов
регуляторов местного действия Образование ГАМК:
CGOH
I
СН2
тутамзтдекарйоксилаза | ’' -{-
СН2 * J> СН2
ПАЯФ
CHNH2 ^С«|Ш2
СООН ГАМК
глутамат
функция:-нейромедиатор,тормозящий процессы возбуждения в ЦНС.
Катаболизм ГАМК:
Инактивирование осуществляется путём периаминирования—^образуется янтарная кислота,подключается к ЦТК.
ГАМК используется как лечебный продукт -гамолон-при нарушении мозгового кровообращения,депрессияхдравмах головного мозга.
ОН?—СН
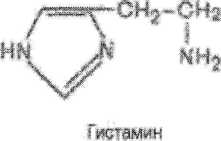




4 JL
гмсщрнДК
V
т м нщ
гщж
Образуется в тучных клетках соединительной ткани,при аллергии,травмах. Действие:
® местное сосудорасширяющее действие,формирует основные признаки воспаления(гиперемия,воспаление,отёчность), э повышается проницаемость сосудистой стенки для воды « вызывают спазм глаткой мускулатуры дыхательных путей(бронхоспазм).
понижают АД но повышают внутри черепное давление.
® стимулируют желчную секркцию. в нейромедиатор.
Образование Дофамина:
II 17
..oAj1 Н / \ * HtyKJ Ьп V; 28
I I 29
Н4-в»штер(Ве) \
Н2-мгегггер«н
Биологическая
роль:
-«Гормон
счастья»-вызывает чувство удовольствия,
-улучшает интеллект, память.
02 Н20
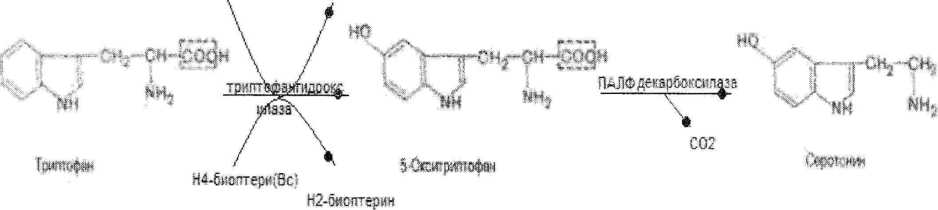
-«цветные сны»
-при участии совместно с гистамином—»восполительная реакция.
температуру тела,АД.
-медиатор аллергических рекакций.
Обезвреживание биогенных аминов:
Амины должны действовать быстро и кратковременно.Существует 2 пути:
Окислительное дезаминирование биогенных аминов при использовании при использовании ферментов : -моноаминоксидаза-ФАД-зависимый фермент
saranasB
~
вгн,ш,
, * V «202 -H20-U
&CH2-NH2
\
/ ч.
БД
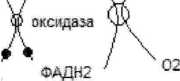
NH3 Н20
-О /Н К /
RCOOH -* R-C=0
кислота альдегид
реакция трансметилирования
>СЙ2-СНг
I
I
мтт
тъ-ц
НМ
Ж
\
Ж
\
Ж*
\Г




}Леп«шстам-й«
Биологическая роль реакции декарбоксилирования:
» образуются высокоактивные биогенные амины
реакция декарбоксилирования необратима.
образуется конечный продукт С02
СПЕЦИФИЧЕСКИЕ ПУТИ А.К.
Обмен метионина.
Метионин -незаменимая а.к.,которая в основном используется для биосинтеза белкадакже:-включается в общий путь катаболизма а.к.
может иметь специфические пути обмена(р-ия трансметилирования)
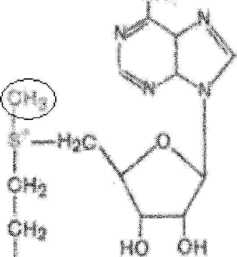
ТРАНСМЕТИЛИРОВАНИЯ-ферментативная реакция переноса метальной группы от донора SAM на какой либо акцептор в метаболических пр-х.
ЧМ2
СИ
-нн5
соон
&тВД8»ежЁшешшй«рАМ)
«ST»c«wsge№®errp
V
СИ|
метамин
реакция
даз шторой АТФ
отдаёт
3 оетатха
?ед$нствентя
H4P207
H3PG4
фосфорной
шепоты}![]()
![]()









![]()
SAM является донором метальной группы,т.к. метальная группа находится при атоме
S,имеющий положительный заряд,связь здесь не прочная и группа легко отщепляется. Биологическая роль SAM:
с-з холина
с. фосфотидилхолина
с. карнитина
с. адреналина « с. креатина
® с. нуклеотидов
с. анзерина(пептид нервной ткани)
обезвреживание биогенных аминов
с. цистеина
Синтез Креатина.
Идёт в 2-е стадии,используется 3 а.к.:глицин,аргинин,SAM.
