
0S03H
.-<4
0SG3K
|V
I.
NH2
NH2
дадвшш
серная «слета
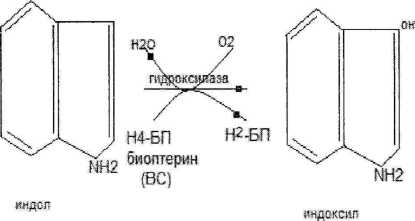
Обезвреживание
Фенола:
О
ft.
НИ
“Л
¥ДФ-тцшрон|1пТ<&
у\
т да \ У
Г
1
л
Г\
¥ДФ
1
фенов
О
А
У
ч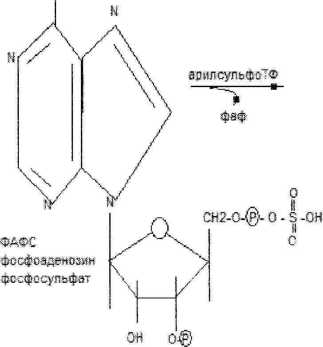

















Калкеаав сспь кчдоксклсерной кислоты
(Животный гндскс8п(50с0д»т с мочой
фб«ил-гоутронвд|метс>к-с:й
чное соединение выд-я с мочой)
УДФ-гпкжурон&вая
кислотз

белки
«ар
акте
зашяшых а.к.
распад
тканевых бедагоа
/
синтез
неороздедиэторвв UHC -с,
гшшдов
с.
небелковых аитосодержаарх
шедшт«'(хопан,^реатиы?н.1;
-штавошш
-с.
гема
-с.
гайшнта мепашка
-с.
пурина и тф«м«дша{агст»{стых основан»??
-с.
штеттштт
« ттржррьш
гормонов -с.
пепггвдоэСзшефмшы т
эедорфмны)
-ГНГ
Внутриклеточный
обмен.
Аминокислоты,
поступившие в клетку, включаются в
процессы анаболизма и катаболизма.
Пути поступления и использования а.к.:

Благодаря ферменту лизосом, тканевые белки распадаются(за сутки около 400 грамм белков). Благодаря распаду тканевых белков.белки организма обновляются.причём время жизни разных белков разный.
Катепсины-(протеиназы)(Ьерменты осуществяющие распад белков в клетках. Катепсины различают в зависимости оптимума pH:
кислые катепсины(лизосом ал ьн ые)
© нейтральные( цитозоль)
щелочные(в митохондриях)
В настоящее время известна структура-протеосома,благодаря которой происходит только распад внутриклеточных белков(короткоживущих,дефектных,поражённых.старых). Классификация катепсинов основывается не только по оптимому pH,но и по строению активных центров:
® тиоловые(в активном центре SH группа)
аспарагиновые
сериновые и др.
Буквенное обозначение катепсинов; А,В.С.Д...
Биологическая роль:
устраняют дефектные белки.
участвуют в обновлении белков,клеток тканей
мобилизируют эндогенный белок при гол о дани и,сахарном диабете.
участвуют в образовании биологически активных веществ,осуществляют частичный протеолиз прогормонов в гормон.профермент в фермент и т.п.
участвуют в расщеплении белков-ферменты пищ.сока.
Энергетическая функция а.к.(10-15%Е),т.е.функция катболизма, приобретает наибольшую важность при следующих случаях:
если с пищей человек получает больше а.к.,чем требуется.
если своб.а.к. в клетке не используется для синтеза белков.
при голодании,сахарном диабете.
Катаболизм а.к. может осуществляться по общим и специфическим путям.
Общие пути:
превращение по а-аминогруппе- дезаминированиелтериаминирование.трансдезаминирование.
превращение по а-карбоксильной группе(декарбоксилирование).
превращение по углеводному скелету.
ДЕЗАМИНИРОВАНИЕ.
Дезаминирование-это ферментативная реакция,в ходе которой а-аминогруппа а.к. отщепляется с образованием своб. NH3 и безазотистого остатка.
Виды дезаминирования:
окислительное
восстановительное
гидролитическое
внутримолекулярное
Окислительное Идёт в 2-а этапа:
Й-СЩ-СШН реакция окисления дезмяввфоваше
|% L {дегкдаиртанш)
-24
«ето«шота
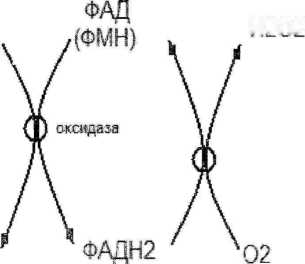
Ферменты,осуществляющие этот процесс наиболее активны в перокеисомах печени и почках.Они относятся к 1 классу океидоредуктаз,подкласс оксидаз. 2 -а вида оксидаз:
оксидазы 1)-а.к.
оксидазы L-а.к.
Оксидазы L-а.к. имеют в качестве кофактора ФМН,оптимум рН=10—»при физиологическом значении рН:^7.4 они мало активны.
Оксидазы D-а.к. -ФАД зависимые,оптимум рН=7,4,но D-изомеров очень мало в клетке,поэтому их роль до конца не установлена.
Схема работы оксидаз:
R
 I
I
ЮСО
мт^а8а.
Н20+02
I
С ООН
аминокислота
(ФМНН2)
Н20 NH3
R
^
ш С —с?
iooH
ш
с##
J
соон

кегошсвота
Единственная а.к.,которая активно дезаминируется в клетке-глутамат. Эту реакцию катализирует фермент глутамат ДГ(1 класс оксидоредуктаз,подкласс дегидрогеназ). Его кофакторы: НАД+,НаДФ+,11АДНН+,НАДФНН+,т.к. он может катализировать реакцию окислительного дезаминирования/гак и восстановленное аминирование а-кетоглутарата.
Белковая часть-6 субъединип-это атлостерический фермент,оптимум рН=7,34-7,4 Активность фермента регулируется:
Акцептор-АДФ,АМФ,ГДФ, НАД
Ингибитор-АТФ.ГТФ.НАДНН+
Химизм:
митохондрии:
II 17
..oAj1 Н / \ * HtyKJ Ьп V; 28
I I 29
—•- I40®> - С JHy—CMj —■ G - -ООО Н
■ * a-Ksiarsyf:a»ar
Н20 NH3
Биологическая роль:
а.к. теряет свою аминогруппу в виде конечного продукта NH3
образуется высоко реакционноспособный безазотистый остаток а-КГ
выделяется Е=3 АТФ
продукт удаления амминого N2 из состава а.к.,который затем может быть выведен из организма,благодаря чему поддерживается азотистый баланс
в результате кол-во а.к. в клетке уменьшается.
ПЕРЕАМИНИРОВАНИЕ(ТРАНСАМИНИРОВАНИЕ).
Переаминирование-это ферментативная реакция ,в ходе которой а-аминогруппа от а.к. переносится на а-кетокислоту,образуется новая а-а.к. и а-к.к.
Это реакция обратима и является универсальной для всех живых организмов. Реакцию катализирует фермент относящийся ко 2 классу -трансфераз, подкласс аминотраисфераз.
По строению это холофермент.кофактором которого является производное вит.Вб- ПАЛФ(пиридоксаль фосфат),он прочно связан с апоферментом и является простетической группой.
В реакция переаминирования вступают большинство а.к.,кроме:
лизина
® треонина
пролина
® оксипролина
В настоящее время было установлено,что в клетке имеется более 10 различных трансфераз,наиболее активны AJIAT и АСАТ(аспартатаминоТФ)
![]() Механизм
«Пинг-Понга»
Механизм
«Пинг-Понга»
