
- •1 Билет)
- •1) Алканы. Строение, нахождение в природе, получение, свойства.
- •2) Механизм электрофильного замещения в ароматическом ряду (SeAr), влияние заместителей на ориентацию
- •2 Билет)
- •1) Алкены: строение, получение, свойства
- •Дегидрирование алканов
- •2) Оптическая изомерия органических соединений с одним асимметричным атомом углерода
- •Рассмотренный вид изомерии называют оптической изомерией, зеркальной изомерией илиэнантиомерией. Обе зеркальные формы составляют пару оптических антиподов или энантиомеров. Проекционные формулы
- •3 Билет)
- •1) Циклоалканы. Стереометрия, методы получения, свойства
- •2) Электронное строение органических соединений. Описание химической связи с помощью метода гибридизации атомных орбиталей. Сигма и пи связь.
- •4 Билет)
- •1) Диены. Строение, получение, свойства
- •2) Оптическая изомерия органических соединений с двумя асимметрическими атомами углерода
- •5 Билет)
- •1) Алкины. Строение, получение, свойства
- •2) Активные промежуточные частицы, обазующиеся в органических реакциях: карбокатионы, карбоанионы, свободные радикалы
- •6 Билет)
- •1) Ароматические угле водороды. Классификация, номенклатура, природные источники. Химические свойства.
- •Свойства
- •Получение
- •2) Геометрическая изомерия
- •7 Билет)
- •1) Спирты. Классификация, номенклатура. Строение, получение и свойства.
- •2) Понятие резонанса в органической химии. Основные положения теории резонанаса
- •8 Билет)
- •1) Фенолы. Строение, получение, свойства
- •Способы получения
- •2) Реакции нуклеофильного замещения при sp3 гибридном атоме углерода. Sn1 механизм
- •9 Билет)
- •1) Простые эфиры и эпоксиды. Строение, получение, свойства
- •Реакционная способность[править]
- •2) Реакции элиминирования, механизм e2, стереохимия
- •10 Билет)
- •1) Галогенпроизводные алканов. Строение, получение, свойства
- •2) Смещение электронной плотности в органических молекулах. Индуктивный и мезомерный эффекты
- •11 Билет)
- •2) Радикальное замещение в ряду алканов, примеры и механизм реакций
- •12 Билет)
- •1) Карбонильные соединения
- •2) Механизм sn2
- •13 Билет)
- •14 Билет)
- •1) Кето-енольное таутомерия. Альдольно-кротоновая конденсация
- •2) Электронные формулы Льюиса и типы связей в органических соединениях.
- •15 Билет)
- •1) Карбоновые кислоты. Строение, получение, свойства
- •2) Изомерия и ее разновидности
- •16 Билет)
- •17 Билет)
- •1) Реактивы Гриньяра, литийорганические соединения Получение реактивов Гриньяра [править]
- •2) Реакции электрофильного замещения в ароматике Реакции ароматического электрофильного замещения
- •Реакции seAr
- •18 Билет)
- •1) Алифатические амины. Нуклеофильные свойства
- •Амины жирного ряда (алифатические амины)
- •2) Ароматичность. Хюккель
- •19 Билет)
- •1) Ароматические амины
- •2) Химические способы переработки горючих ископаемых
2) Реакции нуклеофильного замещения при sp3 гибридном атоме углерода. Sn1 механизм
Механизм SN1 (мономолекулярное нуклеофильное замещение) По этому механизму происходит нуклеофильное замещение в третичных и, в определенных условиях, во вторичных галогеналканах. В молекуле третичных галогеналканов объемные заместители при атоме углерода, связанном с галогеном, создают пространственные препятствия для подхода нуклеофила к электрофильному центру, и его атака с тыла становится невозможной. Вместе с тем третичные галоген-алканы способны в сильнополярных средах к ионизации. По механизму SN1 реакция протекает в две стадии. На первой стадии происходит диссоциация молекулы галогенал-кана при участии молекул протонного полярного растворителя. В результате образуются карбкатион и галоген идион. Поскольку процесс ионизации протекает медленно, то 1 стадия определяет скорость всей реакции. На второй стадии образовавшийся карбкатион быстро реагируете нуклеофилом. Протеканию реакции по механизму SN1 способствуют высокая ионизирующая и сольватирующая способность растворителя, а также стабильность образующегося карбкатиона. Устойчивость алкильных карбкатионов обусловлена делокализацией положительного заряда за счет +/-эффекта алкильных групп и возрастает в ряду.
9 Билет)
1) Простые эфиры и эпоксиды. Строение, получение, свойства
Эпоксиды (оксираны) — насыщенные трехчленные гетероциклы, содержащие в цикле один кислородный атом[1]. Эпоксиды являются циклическими простыми эфирами, однако вследствие напряженности трехчленного цикла обладают высокой реакционной способностью в реакциях раскрытия цикла.
Наиболее общими методами синтеза эпоксидов являются селективное окисление алкенов (эпоксидирование) и циклизация при дегидрогалогенировании галогенгидринов под действием оснований.
Лабораторным методом эпоксидирования алкенов является реакция Прилежаева — взаимодействие алкенов с перкарбоновыми кислотами в инертных неполярных или слабополярных растворителях:
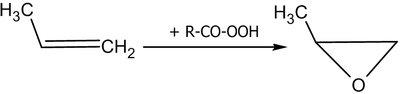
Эпоксидирование алкенов может осуществляться и под действием других пероксидных соединений (трет-бутилгидропероксид, пероксид водорода в щелочной среде при эпоксидировании α,β-непредельных карбонильных соединений), в промышленности этиленоксид получают каталитическим окислением этилена кислородом воздуха.
Другим общим методом синтеза эпоксидов является дегидрогалогенирование галогенгидринов под действием оснований, являющееся внутримолекулярным вариантом синтеза простых эфиров алкилированием алкилгалогенидов алкоголятами (реакция Вильямсона):

Реакционная способность[править]
Благодаря угловому напряжению трехчленного цикла эпоксиды гораздо более реакционноспособны по сравнению с ациклическими и ненапряженными циклическими простыми эфирами. Наиболее характерными и имеющими наибольшее значение в химии эпоксидов являются реакции с нуклеофилами с раскрытием цикла.
Под действием нуклеофилов раскрытие цикла происходит по механизму бимолекулярного нуклеофильного замещения SN2, при этом, в случае наличия в эпоксидном кольце алкильных или арильных заместителей, атака нуклеофила направляется на наименее замещенный атом углерода, реакция идет стереоспецифично с сохранением конфигурации.
Нуклеофильное присоединение к эпоксидам может катализироваться электрофилами. Так, при кислотном катализе на первой быстрой и обратимой стадии реакции происходит протонирование атома кислорода с образованием оксониевого катиона. Дальнейший путь реакции зависит от стабильности образовавшегося оксониевого иона. Если оксониевый ион стабилен, то далее он подвергается нуклеофильной атаке по механизму SN2:

В случае замещенных эпоксидов возможно раскрытие циклического оксониевого катиона с образованием стабильного третичного карбокатиона, который далее подвергается нуклеофильной атаке по механизму мономолекулярного замещения SN1. В таком случае направление раскрытия эпоксидного кольца противоположно наблюдающемуся при механизме SN2: присоединение нуклеофила идет по наиболее замещенному атому углерода оксиранового цикла.
