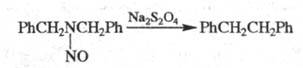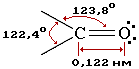- •1 Билет)
- •1) Алканы. Строение, нахождение в природе, получение, свойства.
- •2) Механизм электрофильного замещения в ароматическом ряду (SeAr), влияние заместителей на ориентацию
- •2 Билет)
- •1) Алкены: строение, получение, свойства
- •Дегидрирование алканов
- •2) Оптическая изомерия органических соединений с одним асимметричным атомом углерода
- •Рассмотренный вид изомерии называют оптической изомерией, зеркальной изомерией илиэнантиомерией. Обе зеркальные формы составляют пару оптических антиподов или энантиомеров. Проекционные формулы
- •3 Билет)
- •1) Циклоалканы. Стереометрия, методы получения, свойства
- •2) Электронное строение органических соединений. Описание химической связи с помощью метода гибридизации атомных орбиталей. Сигма и пи связь.
- •4 Билет)
- •1) Диены. Строение, получение, свойства
- •2) Оптическая изомерия органических соединений с двумя асимметрическими атомами углерода
- •5 Билет)
- •1) Алкины. Строение, получение, свойства
- •2) Активные промежуточные частицы, обазующиеся в органических реакциях: карбокатионы, карбоанионы, свободные радикалы
- •6 Билет)
- •1) Ароматические угле водороды. Классификация, номенклатура, природные источники. Химические свойства.
- •Свойства
- •Получение
- •2) Геометрическая изомерия
- •7 Билет)
- •1) Спирты. Классификация, номенклатура. Строение, получение и свойства.
- •2) Понятие резонанса в органической химии. Основные положения теории резонанаса
- •8 Билет)
- •1) Фенолы. Строение, получение, свойства
- •Способы получения
- •2) Реакции нуклеофильного замещения при sp3 гибридном атоме углерода. Sn1 механизм
- •9 Билет)
- •1) Простые эфиры и эпоксиды. Строение, получение, свойства
- •Реакционная способность[править]
- •2) Реакции элиминирования, механизм e2, стереохимия
- •10 Билет)
- •1) Галогенпроизводные алканов. Строение, получение, свойства
- •2) Смещение электронной плотности в органических молекулах. Индуктивный и мезомерный эффекты
- •11 Билет)
- •2) Радикальное замещение в ряду алканов, примеры и механизм реакций
- •12 Билет)
- •1) Карбонильные соединения
- •2) Механизм sn2
- •13 Билет)
- •14 Билет)
- •1) Кето-енольное таутомерия. Альдольно-кротоновая конденсация
- •2) Электронные формулы Льюиса и типы связей в органических соединениях.
- •15 Билет)
- •1) Карбоновые кислоты. Строение, получение, свойства
- •2) Изомерия и ее разновидности
- •16 Билет)
- •17 Билет)
- •1) Реактивы Гриньяра, литийорганические соединения Получение реактивов Гриньяра [править]
- •2) Реакции электрофильного замещения в ароматике Реакции ароматического электрофильного замещения
- •Реакции seAr
- •18 Билет)
- •1) Алифатические амины. Нуклеофильные свойства
- •Амины жирного ряда (алифатические амины)
- •2) Ароматичность. Хюккель
- •19 Билет)
- •1) Ароматические амины
- •2) Химические способы переработки горючих ископаемых
12 Билет)
1) Карбонильные соединения
Карбони́льная гру́ппа — функциональная группа >С=O органических соединений.
Карбонильная группа может входить в состав других функциональных групп, например, амидной или карбоксильной; соединения, в состав которых входит карбонильная группа, называют карбонильными соединениями.
Некоторые классы карбонильных соединений |
||
Класс соединений |
Структура |
Общ. формула |
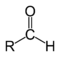
Альдегиды |
|
RCHO |
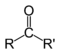
Кетоны |
|
RCOR' |
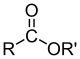
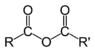
Сложные эфиры |
|
RCOOR' |
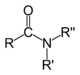
Амиды |
|
RCONR’R" |
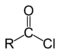
Ацилгалогениды |
|
RCOX, X=F,Cl,Br |
Карбоновые кислоты |
|
RCOOH |
Ангидриды карбоновых кислот |
|
(RCO)2O |
Способы получения. Исходными соединениями для получения альдегидов и кетонов могут быть углеводороды, галогенопроизводные, спирты или кислоты. Гидратация алкинов. Взаимодействие алкинов с водой происходит в присутствии солей Hg2+ и дает ацетальдегид СН3СНО в случае ацетилена и различные кетоны в случае гомологов ацетилена. Окисление спиртов. При окислении первичных спиртов образуются альдегиды, вторичных — кетоны. Каталитическое окисление метана. Важным промышленным способом получения формальдегида (метаналя) является каталитическое окисление метана кислородом воздуха.
2) Механизм sn2
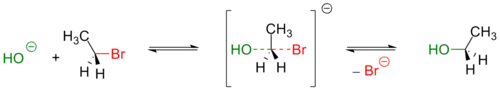
Механизм реакции SN2 или реакции бимолекулярного нуклеофильного замещения (англ. substitution nucleophilic bimolecular ) происходит в одну стадию, без промежуточного образования интермедиата. При этом атака нуклеофила и отщепление уходящей группы происходит одновременно:
R−X + Y− → [Y⋯R⋯X]− → R−Y + X−
Примером реакции SN2 является гидролиз этилбромида:
Условный энергетический профиль реакции бимолекулярного нуклеофильного замещения представлен на диаграмме[3].
Скорость реакции SN2 зависит как от концентрации нуклеофила, так и концентрации субстрата[4]:
Скорость реакции = k × [RX] × [Y]
Так как в процессе реакции атака нуклеофилом может происходить только с одной стороны, результатом реакции является стереохимическая инверсия образующегося продукта.
Ещё в 1895 году году этот эффект обнаружил латышский химик Пауль Вальден («обращение Вальдена»), однако он не смог его объяснить[5]. В 1935 году Хьюз исследуя реакцию оптически активного 2-йодоктана с йодид-ионом обнаружил, что реакция имеет общий второй кинетический порядок и первый по каждому из реагентов, а также что скорость рацемизации в два раза выше скорости внедренияйода в молекулу йодоктана[2]. Так было сформулировано стереохимическое SN2 правило:
В реакциях бимолекулярного нуклеофильного замещения атакующий нуклеофил стереохимически инвертирует молекулу, в которой он замещает уходящую группу.
13 Билет)
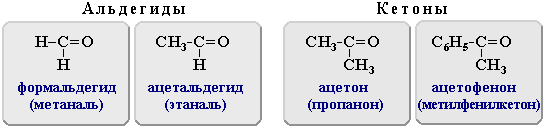
1) Альдегиды и кетоны. Электронное строение, химические свойства. ОВ превращения
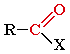
Альдегиды и кетоны относятся к карбонильным органическим соединениям. Карбонильными соединениями называют органические вещества, в молекулах которых имеется группа >С=О (карбонил или оксогруппа).
Общая формула карбонильных соединений:
|
В зависимости от типа заместителя Х эти соединения подразделяют на: альдегиды ( Х = Н ); кетоны ( Х = R, R' ); карбоновые кислоты ( Х = ОН ) и их производные ( Х = ОR, NH2, NHR, Hal и т.д.). Альдегиды - органические соединения, в молекулах которых атом углерода карбонильной группы (карбонильный углерод) связан с атомом водорода. Общая формула: R–CН=O или
|
R = H, алкил, арил |
Функциональная группа –СН=О называется альдегидной. Кетоны - органические вещества, молекулы которых содержат карбонильную группу, соединенную с двумя углеводородными радикалами. Общие формулы: R2C=O, R–CO–R' или
|
R, R' = алкил, арил |
|
|
||
|
Атомы углерода и кислорода в карбонильной группе находятся в состоянии sp2-гибридизации. Углерод своими sp2-гибридными орбиталями образует 3-связи (одна из них - связь С–О), которые располагаются в одной плоскости под углом около 120° друг к другу. Одна из трех sp2-орбиталей кислорода участвует в -связи С–О, две другие содержат неподеленнные электронные пары. -Связь образована р-электронами атомов углерода и кислорода. |
|
|
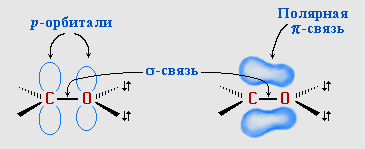
Связь С=О сильно полярна. Ее дипольный момент (2,6-2,8D) значительно выше, чем у связи С–О в спиртах (0,70D). Электроны кратной связи С=О, в особенности более подвижные -электроны, смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда. Карбонильный углерод приобретает частичный положительный заряд.

Поэтому углерод подвергается атаке нуклеофильными реагентами, а кислород - электрофильными, в том числе Н+.
2) Элиминирование Е1
механизм E1 - двухстадийный процесс, в к-ром медленная лимитирующая стадия - ионизация субстрата с образованием карбкатиона; последний быстро отдает протон основанию, к-рым часто служит р-ритель:
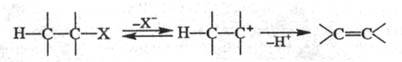
Обычно р-ции по механизму E1 идут без добавления основания, они нестереоспецифичны, т.к. прежде чем отдать протон, карбкатион может принять наиб. устойчивую конформацию. По карбанионному механизму E1cB сначала отщепляется Н, а затем X. Это двухстадийный процесс, в к-ром интермедиатом служит карбанион:
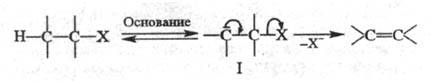
Обозначение
механизма символом E1cB отражает участие
в р-ции сопряженного основания ф-лы
I (сВ - сопряженное основание,
conjugated base). По механизму E1cB преим.
реагируют субстраты,
у к-рых водород активирован
сильными электроноакцепторными
группами.
Элиминирования реакции,
протекающие в газовой фазе (пиролитич.
элиминирование), могут происходить по
перициклич. и свободнорадикальному
механизмам.
О
механизме фотохим.
элиминирования реакций карбонильных
соед. см. Фрагментации
реакции.
Элиминирования реакции применяют
в орг. синтезе для получения олефинов (см.,
напр., Бэмфорда-Стивенса
реакция),
а также циклич. соед., напр,
образование![]() -лактамов
из эфиров
-лактамов
из эфиров![]() -аминокислот
под действием реактива Гриньяра (р-ция
Брекпота):
-аминокислот
под действием реактива Гриньяра (р-ция
Брекпота):
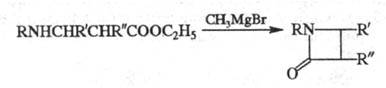
К
элиминирования реакциям с
образованием![]() -связи
относится, напр., превращение
дибензилнитрозоамина в дибензил при
действии дитионита
натрия (р-ция
Овербергера-Ломбардино):
-связи
относится, напр., превращение
дибензилнитрозоамина в дибензил при
действии дитионита
натрия (р-ция
Овербергера-Ломбардино):