
- •Методические указания
- •Занятие №1
- •Содержание занятия
- •Вопросы и упражнения для подготовки к занятию
- •Образец билета для тест–контроля
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Образец билета выходного тест-контроля:
- •Занятие №2
- •Содержание занятия
- •Вопросы для подготовки к занятию
- •Образец билета входного тест-контроля
- •Разбор типовых задач
- •Значение рН различных систем
- •Значение рН, благоприятные для развития патогенных бактерий
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Занятие №3
- •Содержание занятия
- •Вопросы и упражнения для подготовки к занятию
- •Образец билета входного тест-контроля
- •Разбор типовых задач
- •Практическая работа
- •Образец билета выходного контроля
- •Занятие №4
- •Содержание занятия
- •Вопросы к контрольной работе по модулю №1
- •Типовые задачи к рубежной контрольной работе по модулю №1
- •Образец билета контрольной работы по модулю №1
- •Занятие №5
- •Содержание занятия
- •Вопросы для подготовки к занятию
- •Образец билета входного тест–контроля
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Образец билета выходного тест-контроля:
- •Занятие №6
- •Содержание занятия
- •Вопросы и задачи для подготовки к занятию
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Образец билета выходного контроля
- •Занятие №7
- •Содержание занятия
- •Вопросы и задачи для подготовки к занятию
- •Образец билета входного тест-контроля
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Занятие №8
- •Содержание занятия
- •Вопросы к контрольной работе по модулю №2
- •Типовые задачи к контрольной работе по модулю №2
- •Образец билета контрольной работы по модулю №2
Разбор типовых задач
1. Вычислите рН фосфатного буфера, составленного 100 мл 0,1 М КН2РО4 и 50 мл 0,15 М К2НРО4.
Решение: Расчет рН фосфатного буфера проводим по формуле:
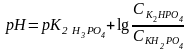
Значение
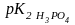 =
6,8 (берем из справочника).
=
6,8 (берем из справочника).
Так как концентрация вещества пропорциональна количеству вещества:
n = C×V,
то в формулу подставим количества вещества КН2РО4 и К2НРО4.

2. Как изменится рН фосфатного буфера, содержащего 100 мл дигидрофосфата калия и 300 мл раствора гидрофосфата калия (концентрации исходных растворов равны по 0,1 моль/л), при добавлении к нему 20 мл раствора NaOH с концентрацией 0,1 моль/л?
Решение: Сначала рассчитаем значение рН исходного раствора:

При добавлении NaOH с ним в первую очередь взаимодействует КН2РО4 по схеме:
КН2РО4 + NaOH = NaKHPO4 + H2O
Часть дигидрофосфата переходит в гидрофосфат.
 =
0,1×0,1
= 0,01 моль;
=
0,1×0,1
= 0,01 моль;
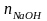 =
0,02×0,1
= 0,002 моль
=
0,02×0,1
= 0,002 моль
После реакции дигидрофосфата калия останется:
 =
0,01 - 0,002 = 0,008 моль
=
0,01 - 0,002 = 0,008 моль
Общее количество гидрофосфата станет:
 =
0,3 ×
0,1 + 0,002 = 0,032 моль
=
0,3 ×
0,1 + 0,002 = 0,032 моль
Рассчитаем рН полученного раствора:
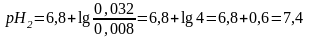
Изменение рН составит:

Тогда:
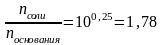
Следовательно, мольное соотношение NH4Cl к NH3 должно быть:
n :
n
®
1,78 : 1
:
n
®
1,78 : 1
Значение рН различных систем
Среды организма |
рН |
Сыворотка крови |
7,36-7,44 |
Чистый желудочный сок |
0,9 |
Сок поджелудочной железы |
7,5-7,8 |
Желчь в протоках |
7,4-8,5 |
Желчь в пузыре |
5,4-6,9 |
Моча |
4,8-7,5 |
Молоко |
6,6-6,9 |
Дистиллированная вода, находящаяся в равновесии с воздухом |
5,5 |
Морская вода |
8,0 |
Свежий яичный белок |
8,0 |
Значение рН, благоприятные для развития патогенных бактерий
Вид бактерий |
рН |
Стафилококки |
7,4 |
Стрептококки |
7,4-76 |
Пневмококки |
7,6-7,8 |
Менингококки |
7,4-7,6 |
Гонококки |
7,0-7,4 |
Лабораторная работа
Задание 1. Приготовление буферного раствора.
В три пробирки внесите 0,1 М растворы СН3СООН и СН3СООNa в соотношении (по объему): 9:1, 5:5 и 1:9. Каждый приготовленный раствор хорошо перемешать. Во все три пробирки прибавьте по 3 капли индикатора метилового оранжевого или метилового красного. Сравните и запишите окраску растворов. По известной формуле рассчитайте значения рН во всех трех растворах. В каких пределах изменилось значение рН?
Номера пробирок |
1 |
2 |
3 |
Соотношение кислота : соль в буферном растворе |
|
|
|
Окраска растворов после добавления индикатора |
|
|
|
Расчетное значение рН |
|
|
|
Задание 2. Определение буферной емкости по кислоте и по щелочи.
В конической колбе приготовьте буферный раствор, смешав 10 мл 0,1 М СН3СООН и 10 мл 0,1 М раствора СН3СООNa. В другой колбе приготовьте раствор – свидетель, смешивая 18 мл 0,1 М СН3СООН и 2 мл 0,1 М СН3СООNa.
В обе колбы внесите по 3 капли раствора метилового оранжевого. Сравните окраску растворов. Затем содержимое первой колбы титруйте из бюретки 0,1 М раствором НС1 до получения одинаковой окраски с раствором – свидетелем. Запишите затраченный объем раствора НС1 и рассчитайте по известной формуле буферную емкость ацетатного буфера. Значение рН содержимого 1 и 2 колб берите из расчетных величин 2 и 3 пробирок (см. табл. из пред. задания). Бюретку с 0,1 М раствором НС1 надо приготовить соблюдая правила ацидометрии параллельно с приготовлением содержимого 1 и 2 колб.
Для определения емкости ацетатного буфера по щелочи надо приготовить колбу с содержанием 10 мл 0,1 М СН3СООН и 10 мл 0,1 М СН3СООNa и раствор – свидетель (другая колба), содержащий 18 мл 0,1 М СН3СООNa и 2 мл 0,1 М СН3СООН. После добавления 3 капель раствора метилового оранжевого в каждую колбу, содержимое 1-ой колбы титруйте из бюретки 0,1 М раствором NaOH до одинаковой окраски с раствором – свидетелем. Записав объем затраченного раствора NaOH рассчитайте буферную емкость по щелочи. Значения рН содержимого 1-ой и 2-ой колб берите из расчетных величин 2 и 1 пробирок (см. табл. из пред. задания). Бюретку с 0,1 М раствором NaOH надо приготовить соблюдая правила алкалиметрии параллельно с приготовлением содержимого 1-ой и 2-ой колб.
Сравните буферную емкость ацетатного буфера по кислоте и по щелочи. Сделайте выводы.
