- •Методические указания
- •Занятие №1
- •Содержание занятия
- •Вопросы и упражнения для подготовки к занятию
- •Образец билета для тест–контроля
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Образец билета выходного тест-контроля:
- •Занятие №2
- •Содержание занятия
- •Вопросы для подготовки к занятию
- •Образец билета входного тест-контроля
- •Разбор типовых задач
- •Значение рН различных систем
- •Значение рН, благоприятные для развития патогенных бактерий
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Занятие №3
- •Содержание занятия
- •Вопросы и упражнения для подготовки к занятию
- •Образец билета входного тест-контроля
- •Разбор типовых задач
- •Практическая работа
- •Образец билета выходного контроля
- •Занятие №4
- •Содержание занятия
- •Вопросы к контрольной работе по модулю №1
- •Типовые задачи к рубежной контрольной работе по модулю №1
- •Образец билета контрольной работы по модулю №1
- •Занятие №5
- •Содержание занятия
- •Вопросы для подготовки к занятию
- •Образец билета входного тест–контроля
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Образец билета выходного тест-контроля:
- •Занятие №6
- •Содержание занятия
- •Вопросы и задачи для подготовки к занятию
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Образец билета выходного контроля
- •Занятие №7
- •Содержание занятия
- •Вопросы и задачи для подготовки к занятию
- •Образец билета входного тест-контроля
- •Разбор типовых задач
- •Лабораторная работа
- •Ситуационные задачи для контроля усвоения темы
- •Занятие №8
- •Содержание занятия
- •Вопросы к контрольной работе по модулю №2
- •Типовые задачи к контрольной работе по модулю №2
- •Образец билета контрольной работы по модулю №2
Образец билета для тест–контроля
1. В основе титриметрического анализа лежит закон:
а) Авогадро; б) эквивалентов;
в) сохранения массы веществ г) действующих масс
2. Метод нейтрализации основан на реакциях:
а) окисления-восстановления;
б) осаждения;
в) кислотно-основного взаимодействия;
г) комплексообразования
3. Для точного измерения объемов применяют:
а) мерную колбу; б) цилиндр;
в) пипетку, г) мензурку
4. Рабочий раствор щелочи готовят:
а) по точной навеске; б) но приблизительной навеске;
в) по точному объему; г) из стандарт-титра
5. Используется как первичный стандарт для стандартизации рабочего раствора соляной кислоты:
а) Н2С2О4× 2Н2О: б) NaOН; в) КВг; г) Na2CO3
6. При титровании щавелевой кислоты раствором, гидроксида натрия лучше использовать индикатор:
а) фенолфталеин б) метилоранж
в) соляная кислота г) лакмус
7. Реакция, лежащая в основе титриметрического анализа не должна протекать:
а) в соответствии с уравнением химической реакции;
б) быстро,
в) без побочных продуктов реакции;
г) обратимо
8. Расчет содержания определяемого вещества в граммах по результатам титрования находят по формуле:
a) Сэкв1×V1 = Сэкв2×V2; б) а=(Сэкв×V×Уч)/1000
в) m=V× p; г) m(р-в)=m(р-ра) × w(р-в)/100
Разбор типовых задач
1. Рассчитайте молярную концентрацию 0,9%-ного раствора хлорида натрия, если r=1 г/мл.
Решение: Связь между молярной концентрацией и массовой долей растворенного вещества выражается соотношением:
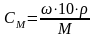 ,
где
,
где
МNaCl = 58,5 г/моль
Отсюда
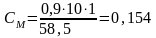 моль/л.
моль/л.
2. Сколько грамм H3PO4 содержится в 500 мл 0,2 моль/л раствора фосфорной кислоты?
Решение: Массу вещества в растворе можно найти по формуле:
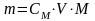 ,
где
,
где
М =98
г/моль
=98
г/моль
Отсюда
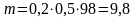 г.
г.
3. Найти молярную концентрацию эквивалента, поправочный коэффициент и титр 0,1 М раствора NaOH, если на титрование 10,0 мл 0,1000 М раствора щавелевой кислоты затрачено 10,2 мл раствора щелочи.
Решение: Связь между объемами и молярными концентрациями эквивалента кислоты и щелочи позволяет найти Сэкв раствора NaOH:
Cэкв(NaOH)=Cэкв(H2C2O4)×V(H2C2O4)/V(NaOH)=10,00×1000/10,2 = 0,0980 моль/л
Поправочный коэффициент равен:
Kп = Cэкв(NaOH)пр/Cэкв(NaOH)теор = 0,0980/0,1 = 0,980.
Титр находим по формуле:
Т = Сэкв×Уч/1000, где
Уч - условная частица NaOH, равная его молярной массе, т.к. z=1.
т.е. УЧ(NaOH) = M(NaOН) = 40 г/моль.
Отсюда Т(NaOH) = 0,0980×40/1000=0,003922 г/мл.
Способ выражения концентрации |
Определение |
Расчетная формула |
Размерность |
Массовая доля (процентная концентрация по массе) |
Содержание массы растворенного вещества в 100 массовых единицах его раствора |
|
безразмерная |
Объемная доля (процентная концентрация по объему или градусы) |
Содержание объема растворенного вещества в 100 объемных единицах его раствора |
|
- // - |
Мольная доля (молярная доля) |
Отношение числа молей растворенного вещества к сумме молей всех компонентов раствора |
|
- // - |
Молярная концентрация |
Число молей растворенного вещества в 1 л его раствора |
|
моль/л |
Моляльная концентрация |
Число молей растворенного вещества в 1 кг растворителя |
|
моль/кг |
Молярная концентрация эквивалента (нормальная концентрация) |
Количество грамм-эквивалентов или условных частиц растворенного вещества в 1 литре раствора |
|
моль/л или г-экв/л |
Титр |
Масса растворенного вещества, содержащегося в 1 мл его раствора |
|
г/мл |
Титр по определяемому веществу (двойной титр) |
Величина, показывающаяся, сколько грамм определяемого вещества соответствует (эквивалентно) 1 мл данного титранта |
|
г/мл |