
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3 ---задача
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3 – Задача
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3--- Задача
- •Вопрос 2
- •Вопрос 3-- Задача
- •Вопрос 1
- •Вопрос 2
- •Вопрос 1
- •Вопрос 2
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3--- Задача
- •Вопрос 1
- •Вопрос 2
- •Вопрос 1
- •Вопрос 2
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3----- Задача
- •Вопрос 1
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3—Задача
- •Вопрос 1
- •Вопрос 2
- •Вопрос 3---Задача
- •Вопрос 1
- •Вопрос 3--Задача
Вопрос 1
Общая характеристика щелочных металлов.В Периодической системе они следуют сразу за инертными газами, поэтому особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на внешнем энергетическом уровне: их электронная конфигурация ns1. Очевидно, что валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа. Поэтому для всех щелочных металлов характерны восстановительные свойства.
Вопрос 2
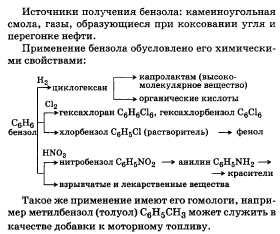
Бензо́л (C6H6, PhH) — органическое химическое соединение, бесцветная жидкость с приятным сладковатым запахом. Простейший ароматический углеводород. Бензол входит в состав бензина, широко применяется в промышленности, является исходным сырьём для производства лекарств, различных пластмасс, синтетической резины, красителей.
Физические свойства-Бензол (жидкий)
Бесцветная жидкость со своеобразным резким запахом. Температура плавления = 5,5 °C, температура кипения = 80,1 °C, плотность = 0,879 г/см³, молярная масса = 78,11 г/моль. Подобно ненасыщенным углеводородам бензол горит сильно коптящим пламенем. С воздухом образует взрывоопасные смеси, хорошо смешивается с эфирами, бензином и другими органическими растворителями, с водой образует азеотропную смесь.
Химические свойства-Для бензола характерны реакции замещения — бензол реагирует с алкенами, хлоралканами, галогенами, азотной и серной кислотами. Реакции разрыва бензольного кольца проходят в жёстких условиях (температура, давление).
Структурная формула:

Билет № 7
Вопрос 1
Хло́роводоро́д[1], хло́ристый водоро́д[2] (HCl) — бесцветный, термически устойчивый газ (при нормальных условиях) с резким запахом, дымящий во влажном воздухе, легко растворяется в воде (до 500 объёмов газа на один объём воды) с образованием хлороводородной (соляной) кислоты.
Применение-Водный раствор широко используется для получения хлоридов, для травления металлов, очистки поверхности сосудов, скважин от карбонатов, обработки руд, при производстве каучуков, глутамината натрия, соды, хлора и других продуктов. Также применяется в органическом синтезе.
Соли соляной кислоты или хлориды – соединения хлора со всеми элементами, имеющими меньшее значение электроотрицательности.
Вопрос 2
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ Углеводороды, содержащие в углеродной цепи две двойные связи называются диеновыми. Их общая формула: Изомерны алкинам С n H 2 n -2.
Химические свойства-Для диенов характерны два типа реакций:
Реакции присоединения
Реакции полимеризации
В зависимости от кратности углерод-углеродных связей углеводороды подразделяют на предельные (алканы) и непредельные (алкены, алкины, диены). Циклические углеводороды разделяют на алициклические и ароматические.
Получение
Синтез Лебедева:
2CH3-CH2-OH --Al2O3, ZnO, t--> CH2=CH-CH=CH2 + 2H2O + H2
Формально эту реакцию можно представить как дегидратацию двух молекул этилового спирта с одновременным межмолекулярным дегидрированием.
Применение в промышленности. Диеновые углеводороды в основном применяются для синтеза каучуков. Синтетические каучуки образуются в результате реакции полимеризации соответствующих мономеров.
