Экзаменационные билеты по биохимии для студентов 2 курса педиатрического факультета
Билет № 1
1.Ферменты. Биологическая роль. Структурно-функциональная организация. Активный центр, его участки. Кофакторы и апоферменты. Понятие об энзимопатиях. Энзимотерапия.
2.Переваривание белков в желудке. Механизм активации пепсина. Роль соляной кислоты в пищеварении, механизм образования. Участие гистамина, гастрина в регуляции образования и секреции соляной кислоты. Возможные последствия снижения или повышения секреции соляной кислоты.
Несколько типов клеток:
1)Обкладочные(париетальные)- соляная кислота+гликопротеин(внутренний фактор касла,связывает внешний- витамин В12,)
2)главные-пипсиноген
3)екл-гистамин
4)джи-гастрин(расположены на малой кривизне и в пилорической области)-активация главных к-ок
Активация пепсина:
1. белки в желудок- гистамин и гастрин
2.гистамин и гастрин- соляная кислота,гастрин-пипсиноген
3.солянная кислота+пипсиноген-пипсин(ограниченный протеолиз), актвные молекулы пепсина+пепсиноген-пепсин(аутокатализ)
Механизм образования соляной кислоты
1.из крови СО2-в клетку+вода-Н2СО3,под действием карбоангидразы,Н2СО3 диссоциирует- НСО3(выделяется в плазму в обмен на хлор)+водород
2.хлор и водород в вакуоль,где образуется соляная кислота
3.вакуоль сокращается под действием гастрина и поступает в желудок
Роль соляной кислоты
рН 1.5-2
активация пепсиногена
бактерицидное действие
денатурация белков
в 12-ти пёрстной кишке-клетки секретирующие секретин,холецистокенин,мотилин
3.Глюкокортикоиды. Химическая природа, образование, ткани-мишени. Влияние глюкокортикоидов на углеводный, белковый и липидный обмены.
Задача: Биохимический анализ крови:
общий билирубин – 58 мкмоль/л (N < 20,5 мкмоль/л)
непрямой билирубин – 37,3 мкмоль/л (N < 17,1 мкмоль/л)
прямой билирубин – 20,7 мкмоль/л (N < 5,1 мкмоль/л)
альбумин – 30 г/л (N 35-50 г/л)
ЛДГ общая – 245 ЕД/л (N 93-184 ЕД/л)
ЛДГ4 – 17% (N 3-9%)
ЛДГ5 - 15% (N 3-12%)
Анализ мочи:
уробилиноген +++
Ваше заключение.
Билет № 2
1.Различие и сходство неорганических и органических катализаторов. Механизм ферментативного катализа.
2.Переваривание белков в двенадцатиперстной кишке. Протеазы поджелудочной железы и энтероцитов: механизм активации, химизм действия, продукты переваривания. Механизм всасывания аминокислот.
Преваривание в двенадцатипёрстной кишке
1.химус(рН 1.5-2)-выделение гормона секретина-нейтрализация соляной кислоты, разрушение пепсина(рН=7)
2.выработка панкеатических проферментов:
3.активация:
1)Трипсиноген+энтеропептидазы кишечника-трипсин(энтеропептидаза-расщепляет пептидные связи внутри полипептидных цепей)
2)трипсин+
Химотрипсиноген-химотрипсин(эндопептидаза)
Прэластаза-эластаза
Прокарбоксипептидаза-карбоксипептидаза(экзопептидаза-отщепляет аминокислоты с С-конца)
Протеазы секретируемые энтероцитами:
Аминопептидаза-экзопептидаза,отщепляет аминокислоты с N-конца
Дипептидаза-гидролизует дипептиды
Прдукты переваривания-свободныеаминокислоты
Транспорт аминокислот через клеточную мембрану
гамма-глутамильный цикл
Это группа ферментов, один из которых встроен в мембрану – гамма-глутамилтрансфераза (ГТ), коферментом которого является глутатион (трипептид: глутамин, цистеин, глицин)
ГТ осуществляет реакцию между глутатионом (глутамином) и аминокислотой
Дипептид глутамил-аминокислота переходит в клетку
Специальный фермент гидролизует дипептид глутамил-аминокислота, высвобождая аминокислоту
Из остатков – глутамина и дипептида цис-гли ферменты вновь синтезируют глутатион
3.Гормоны щитовидной железы. Химическая природа, образование, ткани-мишени. Регуляция тироксином обмена веществ.
Задача: Обследован военнослужащий 24 лет после длительного пешего перехода.
Общий анализ крова:
эритроциты – 3,21012/л (N 4,0 – 5,5 1012/л)
гемоглобин – 100 г/л (N 120 - 140 г/л)
Биохимический анализ крови:
общий билирубин – 54 мкмоль/л (N < 20,5 мкмоль/л)
непрямой билирубин – 33,3 мкмоль/л (N < 17,1 мкмоль/л)
Анализ мочи:
цвет – темно-желтый
гемоглобин ++
Анализ кала:
стеркобилин – 1000 мг/% (N 200 - 600 мг/%)
Ваше заключение.
Билет № 3
1.Регуляция активности ферментов. Направления, уровни регуляции, биологическое значение. Механизмы регуляции: ковалентная модификация структуры, аллостерическая регуляция.
2.Гниение аминокислот в толстом кишечнике. Основные продукты гниения. Биологическая роль процессов гниения в кишечнике. Обезвреживание продуктов гниения белков в печени: этапы, типы химических реакций. Токсическое действие продуктов гниения. Основные пути использования аминокислот в организме.
Гниение аминокислот в толстом кишечнике
Микроорганизмы осуществляет анаэробное превращение аминокислот, продуцируя токсические амины
Лизин-кадаверин(трупный яд)
Триптофан-скатол и индол
Тиразин- крезол и фенол
Толстый кишечник-воротная вена-печень
Обезвреживание:
1 этап – гидроксилирование – внедрение в молекулу субстрата гидроксильной группы с помощью свободно-радикального механизма
Ферменты микросом печени:
Цитохромы Р450 (оксидаза)
НАДФН, ФАДН2, Fe3+
Цитохромы В5 (редуктаза)
НАДН, ФАДН2, Fe3+
Субстраты окисления: RH, O2
P450 Fe3+ + e (НАДФН) => P450 Fe2+ + (НАДФ)
P450 Fe2+ + О2 => P450 Fe3+ + О2̊ -
НАДФ + ФАДН2 => НАДФН + ФАД + H+
О2̊ - + RH => O22- + R ̊ + H+
O22- + H+ + H+ => H2O2
H2O2 + e (НАДФН) P450 => OH- + OH ̊ + (НАДФ)
R ̊ + OH ̊ => R-OH
Индол+ОН=>индоксил
2 этапобезвреживания- (коньюгация): R-OH + кислоты (глюкуроновая, серная, аминокислоты)
глюкуронилтрансфераза
R-OH + УДФ-С6Н9О6 => R-O -С6Н9О6 +УДФ
сульфотрансфераза
R-OH + ФАФ -SO3H => R-O-SO3H + ФАФ
глутатионтрансфераза
R-OH + GSH => RGS + Н2О
Токсическое действие продуктов гниения
Пути использования аминокислот
Функциональные белки организма
Синтез гормонов,нейромедиаторов,азотистых оснований, заменимых аминокислот
3.Кровь. Клеточные и неклеточные компоненты, их биологическая роль.
Задача: Биохимический анализ крови:
общий билирубин – 55 мкмоль/л (N < 20,5 мкмоль/л)
непрямой билирубин – 33,3 мкмоль/л (N < 17,1 мкмоль/л)
прямой билирубин – 21,7 мкмоль/л (N< 5,1 мкмоль/л)
гамма-глутамилтранспептидаза – 2,8 мккат/л (N < 0,52 мккат/л)
АЛТ – 2,41 мккат/л (N < 0,67 мккат/л)
Анализ мочи:
билирубин ++
уробилиноген ++
Ваше заключение.
Билет № 4
1.Механизмы конкурентного и неконкурентного ингибирования ферментов. Значение для токсикологии. Лекарственные препараты как ингибиторы ферментов.
2.Дезаминирование аминокислот. Реакции прямого и непрямого окислительного дезаминирования, ферменты, механизм, продукты реакций. Пути превращений альфа-кетокислот на примере пирувата.
Дезаминирование – отщепление альфа-аминогруппы от аминокислоты
Аминокислота-альфа-аминогруппаальфа-кетокислота(безазотистый остаток)+амиак
Альфа-кетокислота-глюконеогенез,кетогенез,реакции трансаминирования,реакции окисления до СО2 и Н2О
Амиакмочевина и соли амониявыделение из организма
Окислительное дезаминирование(глутатионовой кислоты)
НАД(кофермент)глутаматдегидрогеназа(активна в митохондриях,искл.скелетные мышцы; регуляторный
фермент кислотного обмена)
2 этапа:1.ферментативное дегидрирование глутаматаальфа-иминоглутарат
2.неферментативное,гидролитическое отщепление имминогруппы в виде амиака

Непрямое дезаминирование(трансдезаминирование)
Трансаминирование(превращение любой аминокислоты в глутамат) окислительное дезаминирование
Трансаминирование - реакция переноса альфа-аминогруппы с аминокислоты на альфа-кетокислотуновая аминокислота(глутамат)+новая альфа-кетокислота(пр.пируват)
(реакция обратима)
Витамин В6-пиридоксальфосфат(кофермент)-аминотрансферазы(субстратная специфичность)
Пируват: два пути- аэробный и анаэробный.
Аэробный:
(пируватдегидрогеназный комплекс) ацетил-коферментАЦТКдыхательная цепьCО2+Н2О
оксалоацетатуглекислый газ + вода
Анаэробный
молочная кислота
Пируват является «точкой пересечения» многих метаболических путей. Он может быть превращён обратно в глюкозу в процессе глюконеогенеза, или в жирные кислоты или энергию через ацетил-КоА, в аминокислоту аланин, или в этанол. Таким образом пируват объединяет несколько ключевых метаболических процессов клетки и является универсальной «метаболической валютой» живой клетки.
3.Плазма крови, химический состав. Неорганические вещества. Биологическая роль. Диагностическое значение определения в плазме крови концентрации натрия, калия, кальция, фосфора, железа.
Задача: Биохимический анализ крови:
общий билирубин – 49,3 мкмоль/л (N < 20,5 мкмоль/л)
непрямой билирубин – 23,3 мкмоль/л (N < 17,1 мкмоль/л)
прямой билирубин – 26 мкмоль/л (N< 5,1 мкмоль/л)
щелочная фосфатаза – 6,45 мккат/л (N 0,74 - 2,29 мккат/л)
Анализ мочи:
билирубин ++
уробилиноген отсутствует
Анализ кала:
цвет «глинистый» (ахоличный)
стеаторея
Ваше заключение.
Билет № 5
1.Номенклатура и классификация ферментов, связь с видом катализируемой реакции. Понятие об изоферментах, их биологическая роль. Энзимодиагностика.
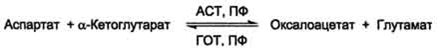
2.Реакции трансаминирования (написать реакции с участием аланин- и аспартатаминотрансфераз). Биологическая роль реакции трансаминирования. Клинико-диагностическое значение определения АЛТ и АСТ в сыворотке крови.
Трансаминирование - реакция переноса альфа-аминогруппы с аминокислоты на альфа-кетокислоту=новая аминокислота+новая альфа-кетокислота(реакция обратима)
Витамин В6-пиридоксальфосфат(кофермент)-аминотрансферазы(субстратная специфичность)
1.
 (без
формул, только названия,как во второй
реакции!!!)
(без
формул, только названия,как во второй
реакции!!!)
2.