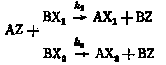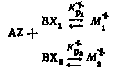- •В.Д.Нефедов е.Н.Текстер м.А.Торопова радиохимия
- •Глава 1
- •§ 1. Предмет радиохимии
- •§ 2. Краткий очерк истории развития радиохимии
- •§ 3. Особенности радиохимии
- •§ 4. Значение радиохимии
- •1 Общая радиохимия глава 2
- •§ 1. Общехимические свойства изотопных частиц
- •2. Термодинамическое поведение изотопных частиц
- •3. Кинетическое поведение изотопных частиц
- •Глава 3
- •§ 1. Классификация реакций изотопного обмена
- •§ 2. Причины протекания реакций изотопного обмена
- •3. Особенности реакций идеального изотопного обмена
- •§ 4. Основное уравнение кинетики реакций идеального изотопного обмена
- •§ 5. Основы экспериментальных методов исследования процессов изотопного обмена
- •Глава 4
- •§ 1. Состояние радиоактивных элементов [нуклидов] в жидкой фазе
- •§ 2. Процессы радиоколлоидообразования
- •§ 3. Основы экспериментальных методов исследования радиоколлоидов
- •Глава 5
- •§ 1. Закономерности процессов соосаждения с изотопными носителями
- •§ 2. Основные области применения изотопных носителей
- •§ 3. Принцип действия и закономерности процессов соосаждения со специфическими носителями
- •§ 4 Факторы, влияющие на процесс соосаждения со специфическими носителями
- •§ 5. Особенности процессов соосаждения со специфическими носителями
- •§ 6. Сокристаллизация со специфическими носителями при отсутствии изоморфизма 1 рода
- •§ 7. Основы экспериментальных методов исследования процессов соосаждения со специфическими носителями
- •§ 8. Основные области применения специфических носителей
- •Глава 6
- •§ 1. Первичная адсорбция
- •§ 2. Вторичная обменная адсорбция
- •§ 3. Закономерности процесса соосаждения с неспецифическими носителями
- •§ 4. Соосаждение с неспецифическими носителями при образовании внутренне-адсорбционных систем
- •§ 5. Основы экспериментальных методов исследования процессов соосаждения с неспецифическими носителями
- •§ 6. Основные области применения неспецифических носителей
- •§ 7. Методы разграничения различных видов соосаждения
- •Глава 7
- •§ 1. Закономерности и классификация экстракционных процессов
- •§ 3. Практическое использование процессов экстракции
- •Глава 8
- •§ 1. Основные закономерности хроматографических процессов Ионообменная хроматография.
- •Распределительная хроматография.
- •См.: Егоров е. В., Макарова с. Б. Ионный обмен в радиохимии. М., Атомиздат, 1971. § 2. Основы экспериментальных методов хроматографического исследования
- •См.: Роберте т. Радиохроматография. М., Мир, 1981. § 3. Примеры практического использования хроматографических методов в радиохимии
- •Глава 9
- •§ 1. Закономерности электрохимических процессов
- •§ 2 Особенности поведения радиоактивных элементов (нуклидов) при электрохимических процессах
- •§ 3. Основы экспериментальных методов исследования электрохимических процессов
- •§ 4. Использование электрохимических процессов в радиохимии
- •2 Химия радиоактивных элементов
- •Глава 10
- •§ 1. Технеций
- •§ 2. Прометий
- •§ 3. Полоний
- •§ 4. Астат
- •§ 5. Радон
- •§ 6. Франций
- •§ 7. Радий
- •Глава 11
- •§ 1. История открытия актиния и актиноидов
- •§ 2. Важнейшие изотопы актиния и актиноидов, методы их получения и идентификации
- •§ 3. Физические свойства актиния и актиноидов
- •§ 4. Актиний
- •§ 5. Торий
- •§ 6. Протактиний
- •§ 7. Уран, нептуний, плутоний и америций
- •§ 8. Трайсамерициевые актиноиды
- •Глава 12
- •§ 1. История открытия
- •§ 2 Методы получения и идентификации
- •3 Химические последствия радиоактивного распада
- •Глава 13
- •§ 1. История открытия ядерной изомерии
- •§ 2. Особенности явления ядерной изомерии
- •§ 3. Химические последствия изомерных переходов
- •§ 4. Практическое использование химических последствий изомерного перехода
- •Глава 14
- •§ 1. Теоретические аспекты химических последствий --распада
- •§ 2. Экспериментальные методы исследования химических последствий --распада
- •§ 3. Практическое использование химических последствий --распада
3. Кинетическое поведение изотопных частиц
Кинетическое поведение изотопных частиц можно охарактеризовать отношением констант скоростей одинаковых реакций, происходящих с участием частиц различного изотопного состава*
Рассмотрим реакции между веществом AZ и изотопными частицами BX1 и ВХ2, протекающие в конкурентных условиях при постоянных температуре и давлении:
|
(I) |
где k1 и k2 — константы скоростей реакций (I) и (II). Отношение k1/k2 характеризует степень близости или различия кинетического поведения изотопных частиц.
Будем исходить из следующих положений теории абсолютных скоростей реакций:
1. Реакция протекает через образование активированного комплекса, который возникает в результате взаимодействия реагирующих частиц, характеризуется определенным относительным расположением атомов, энергией и ее распределением в комплексе. 2. Активированные комплексы находятся в равновесии с исходными веществами. 3. Процесс образования активированного комплекса и последующее его превращение не приводят к нарушению распределения частиц по энергиям. 4. Реакции необратимы (или далеки от состояния равновесия).
Рассмотрим равновесие между исходными продуктами и активированными комплексами:
|
(II) |
Выражения для констант равновесия этих процессов могут быть записаны следующим образом:
![]()
где [М1] и [М2] — равновесные концентрации активированных комплексов. Используя основное соотношение теории абсолютных скоростей реакций , где —скорость реакции, получаем выражения для скоростей реакций (Iа) и (IIа):
![]()
С другой стороны, учитывая, что
w1 = k1[AZ][BX1] и w2 = k2[AZ][BX2],
где k1 и k2—константы скоростей реакций (I) и (II), соответственно получаем
k1 = (kT/h)K![]() p1
и k2 = (kT/h)K
p2
p1
и k2 = (kT/h)K
p2
где —трансмиссионный коэффициент. Тогда
k1 / k2 = K p1 / K p2,
т.е. отношение констант скоростей двух однотипных реакций, протекающих с участием изотопных частиц, равно отношению констант равновесия процессов образования соответствующих активированных комплексов.
Перепишем соотношение (2.13) следующим образом:
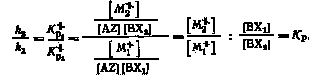
Это соотношение представляет собой выражение константы равновесия Кp реакции изотопного обмена:
M 1 + BX2 M 2 + BX1
Учитывая, что эквивалентом равновесных концентраций реагирующих частиц являются полные статистические суммы, отнесенные к единице объема, имеем
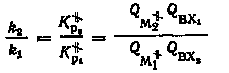
Заменяя полные статистические суммы произведением частных статистических сумм (см. § 2) и принимая во внимание, что число колебательных степеней свободы активированного комплекса на единицу меньше, чем устойчивой молекулы с тем же числом атомов, и равно 3n-7, получим
k2 / k1 = [1,L / 2,L] M [(u1 / u2)((1-e-u2) / (1-e-u1))e-E0 / RT] BX, |
(2.14) |
где 1,L, 2,L —частоты разрываемых связей в активированных комплексах;
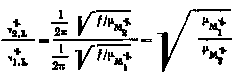
f—силовая постоянная; —приведенные массы систем: изотопный атом -— остаток активированного комплекса; 0 — разность нулевых колебательных энергий частиц BX1 и ВХ2.
Рассчитанные по формуле (2.14) кинетические изотопные эффекты (отношения констант скоростей при 298К) однотипных реакций частиц, включающих различные изотопы, приведены ниже:
Изотопы |
k1/k2 |
H/D |
18 |
H/T |
60 |
12C/14C |
1,5 |
31P/32P |
1,02 |
Как видно, отношение k1/k2 отличается от единицы лишь для реакций с участием атомов наиболее легких элементов.
Рассмотрение различных аспектов поведения изотопных частиц позволяет сделать следующие выводы.
1. Общехимические, термодинамические и кинетические свойства различных изотопов данного элемента практически идентичны. Исключение составляют лишь термодинамические и кинетические свойства самых легких элементов периодической системы (водород, гелий, литий, бор).
2. Свойства элемента могут быть изучены на основании исследования поведения любой совокупности его изотопов. Это особенно важно для радиоактивных элементов, изотопный состав которых носит динамический характер (ввиду неодинаковой скорости радиоактивного распада различных изотопов) и может изменяться во времени в процессе исследования.
См.: Меландер Л. Изотопные эффекты в скоростях химических реакции. М., Мир, 1964.