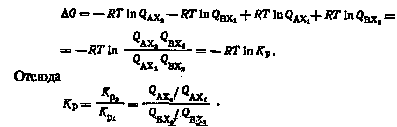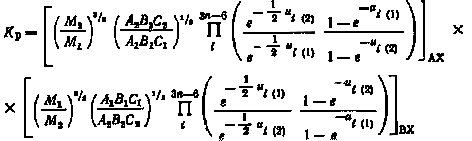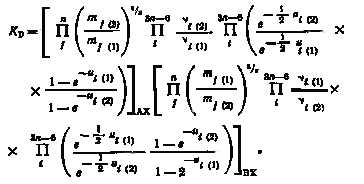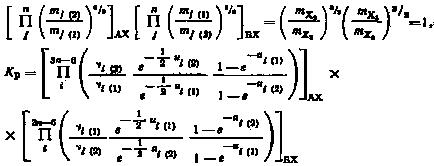- •В.Д.Нефедов е.Н.Текстер м.А.Торопова радиохимия
- •Глава 1
- •§ 1. Предмет радиохимии
- •§ 2. Краткий очерк истории развития радиохимии
- •§ 3. Особенности радиохимии
- •§ 4. Значение радиохимии
- •1 Общая радиохимия глава 2
- •§ 1. Общехимические свойства изотопных частиц
- •2. Термодинамическое поведение изотопных частиц
- •3. Кинетическое поведение изотопных частиц
- •Глава 3
- •§ 1. Классификация реакций изотопного обмена
- •§ 2. Причины протекания реакций изотопного обмена
- •3. Особенности реакций идеального изотопного обмена
- •§ 4. Основное уравнение кинетики реакций идеального изотопного обмена
- •§ 5. Основы экспериментальных методов исследования процессов изотопного обмена
- •Глава 4
- •§ 1. Состояние радиоактивных элементов [нуклидов] в жидкой фазе
- •§ 2. Процессы радиоколлоидообразования
- •§ 3. Основы экспериментальных методов исследования радиоколлоидов
- •Глава 5
- •§ 1. Закономерности процессов соосаждения с изотопными носителями
- •§ 2. Основные области применения изотопных носителей
- •§ 3. Принцип действия и закономерности процессов соосаждения со специфическими носителями
- •§ 4 Факторы, влияющие на процесс соосаждения со специфическими носителями
- •§ 5. Особенности процессов соосаждения со специфическими носителями
- •§ 6. Сокристаллизация со специфическими носителями при отсутствии изоморфизма 1 рода
- •§ 7. Основы экспериментальных методов исследования процессов соосаждения со специфическими носителями
- •§ 8. Основные области применения специфических носителей
- •Глава 6
- •§ 1. Первичная адсорбция
- •§ 2. Вторичная обменная адсорбция
- •§ 3. Закономерности процесса соосаждения с неспецифическими носителями
- •§ 4. Соосаждение с неспецифическими носителями при образовании внутренне-адсорбционных систем
- •§ 5. Основы экспериментальных методов исследования процессов соосаждения с неспецифическими носителями
- •§ 6. Основные области применения неспецифических носителей
- •§ 7. Методы разграничения различных видов соосаждения
- •Глава 7
- •§ 1. Закономерности и классификация экстракционных процессов
- •§ 3. Практическое использование процессов экстракции
- •Глава 8
- •§ 1. Основные закономерности хроматографических процессов Ионообменная хроматография.
- •Распределительная хроматография.
- •См.: Егоров е. В., Макарова с. Б. Ионный обмен в радиохимии. М., Атомиздат, 1971. § 2. Основы экспериментальных методов хроматографического исследования
- •См.: Роберте т. Радиохроматография. М., Мир, 1981. § 3. Примеры практического использования хроматографических методов в радиохимии
- •Глава 9
- •§ 1. Закономерности электрохимических процессов
- •§ 2 Особенности поведения радиоактивных элементов (нуклидов) при электрохимических процессах
- •§ 3. Основы экспериментальных методов исследования электрохимических процессов
- •§ 4. Использование электрохимических процессов в радиохимии
- •2 Химия радиоактивных элементов
- •Глава 10
- •§ 1. Технеций
- •§ 2. Прометий
- •§ 3. Полоний
- •§ 4. Астат
- •§ 5. Радон
- •§ 6. Франций
- •§ 7. Радий
- •Глава 11
- •§ 1. История открытия актиния и актиноидов
- •§ 2. Важнейшие изотопы актиния и актиноидов, методы их получения и идентификации
- •§ 3. Физические свойства актиния и актиноидов
- •§ 4. Актиний
- •§ 5. Торий
- •§ 6. Протактиний
- •§ 7. Уран, нептуний, плутоний и америций
- •§ 8. Трайсамерициевые актиноиды
- •Глава 12
- •§ 1. История открытия
- •§ 2 Методы получения и идентификации
- •3 Химические последствия радиоактивного распада
- •Глава 13
- •§ 1. История открытия ядерной изомерии
- •§ 2. Особенности явления ядерной изомерии
- •§ 3. Химические последствия изомерных переходов
- •§ 4. Практическое использование химических последствий изомерного перехода
- •Глава 14
- •§ 1. Теоретические аспекты химических последствий --распада
- •§ 2. Экспериментальные методы исследования химических последствий --распада
- •§ 3. Практическое использование химических последствий --распада
2. Термодинамическое поведение изотопных частиц
Термодинамическое поведение изотопных частиц можно охарактеризовать константами равновесия однотипных реакций, происходящих с их участием.
Рассмотрим реакцию изотопных частиц BX1 и ВХ2 с веществом AZ, происходящую в конкурентных условиях при постоянных давлении и температуре:
|
(I) |
Константы равновесия этих реакций выражаются соотношениями:
|
(II) |
Используя в качестве меры идентичности термодинамического поведения изотопных частиц отношение констант равновесия реакций (I) и (II), получим:

Ясно, что Кр—константа равновесия реакции
|
(III) |
Эта реакция является реакцией изотопного обмена (см. гл. 2) и состоит в перераспределении изотопов X1 и X2 между молекулами АХ и ВХ. Таким образом, для определения степени идентичности термодинамического поведения двух изотопных частиц BX1 и ВХ2 в реакции с третьим веществом AZ нет необходимости рассматривать каждую из этих реакций. Достаточно знать Кр реакции изотопного обмена между веществами AX1 и ВХ2.
Критерием идентичности термодинамического поведения изотопных частиц является равенство единице константы равновесия реакции (III).
Константу равновесия этой реакции можно определять как экспериментально, так и расчетным путем. Расчет Кр основан на использовании фундаментальных соотношений химической и статистической термодинамики:
где G —изменение стандартного изобарно-изотермического потенциала (свободной энергии Гиббса) реакции (III); Q—полная статистическая сумма по состояниям молекулы; G — определяется выражением
G = (niGi)кон - (niGi)нач
где ni—число молей i-го компонента, участвующих в реакции. В нашем случае
G = GAX2 + GBX1 + GAX1 + GBX2. |
(2.3) |
Значение Q в выражении (2.2) определяется соотношением
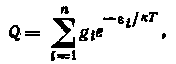
где i — энергия 1-го квантового уровня молекулы; к — постоянная Больцмана; gi—статистический вес i-ro энергетического уровня.
Суммирование распространяется на все возможные энергетические уровни.
На основании соотношений (2.1)—(2.3) для рассматриваемой системы
|
(2.4) |
Полные статистические суммы включают в себя их частные значения, связанные с различными видами движения. В общем случае отдельные виды движения в молекуле взаимосвязаны, однако с определенной степенью приближения их можно трактовать как независимые. Тогда сумма по состояниям молекулы может быть представлена в виде произведения частных статистических сумм:
Q = gie-i/kT = QпостQврQколебQэлQяд
где Qпост—статистическая сумма, связанная с поступательным движением:
![]()
где М — молекулярная масса; —постоянная Планка; V—объем системы; Qвр—вращательная статистическая сумма:
![]()
где А, В, С—главные моменты инерции частицы; S—число симметрии; Qколеб — статистическая сумма, связанная с колебательным движением:
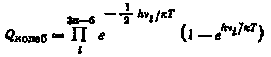
где n—число атомов в молекуле; i—частота колебания для i-го уровня; Qэл и Qяд—статистические суммы, связанные с электронным и ядерным движением.
Как видно из соотношения (2.4), константа равновесия Kp, характеризующая термодинамическое поведение изотопных молекул, определяется частным отношений полных статистических сумм однотипных изотопных молекул (АХ2 и AX1) и (ВХ2 и BX1). Для таких молекул электронные статистические суммы, числа симметрии, а также множители колебательных статистических сумм (за исключением множителей, относящихся к связям с изотопными атомами X1 и X2) одинаковы. Что касается множителей, относящихся к ядерным статистическим суммам, то они сокращаются в выражении для Кр, так как
Qяд(AX1)=Qяд(BX1) и Qяд(BX2)=Qяд(AX2).
Подставляя значения полных статистических сумм в выражение (2.4) для константы равновесия Кр, получим
|
(2.5) |
где ui=hvil(кТ). Это соотношение можно назвать первичным уравнением, определяющим термодинамическое поведение изотопных молекул. Наиболее трудно определить члены этого уравнения, связанные с вращательными статистическими суммами. Однако для изотопных молекул они могут быть исключены. Действительно, для изотопных молекул справедлива теорема Теллера—Редлиха:
|
(2.6) |
где M1 и М2 — молекулярные массы изотопных частиц AX1 и АХ2, содержащих различные изотопные атомы; A, В, С—моменты инерции изотопных частиц AX1 и AX2; mj(1) и mj(2)—массы атомов, входящих в состав изотопных частиц; i(1) и i(2) —частоты колебаний атомов в изотопных частицах AX1 и АХ2.
Подставляя выражение (2.6) в (2.5) получим
|
(2.7) |
Учитывая, что массы всех атомов, зa исключением в изотопных частицах совпадают, имеем:
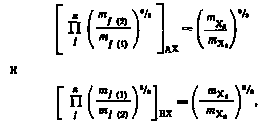
следовательно
|
(2.8) |
Поскольку замена одного изотопа другим в молекулах АХ и ВХ практически не сказывается на частотах колебаний всех связей, за исключением связей А—Х и В—X, то выражение (2.8) примет вид
|
(2.9) |
В выражении (2.9) произведение

можно представить в виде
e -(1/kT){(1/2 h2,AX + 1/2 h1,BX) - (1/2 h1,AX + 1/2 h2,BX)}. |
(2.10) |
При этом множитель, заключенный в фигурные скобки, является разностью нулевых колебательных энергий конечных и начальных продуктов реакции (III) (рис. 1).
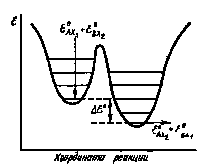 Рис.
1. Изменение нулевой колебательной
энергии для реакции (III)
Рис.
1. Изменение нулевой колебательной
энергии для реакции (III)
Как известно, колебательная энергия, отвечающая данному значению колебательного квантового числа, определяется выражением
= (1/2 + v)k,
где v—колебательное квантовое число; - основная частота, соответствующая переходу с нулевого колебательного уровня на уровень, отвечающий колебательному квантовому числу, равному 1. При = 0 в соответствует нулевой колебательной энергии (0) и равно 1/2 hv.
Таким образом, выражение (2.10) можно переписать следующим образом:
e -(1/kT){(0AX2 - 0BX1) - (0AX1 - 0BX2)} = e -(1/kT)(0кон - 0нач) = е -0/kT,
где 0 — разность нулевых колебательных энергий конечных и начальных продуктов, реакции (III). Умножая числитель и знаменатель показателя степени на число Авогадро, имеем:
e-0/kT = e -0/RT, |
(2.11) |
где E0 — разность нулевых колебательных энергий, отнесенных к молярным количествам конечных и исходных веществ. Подставляя (2.11) в (2.9), получим
|
(2.12) |
Таким образом, для расчета констант равновесия реакций с участием различных изотопных частиц достаточно знать лишь частоты колебаний связей А—X1, А—Х2 и В—X1, В—Х2.
Рассчитанные по уравнению (2.12) значения констант равновесия Кр (Т = 298 К) некоторых реакций изотопного обмена приведены ниже:
|
Kp |
AX1 + BX2
|
|
HOH + HT HOT + HH |
6,19 |
HOH + HD HOD + HH |
3,18 |
13CO2 + 12CO32- 12CO2 + 13CO32- |
1,016 |
79Br81Br + 79BrO-3 79Br2 + 81BrO-3 |
1,007 |
127I129I + 127IO-3 127I2 + 129IO-3 |
1,002 |
238UF6 + 235UF4 235UF6 + 238UF4 |
1,0001 |
Как видно, значения констант равновесия существенно отличаются от единицы лишь для изотопов водорода. Для углерода и более тяжелых элементов значения Кр практически равны 1.