- •В.Д.Нефедов е.Н.Текстер м.А.Торопова радиохимия
- •Глава 1
- •§ 1. Предмет радиохимии
- •§ 2. Краткий очерк истории развития радиохимии
- •§ 3. Особенности радиохимии
- •§ 4. Значение радиохимии
- •1 Общая радиохимия глава 2
- •§ 1. Общехимические свойства изотопных частиц
- •2. Термодинамическое поведение изотопных частиц
- •3. Кинетическое поведение изотопных частиц
- •Глава 3
- •§ 1. Классификация реакций изотопного обмена
- •§ 2. Причины протекания реакций изотопного обмена
- •3. Особенности реакций идеального изотопного обмена
- •§ 4. Основное уравнение кинетики реакций идеального изотопного обмена
- •§ 5. Основы экспериментальных методов исследования процессов изотопного обмена
- •Глава 4
- •§ 1. Состояние радиоактивных элементов [нуклидов] в жидкой фазе
- •§ 2. Процессы радиоколлоидообразования
- •§ 3. Основы экспериментальных методов исследования радиоколлоидов
- •Глава 5
- •§ 1. Закономерности процессов соосаждения с изотопными носителями
- •§ 2. Основные области применения изотопных носителей
- •§ 3. Принцип действия и закономерности процессов соосаждения со специфическими носителями
- •§ 4 Факторы, влияющие на процесс соосаждения со специфическими носителями
- •§ 5. Особенности процессов соосаждения со специфическими носителями
- •§ 6. Сокристаллизация со специфическими носителями при отсутствии изоморфизма 1 рода
- •§ 7. Основы экспериментальных методов исследования процессов соосаждения со специфическими носителями
- •§ 8. Основные области применения специфических носителей
- •Глава 6
- •§ 1. Первичная адсорбция
- •§ 2. Вторичная обменная адсорбция
- •§ 3. Закономерности процесса соосаждения с неспецифическими носителями
- •§ 4. Соосаждение с неспецифическими носителями при образовании внутренне-адсорбционных систем
- •§ 5. Основы экспериментальных методов исследования процессов соосаждения с неспецифическими носителями
- •§ 6. Основные области применения неспецифических носителей
- •§ 7. Методы разграничения различных видов соосаждения
- •Глава 7
- •§ 1. Закономерности и классификация экстракционных процессов
- •§ 3. Практическое использование процессов экстракции
- •Глава 8
- •§ 1. Основные закономерности хроматографических процессов Ионообменная хроматография.
- •Распределительная хроматография.
- •См.: Егоров е. В., Макарова с. Б. Ионный обмен в радиохимии. М., Атомиздат, 1971. § 2. Основы экспериментальных методов хроматографического исследования
- •См.: Роберте т. Радиохроматография. М., Мир, 1981. § 3. Примеры практического использования хроматографических методов в радиохимии
- •Глава 9
- •§ 1. Закономерности электрохимических процессов
- •§ 2 Особенности поведения радиоактивных элементов (нуклидов) при электрохимических процессах
- •§ 3. Основы экспериментальных методов исследования электрохимических процессов
- •§ 4. Использование электрохимических процессов в радиохимии
- •2 Химия радиоактивных элементов
- •Глава 10
- •§ 1. Технеций
- •§ 2. Прометий
- •§ 3. Полоний
- •§ 4. Астат
- •§ 5. Радон
- •§ 6. Франций
- •§ 7. Радий
- •Глава 11
- •§ 1. История открытия актиния и актиноидов
- •§ 2. Важнейшие изотопы актиния и актиноидов, методы их получения и идентификации
- •§ 3. Физические свойства актиния и актиноидов
- •§ 4. Актиний
- •§ 5. Торий
- •§ 6. Протактиний
- •§ 7. Уран, нептуний, плутоний и америций
- •§ 8. Трайсамерициевые актиноиды
- •Глава 12
- •§ 1. История открытия
- •§ 2 Методы получения и идентификации
- •3 Химические последствия радиоактивного распада
- •Глава 13
- •§ 1. История открытия ядерной изомерии
- •§ 2. Особенности явления ядерной изомерии
- •§ 3. Химические последствия изомерных переходов
- •§ 4. Практическое использование химических последствий изомерного перехода
- •Глава 14
- •§ 1. Теоретические аспекты химических последствий --распада
- •§ 2. Экспериментальные методы исследования химических последствий --распада
- •§ 3. Практическое использование химических последствий --распада
§ 3. Практическое использование химических последствий --распада
Из различных аспектов последствий --превращений атомов в составе молекулярных систем большой интерес представляет их использование для получения ранее неизвестных соединений (речь идет о химических формах, состав, структуру и возможность существования которых трудно предсказать на основании общих положений химии). Ниже будут рассмотрены примеры, иллюстрирующие возможности этого метода при получении новых химических соединений ксенона, полония, брома и технеция.
Синтез соединений ксенона. Идея об использовании метода --распада для получения соединений благородных газов была высказана сразу же после сообщения Н. Бартлетта о синтезе гексафторплатината ксенона.
Использованию метода --распада для синтеза соединений ксенона благоприятствовал ряд обстоятельств и прежде всего наличие нескольких цепочек превращений изотопов иода в радиоактивные изотопы ксенона с удобными для работы ядерно-физическими характеристиками. К таким цепочкам относятся:
131I
![]() 131mXe
131mXe
![]() ;
131I
;
131I
![]() Xe
Xe
![]() ;
135I
;
135I
![]() 135Xe
135Xe
![]() .
.
Для указанных цепочек превращений характерно то, что образование атомов ксенона в большинстве случаев не сопровождается возникновением короткоживущих возбужденных состояний ядер, переход которых в основное состояние осуществляется путем внутренней конверсии (см. § 1). Существенно и то, что --переходы в этих цепочках сопровождаются испусканием ядерных электронов сравнительно небольшой средней энергии.
Благоприятным фактором при изучении химических последствий --превращений атомов иода в составе различных соединений оказывается и то обстоятельство, что ксенон — стабильный элемент, и, следовательно, идентификация химических форм его во многих случаях может быть основана на сравнении поведения образующихся форм с поведением известных соединений ксенона.
Кислородные соединения. До последнего времени единственным путем получения известных кислородных соединении ксенона (ХеО3, ХеO4) был гидролиз высших фторидов (XeF4, XeF6). Попытки получить оксиды ксенона прямым путем, из элементов, не увенчались успехом. Исходя из свойств оксианионных форм иода и связи этих свойств со свойствами первичных молекулярных образований, следовало ожидать, что --распад иода в составе иодатов и периодатов приведет к возникновению соответствующих нейтральных кислородных форм ксенона. Происходящие при этом изменения можно представить с помощью схем:
I*O-3 XeO3; I*O-4 XeO4 XeO3 + 1/2O2
Вместе с тем если --распад иода происходит в составе иодид-иона, то в соответствии со схемой I* Хе0 образуется элементарный ксенон.
Установление факта образования химически связанного ксенона при процессах --распада 131I и 133I в составе иодатов и периодатов и
|
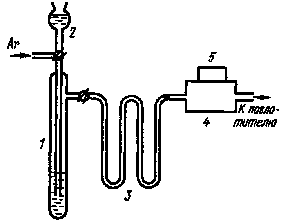
|
Рис. 43. Схема установки для определения выхода соединений ксенона: 1- барботер; 2 - разлагающий реагент; 3 - ловушки; 4 - проточная камера; 5 - детектор радиоактивности |
Рис. 44. Кривая выдувания элементарного ксенона, образующегося при --распаде 133I в составе: 1 - Li133I; 2 - Li3H2133IO6 |
определение выхода соответствующих химических форм основано на регистрации активности элементарного ксенона в газовом потоке (рис. 43). Суть метода состоит в следующем. Из одного и того же препарата радиоактивного иода с определенной массовой активностью готовят иодиды, иодаты и периодаты. Аликвотные количества этих соединений с одинаковым содержанием иода растворяют в воде и помещают в барботеры, которые герметизируются. Растворы выдерживают при определенной температуре в течение времени, необходимого для накопления максимального количества радиоактивного ксенона.
Как видно из рис. 44, количество свободного радиоактивного ксенона в случае иодида лития в несколько раз превышает количества свободного ксенона при накоплении его в составе периодатов. Это объясняется тем, что распад иода в иодид-ионе приводит к возникновению только элементарного ксенона, в то время как при распаде его в составе оксианионов большая часть ксенона оказывается в виде устойчивой в водных растворах нелетучей кислородсодержащей формы ксенона ХеО3. В случае --распада иода в составе иодатов она является непосредственным продуктом превращения. При --распаде иода в составе периодатов ХеО3 образуется в результате разложения малоустойчивого в водных растворах ХеО4. Наличие некоторого количества химически несвязанного ксенона объясняется распадом части первичных молекулярных образований в результате вторичных процессов, развивающихся в электронных оболочках дочерних атомов (см. гл. 14, § 1).
Выходы триоксида ксенона при --распаде различных радиоактивных изотопов иода в составе некоторых оксианионных форм иода (VII) и (V) при различных условиях накопления суммированы в табл. 12.
Как видно из приведенных результатов, процессы --распада изотопов иода в составе кислородных соединений могут быть с успехом использованы для получения триоксида ксенона, содержащего раз-
Т а б л и ц а 12. Выход XeO3 (%) при --распаде радиоактивных изотопов иода в составе кислородсодержащих форм иода |
||||
Материнское соединение иода |
Выход в условиях накопления |
|||
133Xe |
135Xe |
|||
кристалы |
раствор |
кристалы |
раствор |
|
NH4IO4 |
72±8 |
73±4 |
- |
72±1 |
KIO4 |
56±4 |
69±5 |
61±4 |
73±4 |
RbIO4 |
56±2 |
67±5 |
57±3 |
72±8 |
CsIO4 |
52±2 |
59±5 |
45±4 |
72±5 |
Li3H2IO6 |
87±4 |
89±5 |
88±3 |
73±3 |
Na3H2IO6 |
74±7 |
- |
- |
73±3 |
NaIO3 |
44±2 |
- |
- |
- |
личные радиоактивные изотопы этого элемента. Наиболее эффективным материнским соединением является о-периодат лития, --распад изотопов иода в составе которого приводит к максимальному выходу ХеО3. Существенно, что получающийся ХеО3 не содержит неактивных молекул триоксида ксенона, т. е. носителя.
Органические производные. Химические последствия --распада позволили впервые синтезировать органические соединения ксенона ониевого типа. Последние образуются при --распаде изотопов иода в составе ароматических производных с последующей стабилизацией первичных молекулярных ионов по схеме
C6H5133I
[C6H5133Xe]+
![]() C6H5XeX.
C6H5XeX.
Продукты распада радиоактивного иода накапливались в иодбензоле и его растворах в органических растворителях, а также в иодбензоле, нанесенном на кристаллы перхлората калия, борфторида калия и других солей, которые кристаллизовались из растворов кислот и содержали избыток соответствующих анионов. Указанные вещества помещали в барботеры, которые запаивали и выдерживали определенное время.
Факт образования соединений ксенона устанавливали путем сравнения активности химически несвязанного (свободного) ксенона, образующегося при --превращении радиоактивного иода в составе исследуемых систем, и активности ксенона, выделяемого из растворов KI. Как уже отмечалось, использование раствора KI в качестве репера основано на том, что весь образующийся при этом ксенон находится в свободном состоянии. В том и другом случае радиоактивный ксенон переводили в детектор радиоактивности с помощью газа-носителя (аргона) (см. рис. 43). Долю химически связанного ксенона определяли путем измерения активности свободного ксенона после разложения его соединений с помощью веществ, содержащих анионы, с которыми не способны сосуществовать ониевые катионы благородных газов (НС1, HI, КОН).
Ниже приведены результаты исследований по образованию фенилксенониевых производных при --распаде 133I в составе иодбензола, нанесенного на кристаллы солеи:
Соль-носитель |
Выход соединения ксенона, % |
KClO4 |
30±3 |
KB(C6H5)4 |
18±1 |
KBF4 |
8±1 |
KCl |
Не обнаружен |
Чистый иодбензол |
» » |
|
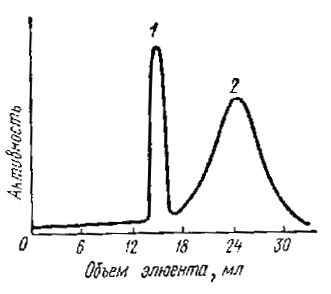
Рис. 45. Кривые элюирования катионов: 1 - фенилксенопия; 2 - дифенилиодония |
Синтез полонийорганических соединений. Процессы --распада висмута в составе различных органических производных этого элемента сыграли большую роль в развитии химии полонийорганических соединений. Это обусловлено, с одной стороны, наличием очень удобной цепочки превращений 210Bi 210Ро и, с другой стороны, богатой химией элементорганических соединений висмута. Важнейшие типы элементорганических соединений полония могут быть получены по следующим схемам:
[R2Bi]- R2Po |
[R2BiX2]- R2Po2 |
R3Bi
[R3Po]+
|
[RBiX3]- RPoX3 |
где R — ароматические радикалы; Х — галоген. Кроме того, большое число полонийорганических соединений получается в результате неглубокой фрагментации первичных молекулярных ионов, образующихся при --распаде 210Bi в составе органических производных висмута (V). Например,
R3BiX2 [R3PoX2]+ R2PoX2 + R+
Выход полонийорганических соединении существенно завист от характера ароматического радикала, наличия в нем заместителей. Ниже показано влияние положения заместителя в бензольном кольце на выход толильных производных R3PoX:
Материнское вещество |
Выход R3PoX, % |
(n-C7H8)3Bi |
68 |
(o-C7H8)3Bi |
67 |
(м-C7H8)3Bi |
39 |
(C6H5)3Bi |
61 |
Зависимость выхода полонийорганических соединений от условий накопления показана в табл. 13.
Т а б л и ц а 13. Зависимость выхода R3PoX, образующегося при --распаде 210Bi в составе R3Bi, от характера ароматического радикала и условий накопления |
||||
Условия накопления |
Выход R3PoX, % |
|||
(C6H3)3PoX |
(nCH3OC6H4)3PoX |
(nC2H5OC6H4)3PoX |
|
|
Раствор в бензоле |
78 |
95 |
94 |
|
Кристалы |
63 |
74 |
70 |
|
Раствор в гелтане |
59 |
- |
- |
|
Раствор в ацетоне |
- |
61 |
59 |
|
Раствор в триэтила- мине |
48 |
35 |
34 |
|
Синтез соединений брома (VII). Хорошо известны устойчивые кислородсодержащие химические формы, в которых хлор и иод находятся в высших степенях окисления (перхлораты, периодаты). Что же касается перброматов, то долгое время их причисляли к несуществующим соединениям.
Впервые успешный синтез иона пербромата был осуществлен в 1968 г. с помощью ядерно-химического метода. Основой его явилось --превращение 83Se в составе селенат-иона:
83SeO2-4
![]() 83BrO-4
83BrO-4
![]() .
.
Изотоп 83Se получался облучением медленными нейтронами обогащенного препарата металлического селена. Селенат-ион, содержащий 83Se, получался путем растворения облученного элементарного селена в азотной кислоте и последующего окисления селенита озоном в щелочной среде. Раствор селената выдерживался до полного распада материнского изотопа.
В основу идентификации иона пербромата был положен метод изоморфной сокристаллизации его с перхлоратом рубидия. Выбор в качестве специфического носителя перхлората объяснялся идентичностью пространственного строения, зарядового состояния и близостью радиусов анионов ВгО-4 и С1O-4. Результаты этих исследований вновь поставили на повестку дня химический синтез перброматов. Эту задачу удалось решить путем окисления бромата водным раствором XeF2.
Синтез соединений технеция. Переход 99Mо 99mTc очень благоприятен для получения разнообразных соединений технеция, поскольку процесс --распада в данном случае не осложнен внутренней конверсией и эффектом Оже.
Исходя из правила Нефедова, можно было ожидать, что основной и устойчивой формой технеция, образующейся непосредственно при --распаде молибдена в составе гексакарбонила этого элемента, должен быть катион Тс(СО)+6, изоэлектронный исходной молекуле Мо(СО)6. Этот катион, обладающий электронной структурой благородных газов, родствен известным однозарядным сложным катионам типа иона аммония и должен образовывать соли, по свойствам напоминающие соли указанных катионов. Катионная природа изучаемой формы технеция была установлена в результате исследований поведения этой формы при электрофорезе и ионообменных процессах.
Аналогичным образом при --распаде 99Мо в составе циклопентадиенильных и хелатных производных молибдена были получены соответствующие соединения технеция. Многие из них впоследствии были синтезированы обычными химическими методами.