- •В.Д.Нефедов е.Н.Текстер м.А.Торопова радиохимия
- •Глава 1
- •§ 1. Предмет радиохимии
- •§ 2. Краткий очерк истории развития радиохимии
- •§ 3. Особенности радиохимии
- •§ 4. Значение радиохимии
- •1 Общая радиохимия глава 2
- •§ 1. Общехимические свойства изотопных частиц
- •2. Термодинамическое поведение изотопных частиц
- •3. Кинетическое поведение изотопных частиц
- •Глава 3
- •§ 1. Классификация реакций изотопного обмена
- •§ 2. Причины протекания реакций изотопного обмена
- •3. Особенности реакций идеального изотопного обмена
- •§ 4. Основное уравнение кинетики реакций идеального изотопного обмена
- •§ 5. Основы экспериментальных методов исследования процессов изотопного обмена
- •Глава 4
- •§ 1. Состояние радиоактивных элементов [нуклидов] в жидкой фазе
- •§ 2. Процессы радиоколлоидообразования
- •§ 3. Основы экспериментальных методов исследования радиоколлоидов
- •Глава 5
- •§ 1. Закономерности процессов соосаждения с изотопными носителями
- •§ 2. Основные области применения изотопных носителей
- •§ 3. Принцип действия и закономерности процессов соосаждения со специфическими носителями
- •§ 4 Факторы, влияющие на процесс соосаждения со специфическими носителями
- •§ 5. Особенности процессов соосаждения со специфическими носителями
- •§ 6. Сокристаллизация со специфическими носителями при отсутствии изоморфизма 1 рода
- •§ 7. Основы экспериментальных методов исследования процессов соосаждения со специфическими носителями
- •§ 8. Основные области применения специфических носителей
- •Глава 6
- •§ 1. Первичная адсорбция
- •§ 2. Вторичная обменная адсорбция
- •§ 3. Закономерности процесса соосаждения с неспецифическими носителями
- •§ 4. Соосаждение с неспецифическими носителями при образовании внутренне-адсорбционных систем
- •§ 5. Основы экспериментальных методов исследования процессов соосаждения с неспецифическими носителями
- •§ 6. Основные области применения неспецифических носителей
- •§ 7. Методы разграничения различных видов соосаждения
- •Глава 7
- •§ 1. Закономерности и классификация экстракционных процессов
- •§ 3. Практическое использование процессов экстракции
- •Глава 8
- •§ 1. Основные закономерности хроматографических процессов Ионообменная хроматография.
- •Распределительная хроматография.
- •См.: Егоров е. В., Макарова с. Б. Ионный обмен в радиохимии. М., Атомиздат, 1971. § 2. Основы экспериментальных методов хроматографического исследования
- •См.: Роберте т. Радиохроматография. М., Мир, 1981. § 3. Примеры практического использования хроматографических методов в радиохимии
- •Глава 9
- •§ 1. Закономерности электрохимических процессов
- •§ 2 Особенности поведения радиоактивных элементов (нуклидов) при электрохимических процессах
- •§ 3. Основы экспериментальных методов исследования электрохимических процессов
- •§ 4. Использование электрохимических процессов в радиохимии
- •2 Химия радиоактивных элементов
- •Глава 10
- •§ 1. Технеций
- •§ 2. Прометий
- •§ 3. Полоний
- •§ 4. Астат
- •§ 5. Радон
- •§ 6. Франций
- •§ 7. Радий
- •Глава 11
- •§ 1. История открытия актиния и актиноидов
- •§ 2. Важнейшие изотопы актиния и актиноидов, методы их получения и идентификации
- •§ 3. Физические свойства актиния и актиноидов
- •§ 4. Актиний
- •§ 5. Торий
- •§ 6. Протактиний
- •§ 7. Уран, нептуний, плутоний и америций
- •§ 8. Трайсамерициевые актиноиды
- •Глава 12
- •§ 1. История открытия
- •§ 2 Методы получения и идентификации
- •3 Химические последствия радиоактивного распада
- •Глава 13
- •§ 1. История открытия ядерной изомерии
- •§ 2. Особенности явления ядерной изомерии
- •§ 3. Химические последствия изомерных переходов
- •§ 4. Практическое использование химических последствий изомерного перехода
- •Глава 14
- •§ 1. Теоретические аспекты химических последствий --распада
- •§ 2. Экспериментальные методы исследования химических последствий --распада
- •§ 3. Практическое использование химических последствий --распада
Глава 14
ХИМИЧЕСКИЕ ПОСЛЕДСТВИЯ ПРИ ПРОЦЕССАХ --РАСПАДА
В общем случае распад включает в себя три типа превращений: --распад, +-распад и электронный захват. В данной главе рассматриваются лишь химические последствия --распада, которые представляют наибольший интерес с точки зрения химии.
--распад— наиболее распространенный вид радиоактивных превращений. Из общего числа радиоактивных ядер (~1700) более 1200 испытывают --распад.
Химические изменения при --распаде атомов в составе молекулярных систем являются итогом ядерных, атомных и молекулярных процессов.
В отличие от процессов, происходящих при распаде изомерных состояний ядер, большая часть ядерных переходов при процессах --распада не приводит к разрушению дочерней молекулярной системы (системы, которая возникает в результате замены ядра материнского атома ядром атома соседнего элемента).
Это связано со способностью электронных оболочек материнских атомов «приспосабливаться» к новому заряду ядра дочернего атома. Общую картину процессов, происходящих при --распаде атомов в составе молекул, можно представить следующим образом. Первичным процессом является превращение нуклонов в составе ядра и эмиссия ядерного электрона и нейтрино. Следствием этого является изменение химической природы атома и его зарядового состояния. Если материнский атом находится в составе молекулы, то результатом этих процессов будет возникновение так называемых первичных молекулярных образований*. Остановимся на каждом из перечисленных процессов и их вкладе в общую картину изменений.
§ 1. Теоретические аспекты химических последствий --распада
Первичные молекулярные образования и их особенности. В соответствии с законами сохранения энергии и спина процессы, происходящие при --превращениях, можно представить с помощью следующей схемы:
10n
11p + e- +
|
(I) |
где 10n и 11р — нейтрон и протон; е- — электрон; — антинейтрино. Итогом превращений, описываемых схемой, является изменение нуклонного состава и заряда ядра в соответствии с законом сдвигам
AZX AZ+1X + e- + + Eрасп.
Таким образом, результатом --распада является изменение заряда (природы) ядра, т. е. образование ядра нового элемента, находящегося в периодической системе на одну клетку правее по отношению к атому материнского элемента. Этот процесс происходит за время 10-21 — 10-22 с (время выхода ядерного электрона за пределы ядра). Последующий уход ядерного электрона за пределы электронных оболочек атома (это происходит за время порядка 10-18 с) приводит к изменению зарядового состояния атома и молекулярной системы в целом.
Поскольку процессы --распада сопровождаются увеличением числа протонов в ядре на единицу, а электронная оболочка наследуется от материнского атома, то в ней возникает дефицит электронов по отношению к новому ядру. Таким оборазом, зарядовые состояния дочернего атома и молекулярной системы, включающей этот атом, увеличиваются на единицу (+1). Если молекулярную систему представить в виде [AZXYn]q, где AZХ — атом, испытывающий --распад, Yn — лиганд, a q — зарядовое состояние молекулярной системы, то состав и зарядовое состояние первичного молекулярного образования определится общей схемой
[AZXYn]q [AZ+1XYn]q+1 |
(II) |
Например,
35SO2-4 35ClO-4; 133IO-3 133XeO3; 14CH4 14NH+4
Одной из характерных особенностей первичных молекулярных образований является их детальная изоэлектронность исходной молекулярной системе (совпадение общего числа электронов и их характера)**. Эта особенность вытекает из того, что электронные структуры первичных молекулярных образований наследуются ими от исходных молекулярных систем. Так, электронная структура метана полностью наследуется ионом аммония и, наоборот, электронная структура аммония сохраняется в метане, возникающем при позитронном распаде атома азота в составе этих ионов:
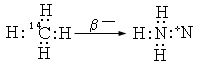
Идентичность электронных и пространственных структур сохраняется и в том случае, когда имеют место несколько последовательных --превращений:
BH-4 CH4 NH+4
Все члены указанных цепочек имеют тетраэдрическую структуру.
Совершенно очевидной особенностью является изолигандность первичных молекулярных образований и исходной молекулы, т. е. полная идентичность этих структур в отношении числа и природы лигандов.
Следующим важным вопросом является взаимосвязь между устойчивостью исходных молекулярных систем и первичных молекулярных образований.
Остановимся на вопросе
об энергии связи двух изоэлектронных
частиц (исходной молекулы и первичного
молекулярного образования). Под энергией
связи в данном случае следует понимать
энергию гомолитического разрушения
связи центральный атом — лиганд в
исходной молекуле и в первичном
молекулярном образовании. Так, для
цепочки
![]()
NH+4 разрыв связей С—Н и N—Н
должен происходить по схемам:
NH+4 разрыв связей С—Н и N—Н
должен происходить по схемам:
СН4 СН3 + Н; NH+4 NH+3 + H.
Эти пути распада изоэлектронных частиц приводят к образованию фрагментов, которые также являются изоэлектронными.
Энергии связи в исходных молекулах, как правило, табулированы. Оценка энергии связи в первичных молекулярных образованиях может быть произведена различными методами: с помощью квантово-химических расчетов, расчетов, основанных на использовании термохимических данных, а также с помощью полуэмпирических методов.
Расчет энергии связи квантово-химическими методами для большинства многоатомных частиц очень сложен, трудно осуществим и далеко не всегда приводит к надежным результатам. Большего внимания заслуживают методы, основанные на экспериментальных данных. Для гидридных молекул общей формулы AZХНn, из которых возникают изоэлектронные молекулярные ионы [AZ+1XHn]+, расчет энергии связи может быть выполнен на основании данных по сродству к протону. Для таких форм можно написать следующие термохимические уравнения:
[AZ+1XHn]+
|
(III) |
[AZ+1XHn]+
|
(IV) |
где Еp—энергия сродства [AZ+1XHn-1] к протону; ЕD—энергия диссоциации первичного молекулярного иона на фрагменты, изоэлектронныe тем, которые возникают при гомолитическом расщеплении связи в исходной молекуле. Вычитая (IV) из (III), получаем
Ep - ED = [AZ+1XHn-1] + H+ - [AZ+1XHn-1]+ - H
или
ED = Ep - [AZ+1XHn-1]+ + [AZ+1XHn-1]+ - H+ + H
Разность [AZ+1XHn-1]+ — [AZ+1XHn-1] представляет собой потенциал ионизации [AZ+1XHn-1]; [H+ H] - потенциал ионизации атома водорода. Поэтому нужно записать ED = Ep + IAZ+1XHn-1 - IH. Для случая 14CH4 NH+4 имеем
NH+4 NH3 + H+ NH+4 NH+3 + H
![]()
ED = Ep + INH3 - IH = 9,0 + 10,1 - 13,6 = 5,5 эВ.
Поскольку энергия отрыва атомов водорода от нейтральной молекулы метана составляет 4,5 эВ, то разность энергий связи в исходной молекуле и первичном молекулярном ионе = ECH4 — ENH+4 = -1 эВ.
Это означает, что энергия связи N—Н в ионе аммония на 1 эВ больше, чем в изоэлектронной с ним молекуле метана. Аналогичные расчеты, выполненные для изоэлектронных гидридных пар молекула — ион, включающих элементы IV—V, V—VI и VI—VII групп периодической системы, показывают, что во всех рассмотренных цепочках --превращений наблюдается образование молекулярного иона, связь в котором оказывается более прочной, чем в материнской молекуле. К сожалению, использование этого метода для соединений, в которых атом, претерпевающий --распад, связан с другими лигандами (например, элементорганических форм), крайне ограничено вследствие малочисленности данных по сродству органических катионов к соответствующим производным дочернего элемента.
Более общим методом оценки энергии связи в рассматриваемых изоэлектронных частицах является приближенный полуэмпирический метод, основанный на идее о неизменности ковалентной составляющей в исходной молекуле и первичном молекулярном образовании. Известно, что энергия химической связи может быть представлена как сумма ковалентной и ионной составляющих. Можно считать, что ковалентная составляющая энергии связи в исходной молекуле и первичном молекулярном ионе остается неизменной. Тогда различие в энергиях связи в рассматриваемых изоэлектронных частицах определится разностью ионных составляющих этих связей. Ионная составляющая, в свою очередь, зависит от разности электроотрицательностей атомов элементов, участвующих в образовании данной связи.
--pаспад означает возрастание электроотрицательности дочернего атома за счет перемещения его вправо по периоду и образования на нем формального положительного заряда (+1). Если в исходной молекуле превращающийся атом был связям с лигандами, имеющими меньшую или равную с ним электроотрицательность, то энергия связи в первичном молекулярном образовании окажется выше, чем в исходной молекуле. В случае более электроотрицательных лигандов имеет место некоторое уменьшение энергии связи по сравнению с исходной молекулой, но оно составляет лишь небольшую часть от первоначальной энергии связи. Это наряду с многочисленными экспериментальными данными по химическим последствиям --распада позволяет сформулировать следующее правило:
если имеется устойчивая (отрицательно заряженная или нейтральная) исходная молекулярная система, в которой распадающийся атом связан ковалентными связями, то --превращение этого атома приводит к новой, также устойчивой молекулярной системе (правило В. Д. Нефедова).
Причины возбуждения и условия сохранения первичных молекулярных образований. При рассмотрении свойств первичных молекулярных образований мы отвлекались от ряда явлений, которые сопровождают --превращения атомов и оказывают влияние на энергетическое состояние и поведение дочерних образований. Эти процессы в общем случае являются результатом радиоактивной отдачи при эмиссии --частицы и антинейтрино и изменений в электронных оболочках дочерних атомов, вызванных внезапным изменением заряда ядра.
Общая энергия --распада определяется из соотношения
Е-расп = [M(Z, A) - M(Z+l, А) - m ] c2 - E*,
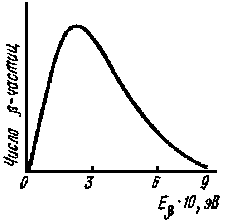
где Е* — энергия возбуждения дочернего ядра. Распределение --частиц по энергии для разрешенных --переходов*** имеет вид
N(Е) = k2f (E, Z) E (E2 - 1)Ѕ(E0 - E)2, где N(E)— вероятность испускания --частиц с данной энергией; k2 — постоянная, не зависящая от энергии; f(E, Z) — функция, зависящая от заряда ядра и энергии --частиц; Е0 — максимальная энергия --частиц.
|
Рис. 39. Спектр --частиц. |
Как известно, импульс нейтрино Р и импульс --частицы выражаются соотношениями
Р =
|
(15.1) |
Р = m0V, |
(15.2) |
где Е — энергия нейтрино; me и V — масса и скорость --частицы. Энергия ядра отдачи ЕM может быть вычислена из соотношения
![]() где
Р — суммарный импульс, получаемый ядром
при одновременной эмиссии --частицы
и нейтрино; М и V—масса и скорость ядра
отдачи.
где
Р — суммарный импульс, получаемый ядром
при одновременной эмиссии --частицы
и нейтрино; М и V—масса и скорость ядра
отдачи.
Поскольку
P2 = P2 + P2 + 2PP cos, |
(15.4) |
то
|
(15.5) |
где — угол между направлениями --частицы и нейтрино. Значение импульса --частицы может быть найдено из уравнения (15.2) с учетом соотношений
E = (m - m0)c2 |
(15.6) |
и
|
(15.7) |
где E — энергия --частицы; m0 — масса покоя --частицы.
Из уравнений (15.6) и (15.7) можно определить значение скорости и массы --частицы:
|
(15.8) |
|
(15.9) |
Подставляя значение m из уравнения (15.8) в уравнение (15.9), получаем
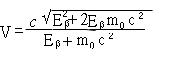
Откуда
|
(15.10) |
Теперь энергию ядра отдачи можно выразить через энергии -частиц и антинейтрино следующим образом:****
EM(эВ) =
|
(15.11) |
Подавляющее большинство искусственных радиоактивных изотопов, представляющих интерес с точки зрения химических последствий их распада, испускают --частицы с максимальной энергией, меньшей 1 МэВ. В этих случаях максимальная энергия атомов отдачи характеризуется долями и единицами электронвольта (за исключением изотопов наиболее легких элементов).
Следует иметь в виду, что не вся энергия отдачи, получаемая дочерним атомом, находящимся в составе молекулярного иона, расходуется на нарушение химической связи. Действительно, вначале энергия отдачи сосредоточена на атоме, испустившем --частицу и нейтрино. Однако, поскольку атом является составной частью молекулы, то при движении он будет увлекать всю молекулу. Таким образом, некоторая часть энергии будет передана молекуле как целому. Так как атом отдачи продолжает двигаться относительно остальной части молекулы, расстояние между ними увеличивается (связь «растягивается»), при этом часть кинетической энергии отдачи переходит в энергию возбуждения молекулы.
Если скорости атома отдачи и остальной части молекулы сравняются до того, как произойдет разрыв химической связи, то энергия отдачи, расходуемая на ее разрыв, будет максимальной. Если ЕB — внутренняя энергия возбуждения (сумма энергий колебательного к вращательного движений, которая может расходоваться на нарушение химической связи), а Е — энергия поступательного движения молекулы, то
ЕМ = ЕВ + E и ЕВ = ЕМ — Е.
Таким образом,
EB =[EМ - (M+MR)V2 /2, где МR — масса остатка молекулы; М — масса атома отдачи, V — скорость поступательного движения молекулы.
По закону сохранения импульса MV = (М + МR)VR, откуда
V= MV/(M+MR), где V — скорость поступательного движения атома отдачи. Подставляя найденное значение V в выражение для ЕВ, получаем
EB = EM -
![]() =
=
![]() .
.
Таким образом, доля кинетической энергии атома отдачи, расходуемой на внутреннее возбуждение молекулы, а следовательно, и на нарушение связи, определяется отношением массы остатка молекулы к массе молекулы:
f = |
(15.12) |
Поскольку значение f меньше единицы, то этот фактор уменьшает влияние радиоактивной отдачи на разрушение первичных молекулярных ионов. Учитывая, что для большей части молекул энергия химической связи составляет 5—10 эВ, и резюмируя все сказанное выше, можно прийти к заключению, что радиоактивная отдача оказывает лишь незначительное влияние на разрушение первичных молекулярных образований, возникающих при процессах --распада.
Основной причиной возбуждения и ионизации дочерних атомов, образующихся при процессах --распада, является так называемый эффект встряски. Этот эффект состоит в переходе электрона с основного уровня материнского атома на возбужденный уровень дочернего или в состояние континуума в результате внезапного изменения заряда ядра. При этом электроны дочернего атома мгновенно оказываются в поле ядра с зарядом, большим на единицу. Таким образом, возникает несоответствие между состоянием электронных оболочек, унаследованных от материнского атома, и новым зарядом ядра. Непосредственным результатом этого является возбуждение и ионизация электронных оболочек дочернего атома.
Расчеты вероятностей возбуждения и ионизации атомов при процессах --распада основываются на теории внезапного возмущения. Согласно этой теории вероятность перехода электрона в возбужденное состояние или удаление его из электронной оболочки (Pif) определяются квадратом интеграла перекрывания волновой функции основного электронного состояния материнского атома i(Z) и волновой функции конечного состояния дочернего иона *f(Z + 1):
Pif = P[(nl)(n'l)] = nl (Z)*n'l(Z+1) d2, где n' и n — главные квантовые числа оболочек материнского и дочернего атомов, между которыми происходят переходы; d — элемент объема.
Обозначим через ps = |i (Z) i(Z + 1) d|2 вероятность того, что электрон останется на своей первоначальной орбите, а через (ps)m — вероятность того, что все m электронов останутся на той же орбите. Тогда вероятность того, что один или несколько из m электронов покинут оболочку, выразится соотношением
Рif = 1-(Ps)m.
В свою очередь, Рif представляет собой сумму вероятностей перехода на дискретный связанный уровень (Р) и в континуум (Рc) При этом необходимо исключить, в соответствии с принципом Паули, переходы на заполненные электронные уровни (Рv). Тогда вероятность «встряски» электронов данной оболочки определится выражением
Рif = РI + Pc - mРv = 1 - (Рs)m - mPv.
Например, вероятность «встряски» 1s-электронов атома натрия, образующегося в результате --распада атома неона, равна
Pif = 1 - [1s(Ne) 1s(Na+) d2]2 - 21s(Ne) 2s(Na+) d2.
Почти все расчеты вероятностей встряски выполнены с использованием водородоподобного приближения, которое позволяет получить следующее выражение для вероятности перехода Рif:
Рif = aZ2-эфф + bZ3-эфф + cZ4-эфф + ..., где Zэфф — эффективный заряд ядра в отношении данных электронов. Для оценки этой вероятности обычно ограничиваются первым членом и тогда считают, что
Рif
|
(15.13) |
В этом выражении an,l —константа для данной оболочки, численное значение которой возрастает от K к L, М и т. д. оболочкам.
Выражение (15.13) может быть использовано также для оценки вероятности ионизации определенных электронных оболочек атомов с различными порядковыми номерами. Очевидно, что эффективный заряд ядра в отношении электронов данной оболочки будет увеличиваться с ростом Z и вероятность ионизации данной оболочки будет уменьшаться. Указанные зависимости иллюстрируются рис. 40.
Выражение (15.13) позволяет достаточно точно оценить вероятность ионизации за счет эффекта «встряски». Из этого выражения следует, что для данного атома вероятность ионизации электронных оболочек возрастает с увеличением их главного квантового числа. Это объясняется тем, что при переходе к более удаленным от ядра оболочкам an,l возрастает, a Zэфф уменьшается за счет возрастающего экранирования заряда ядра внутренними электронами. Поэтому вероятность ионизации внутренних оболочек средних и тяжелых атомов достаточно мала, и вкладом этих процессов в общую картину ионизации электронных оболочек можно пренебречь.
Необходимо отметить принципиальное различие между двукратно заряженными ионами, образованными в результате встряски электронов внутренних и внешних электронных оболочек. В первом случае, как было показано ранее, в электронных оболочках развиваются последующие процессы, приводящие к возникновению более высоких
|
|
Рис. 40. Зависимость вероятности встряски от порядкового номера элемента |
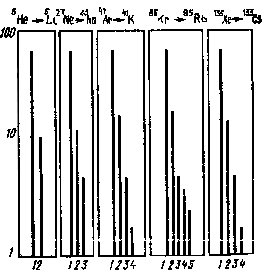
Рис. 41. Спектр зарядов ионов, образующихся в результате --распада атомов благородных газов |
зарядовых состояний атомов. Во втором случае зарядовое состояние +2 сохраняется.
Результаты теоретических и экспериментальных исследований позволяют следующим образом представить общую картину возбуждения и ионизации атомов при процессах --распада: 1) выход однозарядных ионов составляет 80—90%, причем некоторая часть из них оказывается в возбужденном состоянии (эти данные в равной мере относятся как к свободному атому, так и к атому, являющемуся частью молекулярной системы); 2) выход двукратно заряженных ионов составляет 10—15%; 3) выход ионов с зарядом, большим двух, не превышает 5%.
В качестве иллюстрации на рис. 41 приведены спектры зарядовых состояний атомов щелочных элементов, образующихся в результате --распада изотопов неона, аргона, криптона и ксенона.
С точки зрения использования процессов --распада для получения новых молекулярных образований представляют интерес некоторые моменты, касающиеся изменений вероятности ионизации вследствие эффекта «встряски» в пределах периодов и, групп периодической системы. Суммарная вероятность возбуждения и ионизации внутри периода уменьшается с увеличением Z, т. е. при переходе от электроположительных к электроотрицательным элементам. Это связано с увеличением эффективного заряда ядра внутри периода в указанном направлении. Подобная закономерность в изменении вероятности возбуждения и ионизации открывает широкие возможности получения новых молекулярных форм элементов, находящихся в правой части периодов (IV—VIII групп) и способных образовывать соединения с ковалентной связью.
Рассмотрим поведение первичных молекулярных образований, возникающих при процессах --распада атомов в составе устойчивых молекулярных систем. Из правила Нефедова следует, что в этом случае первичные молекулярные ионы, находящиеся в основном энергетическом состоянии, также устойчивы. Однако часть таких образований находится в состоянии электронного и вибрационного возбуждения. С хорошим приближением можно считать, что причиной электронного возбуждения является эффект «встряски», а причиной вибрационного возбуждения — радиоактивная отдача при эмиссии --частиц и нейтрино.
Ввиду независимости электронного и вибрационного возбуждений первичного молекулярного образования вероятность перехода из основного состояния А исходной молекулы в состояние В первичного молекулярного иона определяется произведением
РAB = P Pab, |
(15.14) |
где Р — вероятность перехода из электронного состояния к в электронное состояние ; Рab — вероятность перехода из вибрационного состояния а в вибрационное состояние b.
Сохранение первичного молекулярного образования имеет место в том случае, когда оно оказывается в основном энергетическом состоянии, и энергия вибрационного возбуждения не превышает энергии наиболее слабой химической связи. Тогда вероятность сохранения первичного молекулярного образования определяется соотношением (15.14), в котором Р —вероятность возникновения при --распаде первичного молекулярного образования на основных электронных уровнях; Рab — вероятность возникновения при --распаде первичного молекулярного образования на связанных возбужденных вибрационных уровнях. Р рассчитывается на основании теории внезапного возмущения. При этом предполагается, что встряска электронных оболочек дочернего атома происходит так же, как и в случае --распада свободного атома. Рab рассчитывается из спектра отдачи как доля атомов отдачи, имеющих энергию, меньшую энергии наименее прочной химической связи. Данное значение энергии определяется из соотношения ЕD — EMf [f — см. уравнение (15.12)]; ED — энергия наименее прочной химической связи.
Рассчитаем в качестве примера выход первичных молекулярных ионов (ионов пиридония), образующихся при --распале атомов 14С в состяве бензола:
14C6H6 [C5NH6]+.
Прежде всего необходимо оценить значение энергии, отвечающей наименее эндотермичному процессу разрушения иона пиридония. Наиболее вероятным путем распада первичного молекулярного иона является оаспал по схеме
[C5NH6]+ [C5NH5]+ + H+
Для этого пути распада ED = 4,6 эВ. Поскольку для иона пиридония f = 80/(14+80) = 0,827, то энергия атома отдачи, обеспечивающая разрыв наименее прочной химической связи в ионе пиридония, равна ЕM = ED/ f = 4,6/0,827 = 5,56 В. Из спектра атомов отдачи, образующихся при --распаде 14С, и значения ЕM следует, что вероятность получения первичного молекулярного иона с вибрационной энергией, меньшей 5,56 эВ, составляет 0,944.
Расчет вероятности возникновения первичных молекулярных образований в основных энергетических состояниях дает значение 0,646. Таким образом, вероятность образования электронно-невозбужденного иона пиридония на связанных вибрационных уровнях РAB = 0,944 - 0,646 = 0,609. Это значение достаточно хорошо совпадает с экспериментально найденными значениями выхода пиридина. Выход пиридина в данном случае отвечает выходу иона пиридония, поскольку пиридин может возникать лишь в результате депротонирования этого иона.
Все теоретические аспекты процессов --распада в составе молекулярных систем рассматривались для изолированных молекул. На практике --распад происходит в составе молекул, являющихся частью конденсированных фаз (ионные и молекулярные кристаллы, растворы). Естественно, что в этом случае судьба первичных молекулярных образований определяется последующими процессами их стабилизации в результате взаимодействия со средой. Например, --распад радиоактивного изотопа иода в составе пентафторида иода приводит к возникновению устойчивого катиона XeF+5 по схеме 131IF5 131XeF+5.
Если IF5 находится в растворе HF + SbF5, то в результате взаимодействия этого катиона со средой по схеме
XeF+5 + HF + SbF5 XeF+5 SbF-6 + H+; 2H+ + 2e- H2
происходит его стабилизация в виде соли XeF5SbF6.
Первичными молекулярными образованиями называют молекулярные системы, возникающие непосредственно в результате ядерного --перехода. ** См.: Нефедов В.Д., Синотова Е.Н., Торопова М.А. Химические послед-ствия радиоактивного распада. М., Энергоиздат, 1981. *** Разрешенными переходами называются --превращения в которых не имеет места изменение момента количества движения и четности волновой функции ядра. **** Здесь масса атома отдачи и масса покоя электрона выражены в энергетических единицах (1 а. е. м=931 МэВ, m0=0,51 МэВ).