
- •В.Д.Нефедов е.Н.Текстер м.А.Торопова радиохимия
- •Глава 1
- •§ 1. Предмет радиохимии
- •§ 2. Краткий очерк истории развития радиохимии
- •§ 3. Особенности радиохимии
- •§ 4. Значение радиохимии
- •1 Общая радиохимия глава 2
- •§ 1. Общехимические свойства изотопных частиц
- •2. Термодинамическое поведение изотопных частиц
- •3. Кинетическое поведение изотопных частиц
- •Глава 3
- •§ 1. Классификация реакций изотопного обмена
- •§ 2. Причины протекания реакций изотопного обмена
- •3. Особенности реакций идеального изотопного обмена
- •§ 4. Основное уравнение кинетики реакций идеального изотопного обмена
- •§ 5. Основы экспериментальных методов исследования процессов изотопного обмена
- •Глава 4
- •§ 1. Состояние радиоактивных элементов [нуклидов] в жидкой фазе
- •§ 2. Процессы радиоколлоидообразования
- •§ 3. Основы экспериментальных методов исследования радиоколлоидов
- •Глава 5
- •§ 1. Закономерности процессов соосаждения с изотопными носителями
- •§ 2. Основные области применения изотопных носителей
- •§ 3. Принцип действия и закономерности процессов соосаждения со специфическими носителями
- •§ 4 Факторы, влияющие на процесс соосаждения со специфическими носителями
- •§ 5. Особенности процессов соосаждения со специфическими носителями
- •§ 6. Сокристаллизация со специфическими носителями при отсутствии изоморфизма 1 рода
- •§ 7. Основы экспериментальных методов исследования процессов соосаждения со специфическими носителями
- •§ 8. Основные области применения специфических носителей
- •Глава 6
- •§ 1. Первичная адсорбция
- •§ 2. Вторичная обменная адсорбция
- •§ 3. Закономерности процесса соосаждения с неспецифическими носителями
- •§ 4. Соосаждение с неспецифическими носителями при образовании внутренне-адсорбционных систем
- •§ 5. Основы экспериментальных методов исследования процессов соосаждения с неспецифическими носителями
- •§ 6. Основные области применения неспецифических носителей
- •§ 7. Методы разграничения различных видов соосаждения
- •Глава 7
- •§ 1. Закономерности и классификация экстракционных процессов
- •§ 3. Практическое использование процессов экстракции
- •Глава 8
- •§ 1. Основные закономерности хроматографических процессов Ионообменная хроматография.
- •Распределительная хроматография.
- •См.: Егоров е. В., Макарова с. Б. Ионный обмен в радиохимии. М., Атомиздат, 1971. § 2. Основы экспериментальных методов хроматографического исследования
- •См.: Роберте т. Радиохроматография. М., Мир, 1981. § 3. Примеры практического использования хроматографических методов в радиохимии
- •Глава 9
- •§ 1. Закономерности электрохимических процессов
- •§ 2 Особенности поведения радиоактивных элементов (нуклидов) при электрохимических процессах
- •§ 3. Основы экспериментальных методов исследования электрохимических процессов
- •§ 4. Использование электрохимических процессов в радиохимии
- •2 Химия радиоактивных элементов
- •Глава 10
- •§ 1. Технеций
- •§ 2. Прометий
- •§ 3. Полоний
- •§ 4. Астат
- •§ 5. Радон
- •§ 6. Франций
- •§ 7. Радий
- •Глава 11
- •§ 1. История открытия актиния и актиноидов
- •§ 2. Важнейшие изотопы актиния и актиноидов, методы их получения и идентификации
- •§ 3. Физические свойства актиния и актиноидов
- •§ 4. Актиний
- •§ 5. Торий
- •§ 6. Протактиний
- •§ 7. Уран, нептуний, плутоний и америций
- •§ 8. Трайсамерициевые актиноиды
- •Глава 12
- •§ 1. История открытия
- •§ 2 Методы получения и идентификации
- •3 Химические последствия радиоактивного распада
- •Глава 13
- •§ 1. История открытия ядерной изомерии
- •§ 2. Особенности явления ядерной изомерии
- •§ 3. Химические последствия изомерных переходов
- •§ 4. Практическое использование химических последствий изомерного перехода
- •Глава 14
- •§ 1. Теоретические аспекты химических последствий --распада
- •§ 2. Экспериментальные методы исследования химических последствий --распада
- •§ 3. Практическое использование химических последствий --распада
1 Общая радиохимия глава 2
ПОВЕДЕНИЕ ИЗОТОПНЫХ ЧАСТИЦ
Под изотопными частицами понимают атомы, ионы и молекулы, отличающиеся по изотопному составу.
Известно, что химические системы, содержащие атомы стабильных элементов, сохраняют неизменным свой изотопный и элементный состав, тогда как элементный и изотопный состав систем, включающих радиоактивные нуклиды, является функцией времени. Возникает вопрос, сказывается ли изменение изотопного состава во времени на поведении элемента в целом, т. е. возможно ли изучать свойства элемента на основании исследования свойств любой совокупности его изотопов (в том числе и какого-нибудь одного из них). Для решения этого вопроса необходимо рассмотреть поведение изотопных частиц. При этом следует четко разграничивать два аспекта: ядерно-физический и химический. Известно, что ядерно-физические свойства изотопов различаются чрезвычайно сильно. Это относится к распространенности изотопов, энергии связи нуклонов в ядрах, сечению ядерных реакций, характеру и энергиям радиоактивного распада и т. д. Химический аспект включает вопросы общехимического, термодинамического и кинетического поведения изотопных частиц.
§ 1. Общехимические свойства изотопных частиц
Под общехимическим поведением изотопных частиц понимают характер и условия протекания реакций, в которых участвуют такие частицы, а также, качественный и количественный состав соединений, образующихся при определенных условиях.
Известно, что свойства элемента в целом прежде всего определяются структурой внешних и внутренних электронных оболочек. Резкое различие свойств элементов одного и того же периода обусловлено неодинаковым числом электронов во внешних оболочках атомов. Близкие, хотя и различающиеся свойства элементов одной и той же подгруппы данной группы периодической системы определяются неодинаковой структурой внутренних электронных оболочек. Изотопы одного и того же элемента характеризуются полной идентичностью строения как внешних, так и внутренних электронных оболочек.
Помимо структуры электронных оболочек, свойства элемента определяются также энергетическим состоянием электронов его атома. Причиной различного энергетического состояния электронов изотопных атомов, у которых заряд ядра одинаков, может быть лишь различие масс ядер.
Расчет энергии электронов Е для случая неподвижного ядра водородоподобного атома осуществляется с помощью уравнения Шредингера:
2 + 2me/2 ( E + Ze2/r ) = 0
где - оператор Лапласа; - волновая функция электрона, определяющая вероятность нахождения электрона в данной точке; me — масса электрона; = h/2, где h—постоянная Планка; Z— эффективный заряд ядра; е — заряд электрона; r — радиус орбиты. Ядро движется вокруг общего центра тяжести системы ядро— электрон. Вокруг этого же центра движется и электрон. Известно, что рассмотрение движения системы двух частиц можно заменить рассмотрением движения одной фиктивной частицы, обладающей приведенной массой (расположенной от неподвижного центра на расстоянии, равном расстоянию между частицами):
= Mme/( M + me )
где М—масса ядра, —приведенная масса системы ядро—электрон. С учетом движения ядра уравнение Шредингера можно записать
2 + 2/2( E + Ze2/r ) = 0
Решение этого уравнения имеет вид
E = -e4Z2/22n2
где n—главное квантовое число.
Если имеется два изотопа элемента с массами M1 и М2 приведенные массы которых
1 = M1me/(M1 + me) и 2 = M2me/(M2 + me)
то энергии электронов на определенном электронном уровне атомов этих изотопов соответственно
E1 = -1e4Z2/22n2 и E2 = -2e4Z2/22n2
Отношение этих энергий
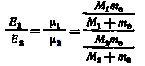
Для изотопов водорода с атомными массами 1 и 3 это отношение составляет 0,9996371, а для изотопов технеция (наиболее легкого радиоактивного элемента) с массовыми числами 98 и 99 оно равно 0,9999999.
Таким образом, строение электронных оболочек изотопных атомов и энергетическое состояние электронов на этих оболочках практически одинаковы. Это определяет идентичность общехимических свойств изотопов всех без исключения элементов периодической системы (в том числе и наиболее легких).
