- •В.Д.Нефедов е.Н.Текстер м.А.Торопова радиохимия
- •Глава 1
- •§ 1. Предмет радиохимии
- •§ 2. Краткий очерк истории развития радиохимии
- •§ 3. Особенности радиохимии
- •§ 4. Значение радиохимии
- •1 Общая радиохимия глава 2
- •§ 1. Общехимические свойства изотопных частиц
- •2. Термодинамическое поведение изотопных частиц
- •3. Кинетическое поведение изотопных частиц
- •Глава 3
- •§ 1. Классификация реакций изотопного обмена
- •§ 2. Причины протекания реакций изотопного обмена
- •3. Особенности реакций идеального изотопного обмена
- •§ 4. Основное уравнение кинетики реакций идеального изотопного обмена
- •§ 5. Основы экспериментальных методов исследования процессов изотопного обмена
- •Глава 4
- •§ 1. Состояние радиоактивных элементов [нуклидов] в жидкой фазе
- •§ 2. Процессы радиоколлоидообразования
- •§ 3. Основы экспериментальных методов исследования радиоколлоидов
- •Глава 5
- •§ 1. Закономерности процессов соосаждения с изотопными носителями
- •§ 2. Основные области применения изотопных носителей
- •§ 3. Принцип действия и закономерности процессов соосаждения со специфическими носителями
- •§ 4 Факторы, влияющие на процесс соосаждения со специфическими носителями
- •§ 5. Особенности процессов соосаждения со специфическими носителями
- •§ 6. Сокристаллизация со специфическими носителями при отсутствии изоморфизма 1 рода
- •§ 7. Основы экспериментальных методов исследования процессов соосаждения со специфическими носителями
- •§ 8. Основные области применения специфических носителей
- •Глава 6
- •§ 1. Первичная адсорбция
- •§ 2. Вторичная обменная адсорбция
- •§ 3. Закономерности процесса соосаждения с неспецифическими носителями
- •§ 4. Соосаждение с неспецифическими носителями при образовании внутренне-адсорбционных систем
- •§ 5. Основы экспериментальных методов исследования процессов соосаждения с неспецифическими носителями
- •§ 6. Основные области применения неспецифических носителей
- •§ 7. Методы разграничения различных видов соосаждения
- •Глава 7
- •§ 1. Закономерности и классификация экстракционных процессов
- •§ 3. Практическое использование процессов экстракции
- •Глава 8
- •§ 1. Основные закономерности хроматографических процессов Ионообменная хроматография.
- •Распределительная хроматография.
- •См.: Егоров е. В., Макарова с. Б. Ионный обмен в радиохимии. М., Атомиздат, 1971. § 2. Основы экспериментальных методов хроматографического исследования
- •См.: Роберте т. Радиохроматография. М., Мир, 1981. § 3. Примеры практического использования хроматографических методов в радиохимии
- •Глава 9
- •§ 1. Закономерности электрохимических процессов
- •§ 2 Особенности поведения радиоактивных элементов (нуклидов) при электрохимических процессах
- •§ 3. Основы экспериментальных методов исследования электрохимических процессов
- •§ 4. Использование электрохимических процессов в радиохимии
- •2 Химия радиоактивных элементов
- •Глава 10
- •§ 1. Технеций
- •§ 2. Прометий
- •§ 3. Полоний
- •§ 4. Астат
- •§ 5. Радон
- •§ 6. Франций
- •§ 7. Радий
- •Глава 11
- •§ 1. История открытия актиния и актиноидов
- •§ 2. Важнейшие изотопы актиния и актиноидов, методы их получения и идентификации
- •§ 3. Физические свойства актиния и актиноидов
- •§ 4. Актиний
- •§ 5. Торий
- •§ 6. Протактиний
- •§ 7. Уран, нептуний, плутоний и америций
- •§ 8. Трайсамерициевые актиноиды
- •Глава 12
- •§ 1. История открытия
- •§ 2 Методы получения и идентификации
- •3 Химические последствия радиоактивного распада
- •Глава 13
- •§ 1. История открытия ядерной изомерии
- •§ 2. Особенности явления ядерной изомерии
- •§ 3. Химические последствия изомерных переходов
- •§ 4. Практическое использование химических последствий изомерного перехода
- •Глава 14
- •§ 1. Теоретические аспекты химических последствий --распада
- •§ 2. Экспериментальные методы исследования химических последствий --распада
- •§ 3. Практическое использование химических последствий --распада
§ 3. Химические последствия изомерных переходов
Рассмотрим процессы, происходящие при изомерном переходе атома в составе молекулы [AmZXYn]. Если разрядка метастабильного состояния происходит с помощью радиационных переходов, то, в силу неизменности порядкового номера элемента и малой вероятности взаимодействия -квантов с электронными оболочками атома, можно считать, что зарядовое состояние системы не изменяется. Единственной причиной химических изменений может быть явление радиоактивной отдачи при эмиссии -квантов.
Так как -квант уносит импульс (Р), то в соответствии с законом сохранения импульса атом основного изомера получает равный по величине, но противоположный по направлению импульс (Рм). При этом Р = Е/с* и Рм = MV, где с — скорость света; М и V — масса и скорость атома отдачи. В результате простых преобразований получаем
![]() .
.
Расчет показывает, что при энергии -квантов, типичной для изомерных переходов (~100 кэВ) и М = 100 а. е. м., Ем 0,05 эВ. Эта энергия в сотни раз меньше энергии химических связей атомов Отсюда следует, что радиационный распад метастабильных состояний атомов в составе устойчивых молекул не должен сопровождаться раз. рушением последних и изомер в основном состоянии будет находиться в составе исходной молекулы.
Если разрядка метастабильного состояния происходит путем внутренней конверсии, то непосредственным результатом является эмиссия электронов внутренней конверсии, возникновение вакансии во внутренних оболочках атома и изменение зарядового состояния молекулы в соответствии со схемой
[AmZXY]q
![]() [AZXY](q
+ 1)* + eв. к.
где ВК — внутренняя
конверсия. Звездочка указывает на то,
что изменение зарядового состояния
произошло вследствие удаления электрона
с внутренней оболочки.
[AZXY](q
+ 1)* + eв. к.
где ВК — внутренняя
конверсия. Звездочка указывает на то,
что изменение зарядового состояния
произошло вследствие удаления электрона
с внутренней оболочки.
Энергия отдачи, получаемая атомом основного изомера при эмиссии электрона внутренней конверсии, определяется выражением
EM = Eeв. к.
![]() =
(Eп - Wi)
,
где
Eeв.к.—энергия электрона внутренней
конверсии. Нетрудно подсчитать, что так
же, как и при радиационной разрядке,
энергия отдачи в данном случае оказывается
много меньше энергии химической связи.
=
(Eп - Wi)
,
где
Eeв.к.—энергия электрона внутренней
конверсии. Нетрудно подсчитать, что так
же, как и при радиационной разрядке,
энергия отдачи в данном случае оказывается
много меньше энергии химической связи.
Основной причиной химических изменений при разрядке метастабильных состояний путем внутренней конверсии является возникновение вакансий во внутренних оболочках атомов.
Это означает не просто появление заряда в исследуемой молекуле, но и сосредоточение в одном из входящих в ее состав атомов огромной, с химической точки зрения, энергии, отвечающей потенциалу ионизации внутренних электронных оболочек**. Последующее рассеяние этой энергии может осуществляться с помощью двух конкурирующих процессов — рентгеновских и Оже-переходов. В первом случае происходит последовательное испускание рентгеновских квантов с энергиями Еh = WК — WL,M,N. Такие процессы приводят к постепенному перемещению вакансий от внутренних к внешним оболочкам и завершаются в течение 10-15—10-16 с. Конечное состояние системы сиигветствует однократно ионизованной исходной молекуле.
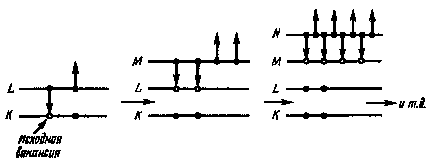
Процессы рассеяния энергии с помощью Оже-переходов состоят
|
Рис. 37. Схема Оже-переходов: -переход электрона на вакансию; - уход электрона за пределы атома |
в перераспределении ее между двумя электронами, находящимися в поле ядра, и остальными электронами. При этом один из электронов переходит в состояние с меньшей энергией (заполняет вакансию в нижележащей оболочке), а другой уходит за пределы атома. Результатом каждого Оже-перехода является удвоение зарядового состояния атома. Схема Оже-переходов, последовательно осуществляемых в атоме, ионизированном в К-оболочке, представлена на рис. 37.
Конечное зарядовое состояние атома (Q), достигаемое в результате n — Оже-переходов, определяется выражением Q = 2n, а энергия, которую получает атом вследствие n-кратной ионизации, составит
E = I1 + I2 + ...IQ. где I1,...,IQ — потенциалы ионизации атома.
Условием энергетической разрешенности Оже-переходов является соотношение
Wi Wi+1 + W+i+1, где Wi—энергия ионизации i-й оболочки; Wi+1—энергия ионизации (i + 1)-й оболочки; W+i+1 — энергия удаления электрона из однократно ионизированной (i + 1)-й оболочки.
В действительности рассеяние энергии атома, ионизованного во внутренней оболочке, осуществляется как с помощью радиационных, так и с помощью Оже-переходов. Спектры зарядовых состояний атомов, возникающих при изомерных переходах, зависят от порядкового номера элемента, коэффициента внутренней конверсии для соответствующей оболочки и относительной интенсивности радиационных и Оже-переходов. Характер спектра зарядовых состояний сохраняется и в том случае, когда изомерный переход происходит в атоме, являющемся частью молекулы. Это означает, что за время 10-15—10-16 с возникает спектр зарядов молекулярных ионов, в которых весь заряд сосредоточен на атоме, испытавшем изомерный переход (на атоме основного изомера). Происходящие при этом процессы можно представить с помощью схемы
[AmZXY]
![]() [AZXQ+iY],
где
ОП — Оже-переходы; n — число Оже-переходов;
Qi — зарядовое состояние атома
основного изомера.
[AZXQ+iY],
где
ОП — Оже-переходы; n — число Оже-переходов;
Qi — зарядовое состояние атома
основного изомера.
Ион [AZXQ+iY], образующийся за столь короткое время, сохраняет все параметры структуры (длины связей, углы и т. д.) исходной молекулы и вместе с тем содержит в своем составе многократно ионизованный атом. Последнее обстоятельство предопределяет крайнюю неустойчивость таких частиц. Их распад начинается с наиболее быстрых процессов перераспределения заряда, который осуществляется путем перетекания электронов от нейтральных структурных единиц к многократно ионизованному атому основного изомера. Этот процесс протекает за время ~10-14 с и может быть представлен схемой
[AZXQ+iY] [AZX(Qi-Q'i)+ YQ'+i] где Q'i — положительный заряд лигандов (структурных единиц).
В результате этого внутри многозарядного иона образуется несколько одноименно заряженных центров. Эти центры будут испытывать кулоновское взаимодействие (F):
![]() ,
где
r — расстояние между центрами. Такое
взаимодействие является причиной
взрывообразного распада иона с
образованием различных заряженных
фрагментов. Ниже приведено относительное
содержание фрагментов, образующихся
при изомерном переходе 80mВr в
составе СН3Вr (содержание Вr5+
принято за единицу):
,
где
r — расстояние между центрами. Такое
взаимодействие является причиной
взрывообразного распада иона с
образованием различных заряженных
фрагментов. Ниже приведено относительное
содержание фрагментов, образующихся
при изомерном переходе 80mВr в
составе СН3Вr (содержание Вr5+
принято за единицу):
Br1+ 0,54 |
Br2+ 0,66 |
Br3+ 0,54 |
Br4+ 0,51 |
Br5+ 1,0 |
Br6+ 1,33 |
Br7+ 1,46 |
Br8+ 1,35 |
Br9+ 0,95 |
Br10+ 0,70 |
Br11+ 0,31 |
Br12+ 0,09 |
Br13+ 0,06 |
CH3Br+ 0,99 |
CH3+ 1,81 |
CH2+ 0,16 |
CH+ 0,21 |
C+ 0,26 |
H+ 0,17 |
|
E = mc2 или Е = Pc, где m — динамическая масса -кванта. ** Эта энергия для К- и L-оболочек тяжелых атомов соответствует 40 — 50 кэВ.