- •В.Д.Нефедов е.Н.Текстер м.А.Торопова радиохимия
- •Глава 1
- •§ 1. Предмет радиохимии
- •§ 2. Краткий очерк истории развития радиохимии
- •§ 3. Особенности радиохимии
- •§ 4. Значение радиохимии
- •1 Общая радиохимия глава 2
- •§ 1. Общехимические свойства изотопных частиц
- •2. Термодинамическое поведение изотопных частиц
- •3. Кинетическое поведение изотопных частиц
- •Глава 3
- •§ 1. Классификация реакций изотопного обмена
- •§ 2. Причины протекания реакций изотопного обмена
- •3. Особенности реакций идеального изотопного обмена
- •§ 4. Основное уравнение кинетики реакций идеального изотопного обмена
- •§ 5. Основы экспериментальных методов исследования процессов изотопного обмена
- •Глава 4
- •§ 1. Состояние радиоактивных элементов [нуклидов] в жидкой фазе
- •§ 2. Процессы радиоколлоидообразования
- •§ 3. Основы экспериментальных методов исследования радиоколлоидов
- •Глава 5
- •§ 1. Закономерности процессов соосаждения с изотопными носителями
- •§ 2. Основные области применения изотопных носителей
- •§ 3. Принцип действия и закономерности процессов соосаждения со специфическими носителями
- •§ 4 Факторы, влияющие на процесс соосаждения со специфическими носителями
- •§ 5. Особенности процессов соосаждения со специфическими носителями
- •§ 6. Сокристаллизация со специфическими носителями при отсутствии изоморфизма 1 рода
- •§ 7. Основы экспериментальных методов исследования процессов соосаждения со специфическими носителями
- •§ 8. Основные области применения специфических носителей
- •Глава 6
- •§ 1. Первичная адсорбция
- •§ 2. Вторичная обменная адсорбция
- •§ 3. Закономерности процесса соосаждения с неспецифическими носителями
- •§ 4. Соосаждение с неспецифическими носителями при образовании внутренне-адсорбционных систем
- •§ 5. Основы экспериментальных методов исследования процессов соосаждения с неспецифическими носителями
- •§ 6. Основные области применения неспецифических носителей
- •§ 7. Методы разграничения различных видов соосаждения
- •Глава 7
- •§ 1. Закономерности и классификация экстракционных процессов
- •§ 3. Практическое использование процессов экстракции
- •Глава 8
- •§ 1. Основные закономерности хроматографических процессов Ионообменная хроматография.
- •Распределительная хроматография.
- •См.: Егоров е. В., Макарова с. Б. Ионный обмен в радиохимии. М., Атомиздат, 1971. § 2. Основы экспериментальных методов хроматографического исследования
- •См.: Роберте т. Радиохроматография. М., Мир, 1981. § 3. Примеры практического использования хроматографических методов в радиохимии
- •Глава 9
- •§ 1. Закономерности электрохимических процессов
- •§ 2 Особенности поведения радиоактивных элементов (нуклидов) при электрохимических процессах
- •§ 3. Основы экспериментальных методов исследования электрохимических процессов
- •§ 4. Использование электрохимических процессов в радиохимии
- •2 Химия радиоактивных элементов
- •Глава 10
- •§ 1. Технеций
- •§ 2. Прометий
- •§ 3. Полоний
- •§ 4. Астат
- •§ 5. Радон
- •§ 6. Франций
- •§ 7. Радий
- •Глава 11
- •§ 1. История открытия актиния и актиноидов
- •§ 2. Важнейшие изотопы актиния и актиноидов, методы их получения и идентификации
- •§ 3. Физические свойства актиния и актиноидов
- •§ 4. Актиний
- •§ 5. Торий
- •§ 6. Протактиний
- •§ 7. Уран, нептуний, плутоний и америций
- •§ 8. Трайсамерициевые актиноиды
- •Глава 12
- •§ 1. История открытия
- •§ 2 Методы получения и идентификации
- •3 Химические последствия радиоактивного распада
- •Глава 13
- •§ 1. История открытия ядерной изомерии
- •§ 2. Особенности явления ядерной изомерии
- •§ 3. Химические последствия изомерных переходов
- •§ 4. Практическое использование химических последствий изомерного перехода
- •Глава 14
- •§ 1. Теоретические аспекты химических последствий --распада
- •§ 2. Экспериментальные методы исследования химических последствий --распада
- •§ 3. Практическое использование химических последствий --распада
§ 8. Трайсамерициевые актиноиды
Химические свойства. Особенностью изучения химии этих элементов является необходимость использования методов радиохимии. Это обусловлено невозможностью получения большинства указанных элементов в весомых количествах, а также их чрезвычайно высокой массовой активностью.
Все элементы от кюрия до фермия получены в виде металлов. Основным методом получения является восстановление их трифторидов щелочными или щелочно-земельными металлами (или оксидов металлическим лантаном) при высоких температурах. Данные по химическому поведению этих элементов в металлическом состоянии относятся в основном к кюрию. Он легко растворяется в разбавленных кислотах, взаимодействует с водородом с образованием гидрида.
Оксиды состава МеО2 и Ме2О3 получены для кюрия, берклия и калифорния. Основными методами получения оксидов состава МеО2 является нагревание гидроксидов или оксалатов Me(III) на воздухе или в токе кислорода. BkO2 был получен также при прокаливании на воздухе ионита с нанесенным на него Bk(III), a CfO2 — обработкой Cf2O3 кислородом при высоком давлении и повышенной температуре. Оксиды состава Ме2О3 для кюрия и берклия получаются восстановлением MeO2 водородом, а для калифорния — прокаливанием на воздухе Cf (III), сорбированного на катионите.\
Оксиды являются исходными соединениями для синтеза галоге нидов состава МеГ3 и МеГ4 и оксигалогенидов общей формулы МеОxГу где 2х + у = 3 или 4. Оксиды и галогениды актиноидов тяжелее ка лифорния до настоящего времени не получены.
Как и более легкие актиноиды, кюрий, берклий и калифорний способны образовывать металлорганические соединения типа Me(C5H5), изоструктурные соответствующим соединениям празеодима.
В водных растворах для всех рассматриваемых элементов, за ис ключением 102-го, основной степенью окисления является +3. В этой степени окисления они, аналогично лантаноидам, находятся (в отсутствие процессов гидролиза и комплексообразования) в форме ионов [Me(H2O)x]3+. Для лантаноидов число молекул координационной воды колеблется в пределах 6—9. В ряду Cm(III) — Es(III) согласно теоретическим расчетам степень гидратации возрастает.
Склонность к комплексообразованию у рассматриваемых актиноидов в степени окисления +3 больше, чем у соответствующих лантаноидов. Исследовано комплексообразование кюрия, берклия и калифорния с лигандами СН3СОО-, SCN-, SO2-4, C2O2-4. Образование комплексов с органическими лигандами (например, лимонной, молочной и винной кислотами, комплексонами и некоторыми другими) установлено для всех элементов от кюрия до фермия включительно. Устойчивость образующихся комплексов возрастает с ростом порядкового номера элемента.
Кроме степени окисления +3, характерной для всех рассматриваемых элементов, кюрий, берклий и калифорний проявляют степень окисления +4. По химическим свойствам все рассматриваемые элементы в степени окисления +4, так же как и более легкие актиноиды, аналогичны Th(IV) и Ce(IV). Устойчивость степени окисления +4 для рассматриваемых элементов (за исключением берклия) уменьшается с ростом порядкового номера элемента (см. табл. 8). Аномальное поведение берклия обусловлено устойчивостью наполовину заполненного электронного 5f'-подуровня в ионе Bk4+. Кюрий и калифорний в этой степени окисления, аналогично америцию, крайне неустойчивы. Для них известны оксиды МеО2 и фториды MeF4. В водных растворах эти элементы в степени окисления +4 могут быть получены действием очень сильных окислителей в виде фторидных, фосфатных и фосфоро-вольфрамовых комплексов. Более легко происходит окисление Bk(III) до Bk(IV), которое может быть осуществлено в растворах минеральных кислот с помощью озона или электрохимически. Все эти элементы в степени окисления +4 в водных растворах восстанавливаются до степени окисления +3 под действием продуктов радиолиза воды. Особенно быстро этот процесс протекает в случае Cm(IV) и Cf(IV) (восстановление которых происходит также и в результате взаимодействия с водой).
Существование степени окисления +2 в водных растворах достоверно установлено для всех элементов от калифорния до 102-го. В ряду калифорний — 102-й элемент устойчивость степени окисления +2 возрастает, что хорошо видно из сравнения потенциалов пар Ме(III)/Ме(II). Калифорний, эйнштейний и фермий в степени окисления +2 были получены восстановлением Me(III) металлическим магнием в спиртовых солянокислых растворах и выделены изоморфным соосаждением с SmCl2. Менделевий в степени окисления +2 может быть получен восстановлением Me(III) более мягкими восстановителями, такими, как Eu(II), Cr(II), V(II).
Актиноиды в степени окисления +2 являются химическими аналогами лантаноидов в той же степени окисления, а также щелочноземельных элементов: они изоморфно соосаждаются с BaSO4, SmCl2 и др., легко образуют амальгамы. Элемент 102 с радиусом иона, по своей величине расположенным между радиусами ионов кальция и стронция, ведет себя при экстракции, ионном обмене и процессах комплексообразования подобно щелочно-земельным элементам.
Степень окисления +1 установлена только для менделевия. Md(I) может быть получен восстановлением Md(III) в водно-спиртовых растворах металлическим магнием. В этой степени окисления менделевий изоморфно соосаждается с соединениями тяжелых щелочных металлов, например с CsCI, RbCl, Rb2[PtCl6] и др. Однако, принимая во внимание рассчитанное значение радиуса иона Md(I), можно ожидать увеличения ковалентности химической связи в его соединениях по сравнению с соединениями щелочных металлов.
Методы выделения. Способы получения рассматриваемых элементов вынуждают выделять их из облученных мишеней сложного элементного и изотопного состава (элемент мишени, соседние актиноиды, продукты реакций деления и реакций глубокого отщепления). Отделение трансфермиевых элементов от вещества мишени является, пожалуй, единственной задачей, которая при синтезе элементов бомбардировкой тяжелыми ионами решается легче и быстрее, чем при других способах синтеза. Это обусловлено большой энергией отдачи, которую приобретают образующиеся ядра. Применяя достаточно тонкую мишень (толщиной не более длины пробега), можно обеспечить почти полное выбивание из нее ядер отдачи. Последние собираются тем или иным способом и затем анализируются. При использовании метода выбивания ядер отдачи из мишени облегчается и доставка продуктов реакций в детекторам излучения. Детекторы размещаются на достаточном удалении от области облучаемой мишени, так как она является источником интенсивного - и нейтронного излучения.
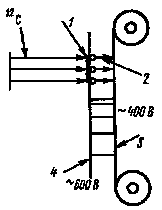
Аппаратурное оформление этого метода может быть различным. Атомы отдачи могут собираться на движущейся металлической ленте или диске, а также увлекаться к сборнику газовой струёй. На рис. 34 представлена схема устройства для двойного сбора атомов отдачи. Мишень, использованная А. Гиорсо для синтеза 102-го элемента, состояла из тонкой никелевой фольги с нанесенным на нее кюрием (рис. 34,7). При облучении мишени потоком ионов 12С атомы 102-го элемента, образующегося по реакции Cm(C, xn)102, выбиваются из мишени. Атомы отдачи 2, заряженные положительно, притягиваются металлической лентой 3, расположенной за мишенью и заряженной отрицательно. Скорость движения ленты выбирается таким образом, чтобы образующиеся при -распаде 102-го элемента атомы отдачи фермия попадали на сборник 4, заряженный еще более отрицательно. Таким образом осуществляется двукратный сбор атомов отдачи, что позволяет выделить фермий в радиохимически чистом состоянии.
|
|
Рис. 34. Схема устройства для двойного сбора атомов отдачи |
Рис. 35. Схема устройства для наблюдения -активных продуктов облучения с использованием газовой струи для транспортировки и собирания атомов отдачи |
Период полураспада 102-го элемента может быть рассчитан из скорости движения металлической ленты и распределения атомов фермия на сборнике 4.
Схема устройства для наблюдения -активных продуктов облучения с использованием газовой струи для транспортировки и собирания атомов отдачи изображена на рис. 35. Продукты, образующиеся при облучении мишени 2 пучком ионов 3, переносятся газовой струёй 1 на обод легкого колеса 5. Кольцевой детектор 4 служит для эффективного измерения радиоактивности короткоживущих нуклидов. По окружности колеса 5 через равные промежутки размещены другие детекторы, к которым продукты облучения доставляются периодически поворотами колеса на необходимый угол по заданному временному графику. Достоинством этого варианта метода является то, что атомы отдачи поступают в сборник после потери ими большей части энергии.
Наиболее сложной задачей является отделение тяжелых актиноидов друг от друга и от лантаноидов, используемых в качестве специфических носителей. Трудность заключается в том, что (в отличие от легких актиноидов) для рассматриваемых элементов характерна одна степень окисления + 3, с чем связана большая близость в их поведении при различных процессах, а отсюда следует необходимость использования многостадийных циклов очистки. Особо трудными для разделения являются пары америций — кюрий и калифорний — эйнштейний.
Для отделения актиноидов друг от друга и от лантаноидов используются процессы экстракции и ионного обмена. В основе этих методов
|
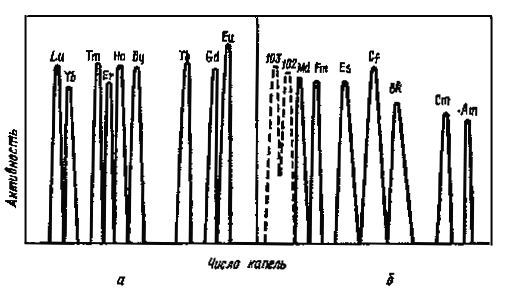
Рис. 36. Вымывание трехвалентных ионов с катионита раствором -оксиизобутирата аммония: а - лантаноидов, в - соответствующих им гомологов в группе актиноидов. Предсказанные положения кривых вымывания элементов 102 и 103 обозначены пунктиром |
лежат различия в устойчивости однотипных комплексных соединений разделяемых элементов. Экстракционные методы выделения и разделения трансамерициевых элементов широко распространены как в аналитической химии, так и в технологии этих элементов. В качестве экстрагентов используются фосфорорганические производные, амины, хелатообразующие реагенты или их смеси.
Кроме экстракции для целей выделения и разделения рассматриваемых элементов применимы почти все известные варианты хроматографических методов: ионный обмен, распределительная хроматография и разделение с использованием неорганических сорбентов. Метод ионного обмена сыграл важную роль при идентификации вновь открываемых тяжелых актиноидов по заранее предсказанному положению пика на кривой вымывания (рис. 36). Наиболее эффективно сочетание методов экстракции и ионного обмена.
Как хроматографические, так и экстракционные методы использовались для выделения практически всех актиноидов. Однако для самых тяжелых элементов (102-го и 103-го) применение этих методов затруднего крайне малыми временами их жизни.
Методы определения. Наиболее чувствительным и надежным методом определения трансамерициевых актиноидов является радиометрический метод. Большинство изотопов этих элементов: 242, 244Сm, 249, 250, 251Cf, 253Es, 252, 254, 255Fm, 256Md, 255, 256102 и 25610З— могут быть определены по их -излучению. Определение 244Cm, 252, 254Cf, 254, 256Fm производится по нейтронам, испускаемым при спонтанном делении, или по осколкам деления. 249Bk определяется по -излучению (Eмакс = 125 кэВ) после тщательной очистки анализируемых препаратов.
Применение. Практическое применение тяжелых актиноидов, так же как и легких, обусловлено их ядерно-физическими свойствами.
Так, изотопы 242, 244Cm используются для приготовления изотопы источников тока, 252, 254Cf являются удобным материалом для изготовления источников нейтронов с большой интенсивностью потока (5мкг 252Cf эквивалентны 1 г радия). Изотопы 242Cm и 254Es находят применение для изготовления -источников. Изотопы 245Сm, 249, 251Cf, так же как 242Аm, могут найти применение в качестве ядерного топлива для малогабаритных реакторов.