
- •В.Д.Нефедов е.Н.Текстер м.А.Торопова радиохимия
- •Глава 1
- •§ 1. Предмет радиохимии
- •§ 2. Краткий очерк истории развития радиохимии
- •§ 3. Особенности радиохимии
- •§ 4. Значение радиохимии
- •1 Общая радиохимия глава 2
- •§ 1. Общехимические свойства изотопных частиц
- •2. Термодинамическое поведение изотопных частиц
- •3. Кинетическое поведение изотопных частиц
- •Глава 3
- •§ 1. Классификация реакций изотопного обмена
- •§ 2. Причины протекания реакций изотопного обмена
- •3. Особенности реакций идеального изотопного обмена
- •§ 4. Основное уравнение кинетики реакций идеального изотопного обмена
- •§ 5. Основы экспериментальных методов исследования процессов изотопного обмена
- •Глава 4
- •§ 1. Состояние радиоактивных элементов [нуклидов] в жидкой фазе
- •§ 2. Процессы радиоколлоидообразования
- •§ 3. Основы экспериментальных методов исследования радиоколлоидов
- •Глава 5
- •§ 1. Закономерности процессов соосаждения с изотопными носителями
- •§ 2. Основные области применения изотопных носителей
- •§ 3. Принцип действия и закономерности процессов соосаждения со специфическими носителями
- •§ 4 Факторы, влияющие на процесс соосаждения со специфическими носителями
- •§ 5. Особенности процессов соосаждения со специфическими носителями
- •§ 6. Сокристаллизация со специфическими носителями при отсутствии изоморфизма 1 рода
- •§ 7. Основы экспериментальных методов исследования процессов соосаждения со специфическими носителями
- •§ 8. Основные области применения специфических носителей
- •Глава 6
- •§ 1. Первичная адсорбция
- •§ 2. Вторичная обменная адсорбция
- •§ 3. Закономерности процесса соосаждения с неспецифическими носителями
- •§ 4. Соосаждение с неспецифическими носителями при образовании внутренне-адсорбционных систем
- •§ 5. Основы экспериментальных методов исследования процессов соосаждения с неспецифическими носителями
- •§ 6. Основные области применения неспецифических носителей
- •§ 7. Методы разграничения различных видов соосаждения
- •Глава 7
- •§ 1. Закономерности и классификация экстракционных процессов
- •§ 3. Практическое использование процессов экстракции
- •Глава 8
- •§ 1. Основные закономерности хроматографических процессов Ионообменная хроматография.
- •Распределительная хроматография.
- •См.: Егоров е. В., Макарова с. Б. Ионный обмен в радиохимии. М., Атомиздат, 1971. § 2. Основы экспериментальных методов хроматографического исследования
- •См.: Роберте т. Радиохроматография. М., Мир, 1981. § 3. Примеры практического использования хроматографических методов в радиохимии
- •Глава 9
- •§ 1. Закономерности электрохимических процессов
- •§ 2 Особенности поведения радиоактивных элементов (нуклидов) при электрохимических процессах
- •§ 3. Основы экспериментальных методов исследования электрохимических процессов
- •§ 4. Использование электрохимических процессов в радиохимии
- •2 Химия радиоактивных элементов
- •Глава 10
- •§ 1. Технеций
- •§ 2. Прометий
- •§ 3. Полоний
- •§ 4. Астат
- •§ 5. Радон
- •§ 6. Франций
- •§ 7. Радий
- •Глава 11
- •§ 1. История открытия актиния и актиноидов
- •§ 2. Важнейшие изотопы актиния и актиноидов, методы их получения и идентификации
- •§ 3. Физические свойства актиния и актиноидов
- •§ 4. Актиний
- •§ 5. Торий
- •§ 6. Протактиний
- •§ 7. Уран, нептуний, плутоний и америций
- •§ 8. Трайсамерициевые актиноиды
- •Глава 12
- •§ 1. История открытия
- •§ 2 Методы получения и идентификации
- •3 Химические последствия радиоактивного распада
- •Глава 13
- •§ 1. История открытия ядерной изомерии
- •§ 2. Особенности явления ядерной изомерии
- •§ 3. Химические последствия изомерных переходов
- •§ 4. Практическое использование химических последствий изомерного перехода
- •Глава 14
- •§ 1. Теоретические аспекты химических последствий --распада
- •§ 2. Экспериментальные методы исследования химических последствий --распада
- •§ 3. Практическое использование химических последствий --распада
§ 5. Торий
Химические свойства. Торий—металл серебристого цвета, легко подвергающийся механической обработке. Порошкообразный торий пирофорен на воздухе (поэтому его хранят под слоем керосина) и легко окисляется с поверхности. Образцы металлического тория с содержанием оксида тория 1,5—2% очень устойчивы к окислению и долгое время не тускнеют. При высоких температурах металлический торий энергично взаимодействует с водородом, азотом, галогенами, серой, кремнием, алюминием и рядом других элементов. Интересным свойством металлического тория является растворимость в нем водорода, возрастающая с понижением температуры. Металлический торий растворим в концентрированных растворах НС1 (6—12 моль/л) и HNO3 (8—16 моль/л) в присутствии иона фтора.
Изучение химических свойств тория осуществляется методами классической химии. По химическим свойствам торий, с одной стороны, является аналогом церия, а с другой — циркония и гафния. Торий способен проявлять степени окисления +4, +3 и +2, из которых наиболее устойчивой является +4. Она же является единственной степенью окисления тория в растворе. Степени окисления +3 и +2 торий имеет в галогенидах ТhГ3 и ТhГ2 (где Г — Вr, I), полученных при действии очень сильных восстановителей только в твердой фазе.
Ион Th4+ обладает большим зарядом, относительно малым радиусом и большим числом электронных уровней, свободных для образования донорно-акцепторных связей с электронодонорными лигандами. Это объясняет склонность тория к образованию многочисленных интерметаллических (с натрием, медью, ртутью, цинком, алюминием и другими металлами) и комплексных соединений с неорганическими и органическими лигандами.
К числу соединений, наиболее важных для химии и технологии тория, относятся оксид, гидроксид и пероксид тория, фторид и другие трудно растворимые соединения, такие, как двойные сульфаты, иодат, хромат, фосфаты и т. д. Из растворимых соединений тория представляют интерес его комплексные соединения с анионами различных кислот, например хлоридами, нитратами, карбонатами, оксалатами, Цитратами и др. При этом с анионами С1-, СlO-3, и ВrО-3 торий образует только катионные комплексы состава [ThA]4-n, где n = 1, 2, 3. В присутствии, всех других лигандов торий, в зависимости от условий, может находиться в форме как катионных, так и анионных комплексов. Характерным свойством тория является также его способность образовывать внутрикомплексные соединения с такими реагентами, как ТТА, 8-оксихинолином, ацетилацетоном, комплексонами и др.
Для тория в степени окисления +4 характерны координационные числа 6, 8 и реже 10 и 12. Комплексные соединения тория с более низкими координационными числами, например ТhСl4, как правило, в растворах сольватированы или гидратированы.
В слабокислых растворах Th(+4) заметно гидролизуется с образованием как моноядерных Тh(ОН)4-n (где n = 13), так и полиядерных продуктов состава
Th2(OH)6+2,
Th[(OH)3Th]n(n+4)+,
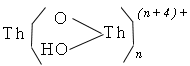 и
др.
и
др.
Методы выделения. Основными источниками тория являются торийсодержащие минералы (монацит, ортит). Методы выделения тория предусматривают отделение его от сопутствующих редкоземельные элементов. В технологии для этой цели используется в основном экстракция тория ТБФ после его отделения от основной массы редкоземельных элементов дробным осаждением менее растворимого суль фата тория. Для количественного извлечения тория необходимо про ведение многоступенчатого процесса экстракции (5—6 ступеней).
В аналитической химии для экстракционного выделения тория широкое применение нашли хелатообразующие реагенты (ТТА, 8-оксихинолин и др.) и высокомолекулярные амины. Кроме того, для аналитического выделения тория могут быть использованы методы осаждения и соосаждения, а также метод ионообменной хроматографии. Последний основан на том, что Th4+ очень сильно адсорбируется катионитами и в отличие от Me3+, Ме2+ и Ме+ не вымывается растворами соляной и азотной кислот любой концентрации. В качестве элюента для тория используются растворы комплексующих реагентов (чаще всего раствор щавелевой кислоты концентрацией 0,5 моль/л).
Малая устойчивость анионных комплексов тория с хлорид- и нитрат-ионами позволяет отделять его от урана, нептуния и плутония, а также других переходных элементов, образующих комплексы, адсорбируемые анионитами.
Методы соосаждения со специфическими (La, Се) и неспецифическими (Fe(OH)3, BiPО4 и др.) носителями используются в основном для получения препаратов 228, 230 и 234Th, применяемых в качестве радиоактивных индикаторов.
Методы определения. В зависимости от поставленной задачи при определении тория используются гравиметрические, объемные, колориметрические и радиометрические методы. Стандартным гравиметрическим методом является осаждение тория растворами аммиака или щавелевой кислоты с последующим прокаливанием до ThO2. Объемные методы основаны на титровании трилоном-Б или осаждении тория в виде труднорастворимых соединений постоянного состава и определении его по избытку осадителя.
Для определения малых количеств тория применяются колориметрические методы с использованием торона или n-арсоновой кислоты, а также радиометрические методы. Непосредственное радиометрическое определение тория (232Th) затруднено из-за его очень большого периода полураспада. В связи с этим радиометрическое определение тория производится по продуктам его распада при наличии радиоактивного равновесия.
Известен также метод радиометрического титрования тория. Титрование в этом случае производится фосфатом натрия, меченным радиоактивным изотопом фосфора 32Р.
Применение. Торий является перспективным материалом для ядерной энергетики. Делящимся элементом при этом служит 233U, образующийся по схеме 23290Th (n,) 23390Th 23392U. Достоинство тория как топливного материала определяется высокой температурой его плавления, отсутствием фазовых переходов, высокой механической прочностью и радиационной устойчивостью металлического тория и ряда его соединений (оксида, карбида, фторида). Использование тория в ядерной энергетике, по мнению многих авторов, способно решить проблему истощения природных запасов урана.
Из других областей применения тория представляет интерес использование ThO2 как катализатора, а также в качестве легирующих присадок к магниевым сплавам, используемым в авиационной и ракетной технике.
