- •В.Д.Нефедов е.Н.Текстер м.А.Торопова радиохимия
- •Глава 1
- •§ 1. Предмет радиохимии
- •§ 2. Краткий очерк истории развития радиохимии
- •§ 3. Особенности радиохимии
- •§ 4. Значение радиохимии
- •1 Общая радиохимия глава 2
- •§ 1. Общехимические свойства изотопных частиц
- •2. Термодинамическое поведение изотопных частиц
- •3. Кинетическое поведение изотопных частиц
- •Глава 3
- •§ 1. Классификация реакций изотопного обмена
- •§ 2. Причины протекания реакций изотопного обмена
- •3. Особенности реакций идеального изотопного обмена
- •§ 4. Основное уравнение кинетики реакций идеального изотопного обмена
- •§ 5. Основы экспериментальных методов исследования процессов изотопного обмена
- •Глава 4
- •§ 1. Состояние радиоактивных элементов [нуклидов] в жидкой фазе
- •§ 2. Процессы радиоколлоидообразования
- •§ 3. Основы экспериментальных методов исследования радиоколлоидов
- •Глава 5
- •§ 1. Закономерности процессов соосаждения с изотопными носителями
- •§ 2. Основные области применения изотопных носителей
- •§ 3. Принцип действия и закономерности процессов соосаждения со специфическими носителями
- •§ 4 Факторы, влияющие на процесс соосаждения со специфическими носителями
- •§ 5. Особенности процессов соосаждения со специфическими носителями
- •§ 6. Сокристаллизация со специфическими носителями при отсутствии изоморфизма 1 рода
- •§ 7. Основы экспериментальных методов исследования процессов соосаждения со специфическими носителями
- •§ 8. Основные области применения специфических носителей
- •Глава 6
- •§ 1. Первичная адсорбция
- •§ 2. Вторичная обменная адсорбция
- •§ 3. Закономерности процесса соосаждения с неспецифическими носителями
- •§ 4. Соосаждение с неспецифическими носителями при образовании внутренне-адсорбционных систем
- •§ 5. Основы экспериментальных методов исследования процессов соосаждения с неспецифическими носителями
- •§ 6. Основные области применения неспецифических носителей
- •§ 7. Методы разграничения различных видов соосаждения
- •Глава 7
- •§ 1. Закономерности и классификация экстракционных процессов
- •§ 3. Практическое использование процессов экстракции
- •Глава 8
- •§ 1. Основные закономерности хроматографических процессов Ионообменная хроматография.
- •Распределительная хроматография.
- •См.: Егоров е. В., Макарова с. Б. Ионный обмен в радиохимии. М., Атомиздат, 1971. § 2. Основы экспериментальных методов хроматографического исследования
- •См.: Роберте т. Радиохроматография. М., Мир, 1981. § 3. Примеры практического использования хроматографических методов в радиохимии
- •Глава 9
- •§ 1. Закономерности электрохимических процессов
- •§ 2 Особенности поведения радиоактивных элементов (нуклидов) при электрохимических процессах
- •§ 3. Основы экспериментальных методов исследования электрохимических процессов
- •§ 4. Использование электрохимических процессов в радиохимии
- •2 Химия радиоактивных элементов
- •Глава 10
- •§ 1. Технеций
- •§ 2. Прометий
- •§ 3. Полоний
- •§ 4. Астат
- •§ 5. Радон
- •§ 6. Франций
- •§ 7. Радий
- •Глава 11
- •§ 1. История открытия актиния и актиноидов
- •§ 2. Важнейшие изотопы актиния и актиноидов, методы их получения и идентификации
- •§ 3. Физические свойства актиния и актиноидов
- •§ 4. Актиний
- •§ 5. Торий
- •§ 6. Протактиний
- •§ 7. Уран, нептуний, плутоний и америций
- •§ 8. Трайсамерициевые актиноиды
- •Глава 12
- •§ 1. История открытия
- •§ 2 Методы получения и идентификации
- •3 Химические последствия радиоактивного распада
- •Глава 13
- •§ 1. История открытия ядерной изомерии
- •§ 2. Особенности явления ядерной изомерии
- •§ 3. Химические последствия изомерных переходов
- •§ 4. Практическое использование химических последствий изомерного перехода
- •Глава 14
- •§ 1. Теоретические аспекты химических последствий --распада
- •§ 2. Экспериментальные методы исследования химических последствий --распада
- •§ 3. Практическое использование химических последствий --распада
§ 2. Важнейшие изотопы актиния и актиноидов, методы их получения и идентификации
Наиболее важные изотопы актиноидов и методы их получения приведены в табл. 5.
Основным источником получения природных изотопов элементов от актиния до урана включительно являются руды, содержащие уран и торий. Методы искусственного получения актиноидов можно разделить на две группы.
Первая группа методов — облучение тория, урана и более тяжелых элементов нейтронами. Ядерные реакции, лежащие в основе этих методов, представляют собой многократно повторяющуюся реакцию радиационного захвата ядром нейтрона (n, ) с последующим - -распадом. Этим методом могут быть получены только изотопы с избытком нейтронов. Облучение нейтронами может осуществляться в ядерных реакторах (реакторный метод) с высокой интенсивностью потока (1013 — 1015 нейтронов/см2с) или в мощных кратковременных (импульсных) потоках нейтронов, возникающих при термоядерных взрывах. Получение трансурановых элементов в ядерном реакторе является единственным методом их промышленного производства. Схема получения акгиноидов реакторным методом представлена на рис. 32. Вертикальные стрелки указывают на образование в результате захвата нейтронов
Таблица 5. Наиболее важные изотопы актиния и актиноидов |
||||
Изотоп |
Период полураспада |
Массовая активность Бк/мкг |
Тип распада |
Метод получения |
227Ac* |
21,8 г |
2,7106 |
-(98,8%) (1,2%) |
Естественный, ряд 235U
226Ra(n,)227Ra |
228Ac |
6,13 ч |
7,951010 |
- |
Естественный, ряд 232Th |
228Th |
1,91 г |
3,07107 |
|
Естественный, ряд 232Th |
230Th |
7,52104 г |
7,72102 |
|
Естественный, ряд 238U |
232Th |
1,41010 |
4,1110-3 |
|
Естественный |
233Th |
22,12 м |
1,351012 |
- |
232Th(n,) |
234Th |
24,1 сут |
3,181010 |
- |
Естественный, ряд 238U |
231Pa |
3,45104 г |
1,68103 |
|
Естественный, ряд 235U 230Th(n,) 231Th |
233Pa |
27,0 сут |
7,75103 |
- |
232Th(n,) 233Th |
233U |
1,62105 г |
3,54102 |
|
232Th(n,) |
234U |
2,5105 г |
2,2810-2 |
|
Естественный, ряд 238U |
235U |
6,96108 г |
8,1710-2 |
|
Естественный |
238U* |
4,51109 г |
1,2410-2 |
|
>> |
235Np |
410 сут |
5,18107 |
ЭЗ, |
235U(d,n) |
237Np* |
2,14106 г |
26,3 |
, |
238U(n, 2n) 237U |
236Pu |
2,85 г |
2,0107 |
, |
238U(d, 6n) 237Np(d, 3n) |
238Pu |
86,4 г |
6,47105 |
|
238U(, 2n);
242Cm |
239Pu* |
2,44104 г |
2,3103 |
|
238U(, n); 239Np |
240Pu* |
6,66103 г |
8,5103 |
|
238U(, 2n); 239Pu(n, ) |
242Pu* |
3,87105 г |
1,44102 |
, |
241Pu(n, ) |
244Pu* |
8,28107 г |
6,66 |
(0,01%) -(99,9%), СД |
243Pu(n, );
244Am |
241Am* |
433 г |
1,26105 |
, |
241Pu |
243Am* |
7,37103 г |
74 |
|
242Am(n, ) 243Pu |
242Cm* |
164 сут |
1,22108 |
|
243Am(p, 2n); 242Am |
244Cm* |
18,099 г |
3,03104 |
|
244Am ; 243Cm(n, ) |
247Bk* |
1,38 103 г |
4,07104 |
|
244Cm(d,n); 247Cf |
249Bk* |
314 сут |
6,29107 |
-, (1,45x x10-3%) |
248Cm(n, ) 249Cm |
249Cf* |
352 г |
1,5105 |
|
249Bk |
252Cf* |
2,631 г |
2,0107 |
(0,968), СД(0,032) |
251Cf(n, ) |
253Es* |
20,47 сут |
9,25108 |
|
253Cf |
254Es* |
276 сут |
7,03107 |
, -(0,01) |
253Es(n, ) |
255Es* |
39,3 сут |
4,81108 |
-(0,91), (0,09) |
254Es(n, ) |
Продолжение табл. 5 |
||||
Изотоп |
Период по- лураспада |
Массовая активность Бк/мкг |
Тип распада |
Метод получения |
257Fm* |
94 сут |
2,03103 |
|
256Fm(n,) |
256Md* |
75 мин |
3,661011 |
ЭЗ(0,91) (0,09) |
253Es(, n) |
258Md |
56 сут |
3,37108 |
|
255Es(, n) |
255102* |
3,0 мин |
9,251012 |
|
242Pu(180,5 n); 246Cm(13C, 4 n); 248Cm(12C, 5 n) |
259102 |
1,5 ч |
3,011011 |
|
248Cm(18O, 3 n) |
256103* |
35 с |
4,71013 |
|
243Am(16O, 5 n) |
260103 |
3 мин |
9,11012 |
|
248Cm(15N,3 n) |
* Звездочкой отмечены изотопы, которые наиболее удобно использовать для изучения физических и химических свойств.
более тяжелых изотопов облучаемых элементов, а горизонтальные — на последовательно происходящие процессы --распада.
С увеличением атомного номера и массового числа синтезируемого элемента резко уменьшается его выход. Самый тяжелый элемент, который может быть получен реакторным методом, — фермий, поскольку единственным путем получения в реакторе трансфермиевых элементов является --распад 259Fm. Однако накопить этот изотоп в ядерном реакторе в соответствии со схемой 257Fm(n,) 258Fm(n,) 259Fm невозможно из-за того, что время, необходимое для присоединения нейтрона по реакции 257Fm(n,)258Fm, значительно больше, чем период спонтанного деления образующегося продукта 258Fm (Т= 3,810-4 с).
Особенностью получения трансурановых элементов в импульсных потоках нейтронов, возникающих при термоядерных взрывах, является чрезвычайно высокая интенсивность нейтронного потока (1023—1025 нейтронов/см2), существующего крайне короткое время (10-6 — 10-8 с). Чтобы получить такой интегральный поток нейтронов в реакторе (с интенсивностью 51015 нейтронов/см2с), необходимо облучение в течение 1—30 лет. В импульсном потоке происходит множественный захват нейтронов с образованием сверхтяжелого изотопа облучаемого элемента, который посредством цепи --превращений трансформируется в синтезируемый элемент, например
23892U [(n, )17 25592U]8- 255100Fm
Число захватываемых нейтронов в ядерной реакции этого типа зависит от плотности потока нейтронов и времени его действия. По теоретическим прогнозам в импульсных потоках нейтронов могут быть получены элементы с порядковыми номерами 104 и 105. Однако до настоящего времени самым тяжелым элементом, полученным этим методом, также является фермий (257Fm). Получение трансурановых элементов в импульсном потоке нейтронов характеризуется низкип выходом, связано с переработкой большого количества подвергнутого облучению материала очень сложного элементного и изотопного состава и исключительно высокой активности.
В т о р а я г р у п п а методов получения трансурановых элементов состоит в облучении урана и более тяжелых элементов заряженными частицами с использованием ускорителей различных типов (ускорительный метод).
Использование в качестве бомбардирующих частиц ионов дейтерия и гелия позволяет получить элементы вплоть до менделевия. Ряд реакций этого типа:
24993Cf(d, 2n) 24999Es; 25599Es(, n) 258101Md
Самые тяжелые актиноиды получают по ядерным реакциям с тяжелыми ионами — многократно ионизированными атомами углерода, азота и кислорода. В качестве примера такой реакции ниже представлена реакция получения 103-го элемента:
24896Cm + 157N
263103
![]() 260103
+ 310n
260103
+ 310n
Энергия тяжелых ионов, используемых в качестве бомбардирующих частиц, должна превышать кулоновский барьер слияния ядер и лежит в пределах десятков — сотен мегаэлектронвольт. Для получения таких ионов необходимы мощные ускорители. Особенностью и достоинством ядерных реакций этого типа является скачкообразное изменение атомного номера облучаемого элемента на величину, соответствующую порядковому номеру ядра бомбардирующей частицы. Недостатком метода является крайне малый выход нового элемента (единицы — сотни атомов за час работы ускорителя). Это объясняется тем, что основным видом распада составного ядра, образующегося в результате реакции слияния ядер, является спонтанное деление. Образование нового элемента, сопровождающееся испарением нескольких нейтронов, происходит с гораздо меньшей вероятностью. В наиболее благоприятных условиях соотношение вероятностей этих двух конкурирующих процессов составляет 103: 1.
Сложность идентификации актиноидов, особенно наиболее тяжелых из них, обусловлена крайне малыми периодами полураспада и сверхмалыми количествами синтезируемых элементов. Эти трудности усугубляются сложностью элементного и изотопного состава облученной мишени.
В связи с этим возникла необходимость разработки специальных экспрессных ядерно-физических и химических методов идентификации. Задачей ядерно-физических методов идентификации является установление заряда и массового числа синтезируемого изотопа, не прибегая к его химическому выделению. К этим методам относятся: метод перекрестных облучений, изучение кривых возбуждения, установление генетических связей.
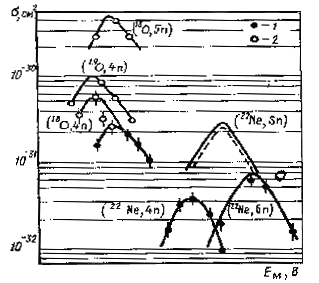
Целью метода перекрестных облучений является доказательство того, что новый изотоп образуется при определенных комбинациях ядер мишени и бомбардирующих частиц. Например, изотоп 255l02 может получаться по реакцииям 242Pu(18O, 5n) и 248Сm(12C, 5n), но не должен образовываться при облучении того же изотопа плутония по реакции 242Pu(126C, 4n).
|
Рис. 33. Кривые возбуждения при синтезе актиноидов по реакциям с тяжелыми ионами: 1 - элемента 102; 2 - фермия |
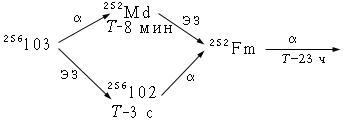
Метод установления генетических связей используется для определения заряда и массового числа изотопов, распадающихся путем -распада или электронного захвата. Он основан на идентификации дочернего продукта, представляющего собой нуклид с известными ядерно-физическими характеристиками. Этот метод был использован для идентификации изотопов 102-го и 103-го элементов, например:
![]()
Химические методы идентификации включают выделение синтезируемого элемента из облученной мишени и установление его химической природы. Наиболее распространенными методами химической идентификации всех актиноидных элементов, за исключением 102-го и 103-го, являются методы комплексообразовательной и распределительной хроматографии. При этом порядковый номер элемента определяется по положению пика на кривой вымывания (см. рис. 36).
Для химической идентификации короткоживущих тяжелых изотопов 102-го и 103-го элементов, получаемых в микроколичествах (несколько десятков атомов и менее), требовалась разработка специальных экспрессных методов идентификации. Одним из таких методов является фронтальная газовая хроматография на изотермической колонке (Т = 300° С) (схему установки см. рис. 21). Атомы 102-го и 103-го элементов тормозятся в потоке азота и переносятся газом в стеклянную колонку 4. На входе в колонку вводятся пары сравнительно летучих хлоридов, например NbC15, ZrC14, TaC15 или HfCl4, являющихся хлорирующими агентами. Экспериментально было показано, что адсорбция различных хлоридов хорошо коррелирует с их летучестью и чем менее летуч хлорид, тем больше время его удержания.
Для химической идентификации 102-го и 103-го элементов сравнивалось поведение хлоридов этих элементов с поведением хлоридов тербия, калифорния и фермия, являющихся типичными представителями семейств лантаноидов и актиноидов. При этом за поведением изучаемых элементов следили по 252Fm, дочернему продукту 102-го или внучатому продукту 103-го элементов:
Газовый поток переносил хлориды внутри стеклянной колонки длиной четыре метра, и они, в зависимости от их летучести, оседали в различных местах на внутренней поверхности стенок колонки. Предварительные опыты показали, что летучие хлориды элементов IV— VII групп периодической системы сравнительно легко проходят по всей колонке без существенной задержки, 102-й и 103-й элементы образуют нелетучие хлориды. Фронт этих хлоридов двигался по колонке очень медленно (подобно хлоридам других лантаноидов и актиноидов). Это указывало на их принадлежность к группе актиноидов, что дополнительно подтверждалось опытами по экстракции 102-го элемента в степени окисления +2 и 103-го в степени окисления +3.