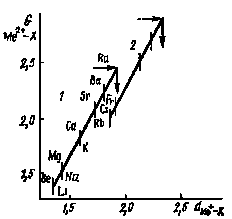- •В.Д.Нефедов е.Н.Текстер м.А.Торопова радиохимия
- •Глава 1
- •§ 1. Предмет радиохимии
- •§ 2. Краткий очерк истории развития радиохимии
- •§ 3. Особенности радиохимии
- •§ 4. Значение радиохимии
- •1 Общая радиохимия глава 2
- •§ 1. Общехимические свойства изотопных частиц
- •2. Термодинамическое поведение изотопных частиц
- •3. Кинетическое поведение изотопных частиц
- •Глава 3
- •§ 1. Классификация реакций изотопного обмена
- •§ 2. Причины протекания реакций изотопного обмена
- •3. Особенности реакций идеального изотопного обмена
- •§ 4. Основное уравнение кинетики реакций идеального изотопного обмена
- •§ 5. Основы экспериментальных методов исследования процессов изотопного обмена
- •Глава 4
- •§ 1. Состояние радиоактивных элементов [нуклидов] в жидкой фазе
- •§ 2. Процессы радиоколлоидообразования
- •§ 3. Основы экспериментальных методов исследования радиоколлоидов
- •Глава 5
- •§ 1. Закономерности процессов соосаждения с изотопными носителями
- •§ 2. Основные области применения изотопных носителей
- •§ 3. Принцип действия и закономерности процессов соосаждения со специфическими носителями
- •§ 4 Факторы, влияющие на процесс соосаждения со специфическими носителями
- •§ 5. Особенности процессов соосаждения со специфическими носителями
- •§ 6. Сокристаллизация со специфическими носителями при отсутствии изоморфизма 1 рода
- •§ 7. Основы экспериментальных методов исследования процессов соосаждения со специфическими носителями
- •§ 8. Основные области применения специфических носителей
- •Глава 6
- •§ 1. Первичная адсорбция
- •§ 2. Вторичная обменная адсорбция
- •§ 3. Закономерности процесса соосаждения с неспецифическими носителями
- •§ 4. Соосаждение с неспецифическими носителями при образовании внутренне-адсорбционных систем
- •§ 5. Основы экспериментальных методов исследования процессов соосаждения с неспецифическими носителями
- •§ 6. Основные области применения неспецифических носителей
- •§ 7. Методы разграничения различных видов соосаждения
- •Глава 7
- •§ 1. Закономерности и классификация экстракционных процессов
- •§ 3. Практическое использование процессов экстракции
- •Глава 8
- •§ 1. Основные закономерности хроматографических процессов Ионообменная хроматография.
- •Распределительная хроматография.
- •См.: Егоров е. В., Макарова с. Б. Ионный обмен в радиохимии. М., Атомиздат, 1971. § 2. Основы экспериментальных методов хроматографического исследования
- •См.: Роберте т. Радиохроматография. М., Мир, 1981. § 3. Примеры практического использования хроматографических методов в радиохимии
- •Глава 9
- •§ 1. Закономерности электрохимических процессов
- •§ 2 Особенности поведения радиоактивных элементов (нуклидов) при электрохимических процессах
- •§ 3. Основы экспериментальных методов исследования электрохимических процессов
- •§ 4. Использование электрохимических процессов в радиохимии
- •2 Химия радиоактивных элементов
- •Глава 10
- •§ 1. Технеций
- •§ 2. Прометий
- •§ 3. Полоний
- •§ 4. Астат
- •§ 5. Радон
- •§ 6. Франций
- •§ 7. Радий
- •Глава 11
- •§ 1. История открытия актиния и актиноидов
- •§ 2. Важнейшие изотопы актиния и актиноидов, методы их получения и идентификации
- •§ 3. Физические свойства актиния и актиноидов
- •§ 4. Актиний
- •§ 5. Торий
- •§ 6. Протактиний
- •§ 7. Уран, нептуний, плутоний и америций
- •§ 8. Трайсамерициевые актиноиды
- •Глава 12
- •§ 1. История открытия
- •§ 2 Методы получения и идентификации
- •3 Химические последствия радиоактивного распада
- •Глава 13
- •§ 1. История открытия ядерной изомерии
- •§ 2. Особенности явления ядерной изомерии
- •§ 3. Химические последствия изомерных переходов
- •§ 4. Практическое использование химических последствий изомерного перехода
- •Глава 14
- •§ 1. Теоретические аспекты химических последствий --распада
- •§ 2. Экспериментальные методы исследования химических последствий --распада
- •§ 3. Практическое использование химических последствий --распада
2 Химия радиоактивных элементов
Изучение химических свойств стабильных элементов осуществляется с использованием природной смеси изотопов. В радиохимии исследователь часто сталкивается с необходимостью получения информации о химии радиоактивного элемента по поведению одного из его изотопов, что возможно благодаря тому, что химическое поведение различных изотопов элемента тождественно (см. гл. 1) и не зависит от ядерно-физических характеристик исследуемого нуклида.
Радиоактивная природа и прежде всего период полураспада определяют возможную массу вещества, с которой обычно работает исследователь при изучении химических свойств радиоактивных элементов, не имеющих долгоживущих изотопов (прометий, полоний, астат, радон, франций). При этом верхний предел составляет 10-6 г и менее, а для элементов с Z > 100 исследования проводятся с сотнями, а иногда и с десятками атомов.
Основные свойства веществ и закономерности их поведения установлены для масс более 10-6 г и концентраций более 10-5 моль/л. Возникает вопрос, сохраняются ли при сколь угодно малых количествах индивидуальные химические свойства элементов, их поведение и само понятие химического вещества. При этом не имеется в виду возможность изменения свойств и поведения радиоактивного вещества вследствие радиолиза.
Известно, что целый ряд физико-химических характеристик зависит от количества вещества*. Например, давление пара жидкости зависит от размера капли. При радиусе капли порядка 1 нм давление пара на 0,1 % больше, чем при обычных условиях. Для воды это имеет место при массе капли 5 пикограмм, для расплавленного америция — при 0,8 нанограмм.
В водных растворах электролитов при очень малых концентрациях (<10-5 моль/л) уже нельзя пренебрегать концентрацией продуктов диссоциации воды [Н+] = [ОН-] = 10-7 моль/л. Это означает, что ионная сила растворов сильных электролитов в области очень разбавленных растворов не может упасть ниже 10-7. Аналогичным образом концентрация водородных ионов (продуктов диссоциаций воды) ограничивает степень диссоциации и гидролиза в очень разбавленных растворах.
Химические реакции, протекающие с малым числом молекулу идентичны реакциям с большим количеством вещества лишь в той мере, в какой число реагирующих молекул обеспечивает статистическое распределение частиц в системе. Только в этом случае можно пренебречь флуктуациями в аддитивных величинах.
В соответствии с законом распределения случайных ошибок, обусловленных статистическим разбросом, относительная погрешность определяется соотношением
= N/N100%, где N — число реагирующих молекул. Это соотношение показываете что для воспроизводимости результата с точностью ~0,1% необходимо иметь минимум 106 молекул, а для воспроизведения с погрешностью 10% требуется не менее 100 молекул. При молекулярной массе порядка 200 это отвечает примерно 310-16 и 310-20 г соответственно.
Если число реагирующих молекул меньше 10, то общепринятая статистическая концепция не имеет силы. Для химических исследований, проводимых с количествами вещества, исчисляемыми единичные ми атомами, вводится эквивалентная концепция статистического поведения частиц во времени. В этом случае статистически достоверные данные получаются в результате многократного повторения эксперимента. Например, существование трехвалентного лоуренсия доказывалось на основе изучения экстракционного поведения 10 атомов 256Lr(T = 35 с); к концу эксперимента оставался всего 1 атом лоуренсия. Достоверный вывод о существовании 256Lr в степени окисления 3+ был получен при проведении около 200 параллельных опытов.
Чрезвычайно важной является концентрационная зависимость скоростей реакций высших порядков. Для бимолекулярной реакции 2-го порядка скорость реакции определяется соотношением: = k[X][А], где k—константа скорости реакции, [X] и [А]—концентрации реагирующих веществ. Из этого соотношения видно, что уменьшение концентрации реагирующих веществ приводит к резкому снижению скорости реакции, что обусловлено уменьшением вероятности столкновения реагирующих частиц. Так, при изменении концентрации веществ от 10-3 до 10-9 моль/л скорость реакции уменьшается на 12 порядков.
Уменьшение обусловлено уменьшением вероятности эффективных столкновений реагирующих веществ.
При очень больших разбавлениях может вообще измениться механизм реакции из-за доминирующей роли других процессов, относительные скорости которых велики. Например, гидролиз макроколичеств иода приводит к образованию 10-3 по уравнениям реакций:
I2 + H2O HIO + HI
3HIO НIO3 + 2НI
При работе с микроконцентрациями иода и астата реакция гидролиза прекращается на первой стадии.
Из изложенного следует, что при изучении физико-химических свойств веществ, находящихся в ультрамалых концентрациях, и их реакций необходимо учитывать целый ряд особенностей.
Одной из наиболее важных задач исследования химии элемента является определение его состояния, т. е. установление физико-химических форм (ионной, молекулярной, коллоидной), в которых он находится в системе, и их относительного содержания.
Разграничение ионной и молекулярной форм от коллоидной не представляет особых трудностей и может быть выполнено методами, описанными в гл. 4. Для установления степени окисления и изучения химических форм элементов, находящихся в микроколичествах, и для определения основных физико-химических констант особую роль приобретают косвенные методы, исследования, а также сравнительные методы расчета.
Косвенными методами установления степени окисления, молекулярной формы, а также ряда физико-химических характеристик, например произведения растворимости окислительно-восстановительных потенциалов радиоактивных элементов и т. д., являются методы, основанные на процессах изоморфной сокристаллизации, экстракции, хроматографии, электрохимических процессах и др.
Для установления ряда очень важных физико-химических характеристик радиоактивных элементов неоценимую роль приобретают сравнительные методы расчета. Эти методы основаны в большинстве случаев на закономерностях в изменении физико-химических свойств в рядах соединений элементов-аналогов. При этом либо строится зависимость этих свойств от параметров, характеризующих индивидуальность элемента-(порядковый номер, массовое число, ковалентный или ионный радиус и др.), либо сравнивается определенное свойство однотипных соединений в двух близких рядах.
Из нескольких вариантов метода сравнительного расчета, предложенных М. X. Карапетьянцем**, чаще используется сравнение значении двух свойств (G' и G") в одном ряду сходных веществ. При этом
G"ABi = K + K1G 'AB. |
(1) |
Это соотношение соблюдается, если справедливы зависимости
G 'ABi = a'A + b'B (GBi). |
(2) |
и
G "ABi = a"A + b"A (GBi). |
(3) |
где GBi — некоторая характеристика неодинаковых, но аналогичных частей Вi молекулы АВi, называемая параметром вещества; aA и bA — постоянные, значения которых определяются видом той часта молекулы, которая одинакова для всех веществ ряда. Действительно, из уравнений (2) и (3) следует, что
 ,
т.е.
в уравнении (1)
,
т.е.
в уравнении (1)
![]() и
и
![]() .
.
Соотношение (1) использовалось, например, для определения межатомных расстояний в галогенидах франция и радия. В этом случае параметром вещества является порядковый номер щелочных и щелочно-земельных элементов, G " и G ' — межатомные расстояния в галогенидах щелочно-земельных и щелочных металлов соответственно. Значения К и K1 находились графически (рис. 27).
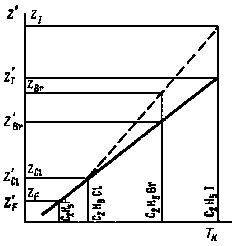
Некоторые физико-химические свойства (потенциал ионизации. температуры кипения и плавления и др.) подчиняются соотношению GRx = К + K1Z', аналогичному соотношению (1), в котором Z' — так называемый параметр элемента. По известному значению параметра элемента легко рассчитать различные физико-химические характеристики соединений этого элемента. Для определения выбирается такая физико-химическая характеристика, которая достаточна точно определяется экспериментально. На рис. 28 представлен калибровочный график для определения Z' галогенов на основании данных по температурам кипения этилгалогенидов. Для нахождения Z' строится прямая по двум точкам, соответствующим элементам, для которых определяемая экспериментально (физико-химическая характеристика установлена наиболее надежно (этилфторид и этилхлорид). Соответствующие точки на оси ординат отвечают Z' (в этом случае Z' = Z).
|
|
Рис. 27. Взаимосвязь межатомных расстояний в газообразных галогенидах щелочных и щелочно-земельных металлов: 1 - фториды, 2 - иодиды |
Рис. 28. Калибровочный график для определения параметра элемента (Z' ) для галогенов по температурам кипения этилгалогенидов |
Как видно (рис. 28), температуры кипения для этилбромида и этилиодида не ложатся на эту прямую, для них Z' Z и отвечает ординатам точек, соответствующих температурам кипения, укладывающимся на прямую. Таким образом, получаем: Z'F = 9; Z'Cl = 17; Z'Br = 21,1; Z'I = 26,5.
Этот метод был использован для определения параметра Z' элемента астата, что позволило определить большое число физико-химических характеристик этого элемента и его соединений. Для определения Z'At (рис. 28) необходимо было оценить температуру кипения аналогичных соединений астата. Для этого была использована линейная зависимость логарифма времени удерживания n-алкилгалогенидов от их температуры кипения при постоянных условиях газохроматографического разделения. Исходя из относительного времени удержания (на динонилфталате при температуре газохроматографической колонки 95, 105 и 115° С) для десяти рядов n-алкилпроизводных брома, иода и астата было получено значение Z' для астата, равное 30,2. С использованием этого значения были оценены температуры кипения и плавления, энергии диссоциации, потенциалы ионизации и энтальпии испарения многих органических и неорганических соединений астата. Знание Z'At позволило предсказывать время удержания (при газохроматографическом анализе) вновь получаемых органических соединений астата.
Различные варианты сравнительных методов расчета нашли применение при определении многих физико-химических характеристик радиоактивных элементов, не имеющих долгоживущих изотопов.