
- •В.Д.Нефедов е.Н.Текстер м.А.Торопова радиохимия
- •Глава 1
- •§ 1. Предмет радиохимии
- •§ 2. Краткий очерк истории развития радиохимии
- •§ 3. Особенности радиохимии
- •§ 4. Значение радиохимии
- •1 Общая радиохимия глава 2
- •§ 1. Общехимические свойства изотопных частиц
- •2. Термодинамическое поведение изотопных частиц
- •3. Кинетическое поведение изотопных частиц
- •Глава 3
- •§ 1. Классификация реакций изотопного обмена
- •§ 2. Причины протекания реакций изотопного обмена
- •3. Особенности реакций идеального изотопного обмена
- •§ 4. Основное уравнение кинетики реакций идеального изотопного обмена
- •§ 5. Основы экспериментальных методов исследования процессов изотопного обмена
- •Глава 4
- •§ 1. Состояние радиоактивных элементов [нуклидов] в жидкой фазе
- •§ 2. Процессы радиоколлоидообразования
- •§ 3. Основы экспериментальных методов исследования радиоколлоидов
- •Глава 5
- •§ 1. Закономерности процессов соосаждения с изотопными носителями
- •§ 2. Основные области применения изотопных носителей
- •§ 3. Принцип действия и закономерности процессов соосаждения со специфическими носителями
- •§ 4 Факторы, влияющие на процесс соосаждения со специфическими носителями
- •§ 5. Особенности процессов соосаждения со специфическими носителями
- •§ 6. Сокристаллизация со специфическими носителями при отсутствии изоморфизма 1 рода
- •§ 7. Основы экспериментальных методов исследования процессов соосаждения со специфическими носителями
- •§ 8. Основные области применения специфических носителей
- •Глава 6
- •§ 1. Первичная адсорбция
- •§ 2. Вторичная обменная адсорбция
- •§ 3. Закономерности процесса соосаждения с неспецифическими носителями
- •§ 4. Соосаждение с неспецифическими носителями при образовании внутренне-адсорбционных систем
- •§ 5. Основы экспериментальных методов исследования процессов соосаждения с неспецифическими носителями
- •§ 6. Основные области применения неспецифических носителей
- •§ 7. Методы разграничения различных видов соосаждения
- •Глава 7
- •§ 1. Закономерности и классификация экстракционных процессов
- •§ 3. Практическое использование процессов экстракции
- •Глава 8
- •§ 1. Основные закономерности хроматографических процессов Ионообменная хроматография.
- •Распределительная хроматография.
- •См.: Егоров е. В., Макарова с. Б. Ионный обмен в радиохимии. М., Атомиздат, 1971. § 2. Основы экспериментальных методов хроматографического исследования
- •См.: Роберте т. Радиохроматография. М., Мир, 1981. § 3. Примеры практического использования хроматографических методов в радиохимии
- •Глава 9
- •§ 1. Закономерности электрохимических процессов
- •§ 2 Особенности поведения радиоактивных элементов (нуклидов) при электрохимических процессах
- •§ 3. Основы экспериментальных методов исследования электрохимических процессов
- •§ 4. Использование электрохимических процессов в радиохимии
- •2 Химия радиоактивных элементов
- •Глава 10
- •§ 1. Технеций
- •§ 2. Прометий
- •§ 3. Полоний
- •§ 4. Астат
- •§ 5. Радон
- •§ 6. Франций
- •§ 7. Радий
- •Глава 11
- •§ 1. История открытия актиния и актиноидов
- •§ 2. Важнейшие изотопы актиния и актиноидов, методы их получения и идентификации
- •§ 3. Физические свойства актиния и актиноидов
- •§ 4. Актиний
- •§ 5. Торий
- •§ 6. Протактиний
- •§ 7. Уран, нептуний, плутоний и америций
- •§ 8. Трайсамерициевые актиноиды
- •Глава 12
- •§ 1. История открытия
- •§ 2 Методы получения и идентификации
- •3 Химические последствия радиоактивного распада
- •Глава 13
- •§ 1. История открытия ядерной изомерии
- •§ 2. Особенности явления ядерной изомерии
- •§ 3. Химические последствия изомерных переходов
- •§ 4. Практическое использование химических последствий изомерного перехода
- •Глава 14
- •§ 1. Теоретические аспекты химических последствий --распада
- •§ 2. Экспериментальные методы исследования химических последствий --распада
- •§ 3. Практическое использование химических последствий --распада
§ 4. Использование электрохимических процессов в радиохимии
Одним из наиболее важных для радиохимии направлений использовaния электрохимических процессов является изучение состояния и физико-химических свойств радиоактивных элементов.
Знак заряда иона, в виде которого радиоактивный элемент присутствует в растворе, можно определить путем изучения миграции этого элемента в электрическом поле. Значение заряда иона определяется путем изучения подвижности и коэффициента диффузии этого иона в растворе электролита. Заряд иона рассчитывается из следующего соотношения:
![]() ,
где
D — коэффициент диффузии (м2/с);b
— подвижность катиона (м2/Bс).
,
где
D — коэффициент диффузии (м2/с);b
— подвижность катиона (м2/Bс).
Необходимо отметить, что этот метод позволяет определить только заряд (z) иона, в виде которого радиоактивный элемент находится в исследуемом растворе, а не его состав. Так, было установлено, что в растворе НС1 заряд ионов полония равен двум, что может относиться либо к иону РоО2+, либо Ро2+, либо РоС12-6.
Прямым методом,
позволяющим определить заряд иона,
соответствующий степени окисления
радиоактивного элемента, и равновесный
потенциал Е0Меz+/Me
электрода, обратимого относительно
этого иона, является изучение зависимости
критического потенциала осаждения от
концентрации радиоактивного элемента.
Тангенс угла наклона зависимости
Eкр.=f(lg с) определяется
соотношением
![]() ,
из которого рассчитывается z. Однако
этот метод предполагает применимость
к исследуемой системе уравнения Нернста.
Используя этот метод, Д. М. Зив с
сотрудниками установили, что в растворе
НС1 (с = 9,1 моль/л) полоний находится
в степени окисления +4 (z = 3,92) и
E0Po4+/Po
= 0,765 B.
,
из которого рассчитывается z. Однако
этот метод предполагает применимость
к исследуемой системе уравнения Нернста.
Используя этот метод, Д. М. Зив с
сотрудниками установили, что в растворе
НС1 (с = 9,1 моль/л) полоний находится
в степени окисления +4 (z = 3,92) и
E0Po4+/Po
= 0,765 B.
Изучение электрохимического поведения актиноидов, и особенно элементов, существующих в разных степенях окисления, позволяет получить ценную информацию об их свойствах и состоянии в растворах. Это особенно важно при изучении химии и разработке методов выделения, разделения, очистки и анализа таких элементов, как нептуний, плутоний и америций, которые могут проявлять в водных растворах степени окисления от +3 до +7.
Большинство экспериментально определенных окислительно-восстановительных потенциалов актиноидных элементов являются формальными, т. е. измеренными для систем с одинаковой аналитической концентрацией восстановленной и окисленной форм в растворе определенного состава. Так, равновесный потенциал системы PuO22+ + 2e- + 4Н + Pu4+ + 2Н2О может быть представлен следующим соотношением:
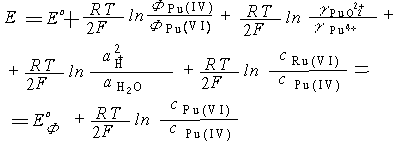 где
Е0ф — формальный
окислительно-восстановительный потенциал
системы в растворе данного состава;
сPu(VI), cPu(IV) — общие
аналитические концентрации окисленной
и восстановленной форм плутония;
где
Е0ф — формальный
окислительно-восстановительный потенциал
системы в растворе данного состава;
сPu(VI), cPu(IV) — общие
аналитические концентрации окисленной
и восстановленной форм плутония;
![]() и
и
![]() функции
закомплексованности; E0 —
стандартный окислительно-восстановительный
потенциал. Следовательно, значение
формального потенциала системы зависит
от состава раствора, в частности от
природы кислоты. Так, формальный потенциал
пары Pu(VI)/Pu(IV) возрастает в ряду НС1O4
< НС1 < H2SO4 вследствие
большей склонности к комплексообразованию
Pu(IV) с сульфат-ионами. Поэтому для
сравнительных оценок необходимо
пользоваться значениями формальных
потенциалов измеренных в растворе
одинакового состава и концентрации.
функции
закомплексованности; E0 —
стандартный окислительно-восстановительный
потенциал. Следовательно, значение
формального потенциала системы зависит
от состава раствора, в частности от
природы кислоты. Так, формальный потенциал
пары Pu(VI)/Pu(IV) возрастает в ряду НС1O4
< НС1 < H2SO4 вследствие
большей склонности к комплексообразованию
Pu(IV) с сульфат-ионами. Поэтому для
сравнительных оценок необходимо
пользоваться значениями формальных
потенциалов измеренных в растворе
одинакового состава и концентрации.
Электрохимические методы используются так же, как методы разделения радиоактивных элементов и как методы выделения без носителя радиоактивных нуклидов, образующихся в результате различных ядерных реакций.
Метод электромиграции, основанный на различии подвижностей ионов в электрическом поле, нашел применение как для разделения радиоактивных элементов, так и для изучения процессов их комплексообразования. В последнее время этот метод широко используется для разделения редкоземельных и актиноидных элементов. Достоинством метода является большая скорость процесса разделения. Так, разделение радиоактивных нуклидов 144Се, 144Pr и 152Еu в растворе ЭДТА может быть осуществлено за 45 с.
