- •В.Д.Нефедов е.Н.Текстер м.А.Торопова радиохимия
- •Глава 1
- •§ 1. Предмет радиохимии
- •§ 2. Краткий очерк истории развития радиохимии
- •§ 3. Особенности радиохимии
- •§ 4. Значение радиохимии
- •1 Общая радиохимия глава 2
- •§ 1. Общехимические свойства изотопных частиц
- •2. Термодинамическое поведение изотопных частиц
- •3. Кинетическое поведение изотопных частиц
- •Глава 3
- •§ 1. Классификация реакций изотопного обмена
- •§ 2. Причины протекания реакций изотопного обмена
- •3. Особенности реакций идеального изотопного обмена
- •§ 4. Основное уравнение кинетики реакций идеального изотопного обмена
- •§ 5. Основы экспериментальных методов исследования процессов изотопного обмена
- •Глава 4
- •§ 1. Состояние радиоактивных элементов [нуклидов] в жидкой фазе
- •§ 2. Процессы радиоколлоидообразования
- •§ 3. Основы экспериментальных методов исследования радиоколлоидов
- •Глава 5
- •§ 1. Закономерности процессов соосаждения с изотопными носителями
- •§ 2. Основные области применения изотопных носителей
- •§ 3. Принцип действия и закономерности процессов соосаждения со специфическими носителями
- •§ 4 Факторы, влияющие на процесс соосаждения со специфическими носителями
- •§ 5. Особенности процессов соосаждения со специфическими носителями
- •§ 6. Сокристаллизация со специфическими носителями при отсутствии изоморфизма 1 рода
- •§ 7. Основы экспериментальных методов исследования процессов соосаждения со специфическими носителями
- •§ 8. Основные области применения специфических носителей
- •Глава 6
- •§ 1. Первичная адсорбция
- •§ 2. Вторичная обменная адсорбция
- •§ 3. Закономерности процесса соосаждения с неспецифическими носителями
- •§ 4. Соосаждение с неспецифическими носителями при образовании внутренне-адсорбционных систем
- •§ 5. Основы экспериментальных методов исследования процессов соосаждения с неспецифическими носителями
- •§ 6. Основные области применения неспецифических носителей
- •§ 7. Методы разграничения различных видов соосаждения
- •Глава 7
- •§ 1. Закономерности и классификация экстракционных процессов
- •§ 3. Практическое использование процессов экстракции
- •Глава 8
- •§ 1. Основные закономерности хроматографических процессов Ионообменная хроматография.
- •Распределительная хроматография.
- •См.: Егоров е. В., Макарова с. Б. Ионный обмен в радиохимии. М., Атомиздат, 1971. § 2. Основы экспериментальных методов хроматографического исследования
- •См.: Роберте т. Радиохроматография. М., Мир, 1981. § 3. Примеры практического использования хроматографических методов в радиохимии
- •Глава 9
- •§ 1. Закономерности электрохимических процессов
- •§ 2 Особенности поведения радиоактивных элементов (нуклидов) при электрохимических процессах
- •§ 3. Основы экспериментальных методов исследования электрохимических процессов
- •§ 4. Использование электрохимических процессов в радиохимии
- •2 Химия радиоактивных элементов
- •Глава 10
- •§ 1. Технеций
- •§ 2. Прометий
- •§ 3. Полоний
- •§ 4. Астат
- •§ 5. Радон
- •§ 6. Франций
- •§ 7. Радий
- •Глава 11
- •§ 1. История открытия актиния и актиноидов
- •§ 2. Важнейшие изотопы актиния и актиноидов, методы их получения и идентификации
- •§ 3. Физические свойства актиния и актиноидов
- •§ 4. Актиний
- •§ 5. Торий
- •§ 6. Протактиний
- •§ 7. Уран, нептуний, плутоний и америций
- •§ 8. Трайсамерициевые актиноиды
- •Глава 12
- •§ 1. История открытия
- •§ 2 Методы получения и идентификации
- •3 Химические последствия радиоактивного распада
- •Глава 13
- •§ 1. История открытия ядерной изомерии
- •§ 2. Особенности явления ядерной изомерии
- •§ 3. Химические последствия изомерных переходов
- •§ 4. Практическое использование химических последствий изомерного перехода
- •Глава 14
- •§ 1. Теоретические аспекты химических последствий --распада
- •§ 2. Экспериментальные методы исследования химических последствий --распада
- •§ 3. Практическое использование химических последствий --распада
§ 3. Основы экспериментальных методов исследования электрохимических процессов
Методы определения электрохимических потенциалов радиоактивных элементов. Изучение поведения радиоактивных элементов при электрохимических процессах связано с рядом трудностей методического характера. Это прежде всего сложность приготовления обратимых электродов из радиоактивных элементов и невозможность прямого измерения их равновесных электродных потенциалов.
Прямой статический метод измерения электродного потенциала по отношению к электроду сравнения неприменим для систем, содержащих микроколичества радиоактивных элементов. Это обусловлено тем, что потенциал на границе электрод — раствор при низких концентрациях элемента определяется не исследуемой электродной реакцией с их участием, а другими компонентами системы, например ионами растворителя или растворенным в воде кислородом.
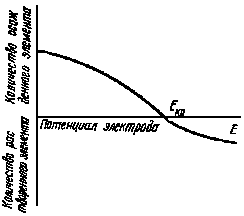
Динамический метод заключается в снятии поляризационных кривых (см. рис. 23), причем значение равновесного потенциала определяется по точке пересечения обратимой поляризационной кривой с линией нулевого тока. Этот метод также непригоден для измерения потенциала систем, содержащих микроколичества радиоактивных элементов или радиоактивных нуклидов. Это объясняется тем, что доля тока, расходуемого на разряд ионов радиоактивного элемента, ничтожно мала по сравнению с общей силой тока, обусловленнпй разрядом ионов растворителя и примесей. Следствием особенностей электрохимического поведения радиоактивных элементов является необходимость создания специальных методов определения их электрохимических потенциалов.
Как указывалось выше, эта задача может быть сведена к определению
|
|
Рис. 24. Зависимость скорости осаждения радиоактивного элемента от потенциала электрода. |
Рис. 25. Зависимость скорости осаждения (растворения)радиоактивного элемента от потенциала электрода. |
критических потенциалов осаждения радиоактивных элементов. Определение этих потенциалов осуществляется путем изучения зависимости: скорость осаждения радиоактивного элемента — потенциал. Эту зависимость можно рассматривать как поляризационную кривую, отвечающую процессу разряда на электроде ионов радиоактивного элемента. Действительно, скорость осаждения радиоактивного элемента прямо пропорциональна парциальной силе тока (тока, идущего только на данное превращение). В соответствии с первым законом Фарадея
mi = giIt = giQ и mi/t = giI, где mi — масса вещества, претерпевшего превращение, пропорциональная измеренной радиоактивности электрода (г); gi — фактор пропорциональности, называемый электрохимическим эквивалентем и показывающий, какая масса вещества претерпела превращение при прохождении через границу единицы количества электричества (г/Кл); I — сила тока (A); Q = It — количество электричества (Кл).
Скорость осаждения радиоактивного элемента при постоянном значении потенциала электрода определяется из зависимости: количество осажденного радиоактивного элемента — время. Скорость осаждения в произвольных единицах находят по наклону кривых в какой-либо одной точке или по массе осажденного радиоактивного элемента за один и тот же промежуток времени.
Значение критического потенциала осаждения радиоактивного элемента отвечает точке пересечения с осью абсцисс касательной, проведенной к кривой скорость осаждения — потенциал в точке перегиба (рис. 24).
Этот метод был предложен в 1914 г. Г. Хевеши и Ф. Панетом. Затем был усовершенствован в 1930 г. Ф. Жолио-Кюри с помощью сконструированного специального прибора, позволяющего вести наблюдение за скоростью осаждения радиоактивного элемента в процессе его выделения на электроде. Дальнейшее усовершенствование методики определения критического потенциала принадлежит Д. М. Зиву и Г. С. Синициной, которым удалось увеличить точность определения значений Екр до ± (0,002— 0,003) В, т. е. почти в 10 раз. Наиболее простым в практическом осуществлении является предложенный ими комбинированный метод. Неустойчивость потенциала исследуемого электрода во времени устранялась разделением катодного и анодного пространства и использованием в качестве второго электрода электролитической ячейки (анода в случае выделения на катоде и наоборот) обратимого окислительно-восстановительного электрода. Большая точность в определении Екр достигается измерением как скорости осаждения, так и скорости растворения радиоактивного элемента, выделенного на электроде (рис. 25). В этом случае критический потенциал осаждения отвечает точке пересечения экспериментальной кривой с осью абсцисс. Следует отметить, что этот прием возможен лишь при условии обратимости исследуемого электрода.
Трудности экспериментального определения критического потенциала осаждения радиоактивных элементов в равной мере относятся и к определению потенциалов окислительно-восстановительных электродов. При работе с микроколичествами радиоактивных элементов используется косвенный метод определения этих потенциалов. Суть метода сводится к следующему. Если в растворе находятся две окислительно-восстановительные системы ox1 + red2 red1 + ox2, то условию равновесия отвечает равенство их равновесных потенциалов:
Eox1/red1 = Eox2/red2.
Поскольку
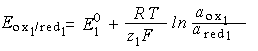
и
![]() ,
,
то
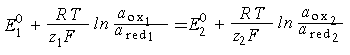 .
.
Если индекс 1 относится к известной макросистеме, а индекс 2 — к исследуемой микросистеме, то задача определения стандартного потенциала Е2 сводится к определению aох2, и ared2, радиохимическим методом. Например, определение стандартного потенциала ECf3+/Cf2+ было основано на исследовании равновесия
Cf3+ + Sm2+ Cf2+ + Sm3+.
Определение отношения aCf3+/Cf2+ осуществлялось радиометрически после отделения Cf2+ путем изоморфного соосаждения этой формы с SmCl2.
Электрохимические методы выделения и разделения радиоактивных элементов (нуклидов). Электрохимические выделение радиоактивных элементов и их разделение осуществляется методами цементации (контактного вытеснения металлов), электролиза и электромиграции.
Метод цементации включает электрохимическую реакцию окисления металла электрода Ме1 — z1е Me1z+ и электрохимическую реакцию восстановления выделяемого на электроде радиоактивного элемента Me2z2+ + z2е Me2. Процесс цементации, как и любая химическая реакция, протекает самопроизвольно при условии уменьшения свободной энергии Гиббса (G) в соответствии с уравнением
-G = zFE = zF(E2-E1), |
(9.1) |
где Е — ЭДС; E1 и Е2 — равновесные потенциалы реакций окисления металла электрода и восстановления ионов радиоактивного элемента до металлического состояния (критический потенциал осаждения радиоактивного элемента).
Как видно из соотношения (9.1), выделение радиоактивного элемента (или радиоактивного нуклида) методом цементации термодинамически возможно, если E1 < Е2.
Особое значение при выделении микроколичеств радиоактивных элементов имеют выбор материала электрода, величина поверхности и ее состояние. Влияние на процесс цементации природы материала электрода сказывается через его равновесный потенциал, поляризуемость (при анодном растворении) и способность к пассивации. Один и тот же металл при постоянной величине удельной поверхности может обладать различной электрохимической активностью, выражаемой долей реально участвующей в процессе цементации массы материала электрода. Для увеличения электрохимической активности электрода целесообразна его предварительная обработка (механическая, термическая и др.).
Важным преимуществом метода цементации являются его специфичность и простота аппаратурного оформления. К недостаткам метода следует отнести невозможность его использования для выделения электроотрицательных элементов и трудность отделения радиоактивных нуклидов от материала электрода (необходимость практически полного растворения электрода). С этой точки зрения наиболее удобными являются инертные электроды из серебра, платины, золота, сдвиг равновесных потенциалов которых достигается изменением концентрации ионов, относительно которых обратим электрод.
Эффективность использования метода электролиза для выделения радиоактивного элемента (или радиоактивного нуклида) определяется для каждой системы соотношением их критических потенциалов и равновесного потенциала водородного электрода. Элементы, критические потенциалы осаждения которых (с учетом их концентрации) более положительны, чем равновесный потенциал водородного электрода, могут быть выделены на катоде с выходом по току около 100%. Разделение этих элементов методом электролиза возможно, если их критические потенциалы осаждения отличаются друг от друга.
К факторам, влияющим на эффективность разделения элементов методом электролиза, относятся: плотность тока, материал электрода, состав электролита, температура процесса. Например, введение в электролит комплексообразующих реагентов часто позволяет увеличивать эффективность разделения элементов с близкими значениями Екр за счет различия в их способности к комплексообразованию.
Электроотрицательные элементы не могут быть выделены электролизом из водных растворов, так как потенциалы их выделения более отрицательны, чем потенциал выделения водорода. Для электрохимического выделения таких элементов используются электроды с высоким перенапряжением водорода (свинец, ртуть) или их осаждают путем электролиза расплавов. Так, для выделения металлического радия используется электролиз с ртутным катодом с последующей отгонкой ртути. Кроме того, для осаждения электроотрицательных радиоактивных элементов иногда используют образование ими трудно-растворимых соединений с продуктами электролиза. В частности, актиноиды выделяют на катоде в виде тонкого слоя гидроксидов за счет увеличения рН в прикатодном слое. Этот метод получил название «электролитического гидролиза». Достоинством метода электролиза является образование равномерных, прочно сцепленных с поверхностью электрода слоев осаждаемого радиоактивного элемента (или радиоактивного нуклида). Поэтому метод электролиза широко используется также для приготовления радиоактивных источников.
Электрохимическое разделение элементов методом электромиграции основано на различии в скоростях движения ионов в электрическом поле. Движение заряженных частиц сферической формы при приложении к раствору электрического поля подчиняется уравнению Стокса:
zF = 6rb, |
(9.2) |
где z и r — заряд и радиус частицы; Е — напряженность электрического поля (В/м); b — подвижность иона (м2/Bс); — вязкость (Пас). Как видно из уравнения (9.2), в среде данного состава подвижность иона пропорциональна отношению z/r.
Эффективность разделения элементов методом электромиграции определяется различием их подвижностей. В тех случаях, когда подвижности ионов разделяемых элементов очень близки, например при разделении актиноидных элементов, увеличение эффективности разделения может быть достигнуто добавлением комплексообразующих реагентов. При условии, что скорость установления равновесия процесса комплексообразования велика по сравнению со скоростью электромиграционного переноса, наблюдается общая зона движения каждого из разделяемых элементов, включающая все его химические формы.
|
Рис. 26. Схема непрерывного электрофореза: 1 - направление электрического поля; 2 - направление потока фонового электролита |
bMe cMe = bMez+ cMez+ + ni=1bMe Ai cMe Ai,
где cMe — общая аналитическая концентрация элемента.
Разделение элементов методом электромиграции осуществляется обычно в пористом наполнителе (стеклянном порошке, крахмале, агар-агаре), пропитанном электролитом. На рис. 26 представлена схема разделения элементов одним из вариантов метода электромиграции, называемым методом, непрерывного электрофореза. В этом варианте метода движение электролита происходит под прямым углом к наравлению электрического поля; смесь разделяемых элементов подается на узком участке.