
- •В.Д.Нефедов е.Н.Текстер м.А.Торопова радиохимия
- •Глава 1
- •§ 1. Предмет радиохимии
- •§ 2. Краткий очерк истории развития радиохимии
- •§ 3. Особенности радиохимии
- •§ 4. Значение радиохимии
- •1 Общая радиохимия глава 2
- •§ 1. Общехимические свойства изотопных частиц
- •2. Термодинамическое поведение изотопных частиц
- •3. Кинетическое поведение изотопных частиц
- •Глава 3
- •§ 1. Классификация реакций изотопного обмена
- •§ 2. Причины протекания реакций изотопного обмена
- •3. Особенности реакций идеального изотопного обмена
- •§ 4. Основное уравнение кинетики реакций идеального изотопного обмена
- •§ 5. Основы экспериментальных методов исследования процессов изотопного обмена
- •Глава 4
- •§ 1. Состояние радиоактивных элементов [нуклидов] в жидкой фазе
- •§ 2. Процессы радиоколлоидообразования
- •§ 3. Основы экспериментальных методов исследования радиоколлоидов
- •Глава 5
- •§ 1. Закономерности процессов соосаждения с изотопными носителями
- •§ 2. Основные области применения изотопных носителей
- •§ 3. Принцип действия и закономерности процессов соосаждения со специфическими носителями
- •§ 4 Факторы, влияющие на процесс соосаждения со специфическими носителями
- •§ 5. Особенности процессов соосаждения со специфическими носителями
- •§ 6. Сокристаллизация со специфическими носителями при отсутствии изоморфизма 1 рода
- •§ 7. Основы экспериментальных методов исследования процессов соосаждения со специфическими носителями
- •§ 8. Основные области применения специфических носителей
- •Глава 6
- •§ 1. Первичная адсорбция
- •§ 2. Вторичная обменная адсорбция
- •§ 3. Закономерности процесса соосаждения с неспецифическими носителями
- •§ 4. Соосаждение с неспецифическими носителями при образовании внутренне-адсорбционных систем
- •§ 5. Основы экспериментальных методов исследования процессов соосаждения с неспецифическими носителями
- •§ 6. Основные области применения неспецифических носителей
- •§ 7. Методы разграничения различных видов соосаждения
- •Глава 7
- •§ 1. Закономерности и классификация экстракционных процессов
- •§ 3. Практическое использование процессов экстракции
- •Глава 8
- •§ 1. Основные закономерности хроматографических процессов Ионообменная хроматография.
- •Распределительная хроматография.
- •См.: Егоров е. В., Макарова с. Б. Ионный обмен в радиохимии. М., Атомиздат, 1971. § 2. Основы экспериментальных методов хроматографического исследования
- •См.: Роберте т. Радиохроматография. М., Мир, 1981. § 3. Примеры практического использования хроматографических методов в радиохимии
- •Глава 9
- •§ 1. Закономерности электрохимических процессов
- •§ 2 Особенности поведения радиоактивных элементов (нуклидов) при электрохимических процессах
- •§ 3. Основы экспериментальных методов исследования электрохимических процессов
- •§ 4. Использование электрохимических процессов в радиохимии
- •2 Химия радиоактивных элементов
- •Глава 10
- •§ 1. Технеций
- •§ 2. Прометий
- •§ 3. Полоний
- •§ 4. Астат
- •§ 5. Радон
- •§ 6. Франций
- •§ 7. Радий
- •Глава 11
- •§ 1. История открытия актиния и актиноидов
- •§ 2. Важнейшие изотопы актиния и актиноидов, методы их получения и идентификации
- •§ 3. Физические свойства актиния и актиноидов
- •§ 4. Актиний
- •§ 5. Торий
- •§ 6. Протактиний
- •§ 7. Уран, нептуний, плутоний и америций
- •§ 8. Трайсамерициевые актиноиды
- •Глава 12
- •§ 1. История открытия
- •§ 2 Методы получения и идентификации
- •3 Химические последствия радиоактивного распада
- •Глава 13
- •§ 1. История открытия ядерной изомерии
- •§ 2. Особенности явления ядерной изомерии
- •§ 3. Химические последствия изомерных переходов
- •§ 4. Практическое использование химических последствий изомерного перехода
- •Глава 14
- •§ 1. Теоретические аспекты химических последствий --распада
- •§ 2. Экспериментальные методы исследования химических последствий --распада
- •§ 3. Практическое использование химических последствий --распада
Глава 8
ХРОМАТОГРАФИЧЕСКИЕ ПРОЦЕССЫ В РАДИОХИМИИ
Различные методы хроматографии широко используются как для исследования состояния радиоактивных элементов (нуклидов), так и для разделения сложных смесей радиоактивных веществ.
Хроматографические методы являются физико-химическими методами разделения веществ в динамических условиях. Компоненты разделяемой смеси распределяются между двумя фазами, одна из которых неподвижна и имеет большую поверхность, вторая — подвижна и представляет собой поток жидкости (или газа), находящийся в контакте с неподвижным слоем.
Классификация хроматографических методов, наиболее широко используемых в радиохимии, по механизму элементарного акта, по агрегатному состоянию систем, в которых производится разделение, и по характеру осуществления процесса может быть представлена следующей схемой:
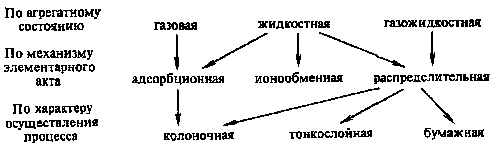 .
.
Характерной особенностью всех видов хроматографии является многократность повторения элементарных актов, например сорбции — десорбции, экстракции —реэкстракции и др. Это обусловливает высокую эффективность хроматографических методов для разделения близких по химическим свойствам элементов (актиноидов, лантаноидов, элементов-аналогов и др.).
§ 1. Основные закономерности хроматографических процессов Ионообменная хроматография.
Механизмом элементарного акта ионообменной хроматографии является гетерогенный обратимый стехиометрический обмен между ионами в растворе и подвижными ионами, находящимися в твердой фазе ионита. Так, например, на катионите R - An-H+ + Na+ + Cl- R - An-Na+ + H+ + Cl- на анионите R - Kt+Cl- + Na+ + Br- R - Kt+Br- + Na+ + Cl-, где R — полимерный радикал, образующий вместе с фиксированной (неподвижной) ионогенной группой An- или Kt+ каркас ионита; -Аn-Н+ и —Kt+Cl- — функциональные группы ионита; Н+ и С1- — противоионы (подвижные ионы), соответственно, катионита и анионита.
Процесс ионного обмена можно рассматривать как гетерогенную химическую реакцию двойного обмена:
zB AzA + zA BzB zB AzA + zA BzB.
Чертой сверху отмечены ионы, находящиеся в фазе ионита. В соответствии с законом действующих масс
Kp = aBzA aA zB / aAzB aB zA, |
(8.1) |
где a и а — термодинамические активности обменивающихся ионов в растворе и фазе ионита. После простых математических преобразований выражение (8.1) может быть представлено в виде
|
(8.2) |
где KAB = (Kp)1/zA zB.
В радиохимических исследованиях, как правило, термодинамические активности ионов можно заменить их концентрациями. Тогда уравнение (8.2) может быть переписано в виде
|
(8.3) |
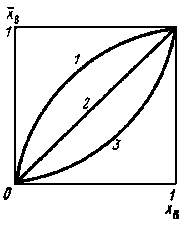
где КAB — концентрационная константа обмена, являющаяся мерой сродства обменивающихся ионов к иониту. Это соотношение известно под названием уравнения изотермы ионного обмена Б. П. Никольского.
|
Рис. 13. Изотермы ионного обмена: 1 - KAB > 1; 2 - KAB < 1; 3 - KAB < 1. |
В ионном обмене могут одновременно участвовать три и более ионов, причем любой обмен пары ионов протекает независимо от других и описывается уравнением (8.3).
Помимо концентрационной константы обмена характеристикой избирательности ионного обмена может служить коэффициент распределения, равный отношению концентраций распределяющегося элемента в фазе ионита и в растворе:
|
(8.4) |
Чем больше значение для обменивающегося иона, тем больше его сродство к иониту.
Отношение коэффициентов распределения обменивающихся ионов называется коэффициентом разделения ():
= 1/2, |
(8.5) |
где 1 > 2.
Эффективность разделения методом ионообменной хроматографии (в отсутствие комплексообразующих агентов) зависит от химической природы разделяемых ионов, типа ионита и условий разделения. Сродство иона к иониту возрастает с увеличением отношения заряда к радиусу гидратированного иона. Аномальное положение в этом ряду занимают ионы Н+ (для катионитов типа слабой кислоты) или ОН- (для анионитов типа слабого основания). Так, в ряду щелочных металлов сродство к иониту увеличивается от лития к францию по мере уменьшения радиуса гидратированных ионов. Однако в концентрированных растворах, например в концентрированном растворе НС1 (12 моль/л), имеет место обращение ряда вследствие дегидратации ионов. Повышение температуры увеличивает скорость диффузионных процессов и, следовательно, скорость установления равновесия. И, наконец, эффективность ионообменных разделений в равновесных условиях возрастает с увеличением числа элементарных актов. Чем их больше, тем более узки пики разделяемых веществ на хроматограмме и тем лучше разделение.
В тех случаях, когда различия в сродстве к иониту разделяемых компонентов (например, транскюриевых актиноидных или редкоземельных элементов) очень малы, используется комплексообразовательная ионообменная хроматография. Эффективность разделения элементов в этом случае обусловлена избирательностью их связывания в непоглощаемый ионитом комплексный ион.
Рассмотрим в качестве примера разделение этим методом берклия и калифорния на катионите КУ-2 с использованием в качестве элюента раствора (NH4)2H2Y (Y = ЭДТА). Коэффициент разделения этих элементов.
|
(8.6) |
Концентрации берклия и калифорния в фазе ионита можно выразить в соответствии с законом действующих масс следующим образом:
|
(8.7) |
и
|
(8.8) |
Концентрации обоих элементов в растворе элюента, в котором они находятся в виде непоглощаемых катионитом ионов типа [МУ]-, можно выразить через значения констант устойчивости этих ионов ():
cBk = [BkY-] = Bk[Bk3+][Y4-], cCf = [CfY-] = Cf[Cf3+][Y4-], |
(8.9) (8.10) |
где Bk, Cf—константы устойчивости комплексов. Подставив выражения (8.7)—(8.10) в (8.6), получаем
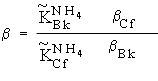 .
.
Поскольку концентрационные константы обмена для элементов, близких по химическим свойствам, практически не отличаются, то отношение
![]() .
.
Таким образом, коэффициент разделения тем больше, чем больше различие в константах устойчивости образующихся в растворе комплексных анионов.
Метод комплексообразовательной хроматографии может применяться в двух вариантах. Когда избирательность комплексообразования не очень велика, вымывание осуществляют раствором одного реагента постоянной или постепенно изменяющейся концентрации (например, при разделении лантаноидов или транскюриевых актиноидов). Если избирательность велика, то можно использовать специфические реагенты для каждого из разделяемых компонентов.
В качестве ионитов в радиохимии наиболее широко используются иониты на основе синтетических смол, а также неорганические иониты: природные минеральные сорбенты (цеолиты, глинистые материалы слоистой структуры, природные минералы и т. д.) и синтетические неорганические иониты (труднорастворимые оксиды и гидроксиды алюминия, титана, циркония и других тяжелых металлов, сорбенты на основе труднорастворимых солей тяжелых металлов, например фосфат циркония, соли гетерополикислот, окисленные угли и т.д.)*
Процесс ионного обмена включает: 1) диффузию обменивающихся ионов в пленке, прилегающей к зерну ионита и не разрушающейся при перемешивании и протекании раствора; 2) собственно химический обмен ионов, который, как правило, протекает очень быстро и не является скоростьопрсдсляющей стадией; 3) диффузию ионов внутри зерна ионита.
В разбавленных растворах (с < 0,01 моль/л) на ионитах с высокой емкостью и малым числом поперечных связей суммарная скорость процесса ионного обмена определяется скоростью диффузии в пленке (режим пленочной внешнедиффузионной кинетики).
В концентрированных растворах (с > 0,05 моль/л) и на ионитах с большим числом поперечных связей суммарная скорость ионного обмена определяется скоростью диффузии в зерне (режим гелевой внутридиффузионной кинетики).
Выгоднее вести процесс в режиме пленочной внешнедиффузионной кинетики. Этому способствуют большая емкость ионита и высокая степень его дисперсности, низкая концентрация протекающего раствора и небольшая скорость его пропускания через ионит. Кроме того, необходимо иметь в виду, что скорость ионного обмена возрастает с увеличением температуры и уменьшением степени поперечной связанности ионита.

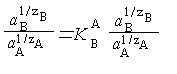 ,
,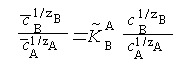 ,
,
 ,
,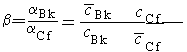 .
. ,
,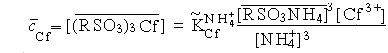 .
.