
- •В.Д.Нефедов е.Н.Текстер м.А.Торопова радиохимия
- •Глава 1
- •§ 1. Предмет радиохимии
- •§ 2. Краткий очерк истории развития радиохимии
- •§ 3. Особенности радиохимии
- •§ 4. Значение радиохимии
- •1 Общая радиохимия глава 2
- •§ 1. Общехимические свойства изотопных частиц
- •2. Термодинамическое поведение изотопных частиц
- •3. Кинетическое поведение изотопных частиц
- •Глава 3
- •§ 1. Классификация реакций изотопного обмена
- •§ 2. Причины протекания реакций изотопного обмена
- •3. Особенности реакций идеального изотопного обмена
- •§ 4. Основное уравнение кинетики реакций идеального изотопного обмена
- •§ 5. Основы экспериментальных методов исследования процессов изотопного обмена
- •Глава 4
- •§ 1. Состояние радиоактивных элементов [нуклидов] в жидкой фазе
- •§ 2. Процессы радиоколлоидообразования
- •§ 3. Основы экспериментальных методов исследования радиоколлоидов
- •Глава 5
- •§ 1. Закономерности процессов соосаждения с изотопными носителями
- •§ 2. Основные области применения изотопных носителей
- •§ 3. Принцип действия и закономерности процессов соосаждения со специфическими носителями
- •§ 4 Факторы, влияющие на процесс соосаждения со специфическими носителями
- •§ 5. Особенности процессов соосаждения со специфическими носителями
- •§ 6. Сокристаллизация со специфическими носителями при отсутствии изоморфизма 1 рода
- •§ 7. Основы экспериментальных методов исследования процессов соосаждения со специфическими носителями
- •§ 8. Основные области применения специфических носителей
- •Глава 6
- •§ 1. Первичная адсорбция
- •§ 2. Вторичная обменная адсорбция
- •§ 3. Закономерности процесса соосаждения с неспецифическими носителями
- •§ 4. Соосаждение с неспецифическими носителями при образовании внутренне-адсорбционных систем
- •§ 5. Основы экспериментальных методов исследования процессов соосаждения с неспецифическими носителями
- •§ 6. Основные области применения неспецифических носителей
- •§ 7. Методы разграничения различных видов соосаждения
- •Глава 7
- •§ 1. Закономерности и классификация экстракционных процессов
- •§ 3. Практическое использование процессов экстракции
- •Глава 8
- •§ 1. Основные закономерности хроматографических процессов Ионообменная хроматография.
- •Распределительная хроматография.
- •См.: Егоров е. В., Макарова с. Б. Ионный обмен в радиохимии. М., Атомиздат, 1971. § 2. Основы экспериментальных методов хроматографического исследования
- •См.: Роберте т. Радиохроматография. М., Мир, 1981. § 3. Примеры практического использования хроматографических методов в радиохимии
- •Глава 9
- •§ 1. Закономерности электрохимических процессов
- •§ 2 Особенности поведения радиоактивных элементов (нуклидов) при электрохимических процессах
- •§ 3. Основы экспериментальных методов исследования электрохимических процессов
- •§ 4. Использование электрохимических процессов в радиохимии
- •2 Химия радиоактивных элементов
- •Глава 10
- •§ 1. Технеций
- •§ 2. Прометий
- •§ 3. Полоний
- •§ 4. Астат
- •§ 5. Радон
- •§ 6. Франций
- •§ 7. Радий
- •Глава 11
- •§ 1. История открытия актиния и актиноидов
- •§ 2. Важнейшие изотопы актиния и актиноидов, методы их получения и идентификации
- •§ 3. Физические свойства актиния и актиноидов
- •§ 4. Актиний
- •§ 5. Торий
- •§ 6. Протактиний
- •§ 7. Уран, нептуний, плутоний и америций
- •§ 8. Трайсамерициевые актиноиды
- •Глава 12
- •§ 1. История открытия
- •§ 2 Методы получения и идентификации
- •3 Химические последствия радиоактивного распада
- •Глава 13
- •§ 1. История открытия ядерной изомерии
- •§ 2. Особенности явления ядерной изомерии
- •§ 3. Химические последствия изомерных переходов
- •§ 4. Практическое использование химических последствий изомерного перехода
- •Глава 14
- •§ 1. Теоретические аспекты химических последствий --распада
- •§ 2. Экспериментальные методы исследования химических последствий --распада
- •§ 3. Практическое использование химических последствий --распада
§ 2. Вторичная обменная адсорбция
Вторичная обменная адсорбция является результатом обмена ионов во внешней обкладке двойного электрического слоя носителя на одноименно заряженные ионы, находящиеся в растворе.
Рассмотрим наиболее простой случай вторичной обменной адсорбции — на поверхности ионных кристаллов. Нарушение стехиометрии на поверхностном слое кристалла за счет первичной потенциалобразующеи адсорбции приводит к соответствующему нарушению стехиометрии в прилегающем слое раствора — к возникновению внешней обкладки двойного слоя. Это означает, что в прилегающем слое раствора концентрируются ионы со знаком заряда, противоположным знаку заряда поверхности (компенсирующие ионы). Если осадок неспецифического носителя находится в его насыщенном растворе, содержащем ионы радиоактивного элемента (или радиоактивного нуклида), то в образовании внешней обкладки двойного слоя принимают участие и эти ионы.
Перенос ионов радиоактивного элемента из объема раствора во внешнюю обкладку двойного электрического слоя получил название вторичной обменной адсорбции.
Так, процесс вторичной адсорбции 234Th4+ на осадке BaSO4 можно представить следующей схемой:
В процессе вторичной адсорбции могут принимать участие все находящиеся в растворе ионы со знаком заряда, противоположным знаку заряда поверхности кристалла (т. е. одинаковым с ионами, находящимися во внешней обкладке двойного слоя).
Если наряду с ионами радиоактивного элемента AzA в растворе находятся ионы других электролитов: ВzB, CzC, YzY (где zA, zB, zC, ... zY — их заряд), то процессы конкурентного замещения ионов радиоактивного элемента всеми остальными одноименно заряженными ионами можно представить следующим образом:
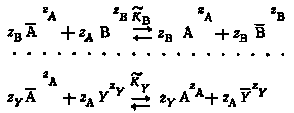
Черта над символом указывает местонахождение ионов во внешней обкладке двойного слоя.
KB .. KY— концентрационные константы равновесия соответствующих реакций.
Полагая, что все ионы, кроме ионов радиоактивного элемента, одновалентны, уравнения реакций можно записать следующим образом:
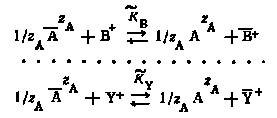
В результате взаимодействия между ионами, находящимися во внешней обкладке двойного слоя и в растворе, достигается состояние равновесия.
Обозначим равновесные концентрации ионов во внешней обкладке и в растворе соответственно через mA, mB, ... mY и mA, mB ... , mY.
На основании закона действующих масс для каждой из приведенных выше реакций имеем:
|
(6.7) |
Суммируя левые и правые части этих уравнений как дроби с одинаковыми знаменателями, получаем:
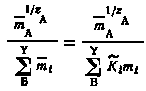
или
|
(6.8) |
где![]() - суммарная концентрация ионов во внешней
обкладке двойного слоя, так как
концентрация радиоактивного элемента
- суммарная концентрация ионов во внешней
обкладке двойного слоя, так как
концентрация радиоактивного элемента
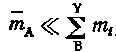
Суммарная концентрация ионов во внешней обкладке двойного слоя может быть выражена через избыточный заряд, приходящийся на единицу объема внешней обкладки:
|
(6.9) |
где Сi — заряд внешней обкладки двойного слоя; V — объем внешней обкладки двойного слоя.
Из уравнений (6.8) и (6.9) получаем
|
(6.10) |
Наиболее часто употребляемой характеристикой процесса адсорбции является значение коэффициента адсорбции, определяемого отношением х/(1 — х), где х — доля адсорбированного радиоактивного элемента, (1 — х) — доля радиоактивного элемента, оставшегося в растворе.
Коэффициент адсорбции радиоактивного элемента связан с его равновесными концентрациями во внешней обкладке двойного слоя и в растворе следующим образом:
|
(6.11) |
где V - объем раствора. Тогда
|
(6.12) |
Подставляя значение mA/mA из выражения (6.12) в соотношение (6.10), получим
|
(6.13) |
Это соотношение получило название уравнения вторичной обменной адсорбции.

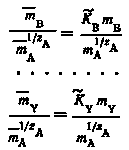 .
. ,
,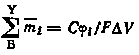 ,
,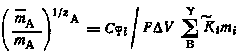 .
.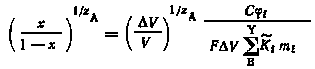 .
.