- •В.Д.Нефедов е.Н.Текстер м.А.Торопова радиохимия
- •Глава 1
- •§ 1. Предмет радиохимии
- •§ 2. Краткий очерк истории развития радиохимии
- •§ 3. Особенности радиохимии
- •§ 4. Значение радиохимии
- •1 Общая радиохимия глава 2
- •§ 1. Общехимические свойства изотопных частиц
- •2. Термодинамическое поведение изотопных частиц
- •3. Кинетическое поведение изотопных частиц
- •Глава 3
- •§ 1. Классификация реакций изотопного обмена
- •§ 2. Причины протекания реакций изотопного обмена
- •3. Особенности реакций идеального изотопного обмена
- •§ 4. Основное уравнение кинетики реакций идеального изотопного обмена
- •§ 5. Основы экспериментальных методов исследования процессов изотопного обмена
- •Глава 4
- •§ 1. Состояние радиоактивных элементов [нуклидов] в жидкой фазе
- •§ 2. Процессы радиоколлоидообразования
- •§ 3. Основы экспериментальных методов исследования радиоколлоидов
- •Глава 5
- •§ 1. Закономерности процессов соосаждения с изотопными носителями
- •§ 2. Основные области применения изотопных носителей
- •§ 3. Принцип действия и закономерности процессов соосаждения со специфическими носителями
- •§ 4 Факторы, влияющие на процесс соосаждения со специфическими носителями
- •§ 5. Особенности процессов соосаждения со специфическими носителями
- •§ 6. Сокристаллизация со специфическими носителями при отсутствии изоморфизма 1 рода
- •§ 7. Основы экспериментальных методов исследования процессов соосаждения со специфическими носителями
- •§ 8. Основные области применения специфических носителей
- •Глава 6
- •§ 1. Первичная адсорбция
- •§ 2. Вторичная обменная адсорбция
- •§ 3. Закономерности процесса соосаждения с неспецифическими носителями
- •§ 4. Соосаждение с неспецифическими носителями при образовании внутренне-адсорбционных систем
- •§ 5. Основы экспериментальных методов исследования процессов соосаждения с неспецифическими носителями
- •§ 6. Основные области применения неспецифических носителей
- •§ 7. Методы разграничения различных видов соосаждения
- •Глава 7
- •§ 1. Закономерности и классификация экстракционных процессов
- •§ 3. Практическое использование процессов экстракции
- •Глава 8
- •§ 1. Основные закономерности хроматографических процессов Ионообменная хроматография.
- •Распределительная хроматография.
- •См.: Егоров е. В., Макарова с. Б. Ионный обмен в радиохимии. М., Атомиздат, 1971. § 2. Основы экспериментальных методов хроматографического исследования
- •См.: Роберте т. Радиохроматография. М., Мир, 1981. § 3. Примеры практического использования хроматографических методов в радиохимии
- •Глава 9
- •§ 1. Закономерности электрохимических процессов
- •§ 2 Особенности поведения радиоактивных элементов (нуклидов) при электрохимических процессах
- •§ 3. Основы экспериментальных методов исследования электрохимических процессов
- •§ 4. Использование электрохимических процессов в радиохимии
- •2 Химия радиоактивных элементов
- •Глава 10
- •§ 1. Технеций
- •§ 2. Прометий
- •§ 3. Полоний
- •§ 4. Астат
- •§ 5. Радон
- •§ 6. Франций
- •§ 7. Радий
- •Глава 11
- •§ 1. История открытия актиния и актиноидов
- •§ 2. Важнейшие изотопы актиния и актиноидов, методы их получения и идентификации
- •§ 3. Физические свойства актиния и актиноидов
- •§ 4. Актиний
- •§ 5. Торий
- •§ 6. Протактиний
- •§ 7. Уран, нептуний, плутоний и америций
- •§ 8. Трайсамерициевые актиноиды
- •Глава 12
- •§ 1. История открытия
- •§ 2 Методы получения и идентификации
- •3 Химические последствия радиоактивного распада
- •Глава 13
- •§ 1. История открытия ядерной изомерии
- •§ 2. Особенности явления ядерной изомерии
- •§ 3. Химические последствия изомерных переходов
- •§ 4. Практическое использование химических последствий изомерного перехода
- •Глава 14
- •§ 1. Теоретические аспекты химических последствий --распада
- •§ 2. Экспериментальные методы исследования химических последствий --распада
- •§ 3. Практическое использование химических последствий --распада
§ 8. Основные области применения специфических носителей
Одним из наиболее интересных применений специфических носителей является использование их для установления принадлежности радиоактивного нуклида, выделенного из природных объектов (например, Франция) или полученного в результате ядерных реакций (например, технеция), определенному радиоактивному элементу. Исключительно важную роль сыграли процессы соосаждения со специфическими носителями для идентификации радиоактивных элементов (технеция, протактиния, актиния и др.).
Рассмотрим несколько примеров использования специфических носителей для этой цели. Как известно, возникновение радиохимии как науки связано с открытием радия. М. Кюри обнаружила, что некоторые урановые руды обладают значительно большей радиоактивностью, чем чистый уран и его соединения. Химическое разделение природных образований урана на составные части привело к открытию двух новых элементов — полония и радия. Последний был обнаружен в бариевой фракции и изолирован в чистом виде путем дробной кристаллизации хлоридов бария и радия. Исходя из того, что радий, находясь в растворе в виде ничтожных примесей, изоморфно соосаждается со всеми солями бария, М.Кюри пришла к заключению, что он является ближайшим аналогом этого элемента.
Процессы изоморфной сокристаллизации были использованы О. Ханом для поисков стабильного изотопа радия, существование которого он считал вероятным. Для этой цели несколько сот килограммов бариевого минерала витте-рита было переработано в бромид бария, который подвергался затем длительному процессу дробной кристаллизации; в результате была получена конечная фракция массой всего около 40 мг. Интегральный коэффициент обогащения по расчетным данным должен был составить 510-5, но в полученных кристаллах бромида бария радий спектроскопически обнаружить не удалось. Учитывая, что спектральный анализ позволяет установить присутствие радия при соотношении Ra : Ва == 1 : 104, ясно, что в результате концентрирования был получен препарат BaBi2 с менее благоприятным соотношением Ra : Ва. Отсюда был сделан вывод, что если стабильный изотоп радия и существует, то содержание его в виттерите не должно превышать 210-5 г на 1г Ва.
Сложность открытия технеция была обусловлена необходимостью его получения искусственным путем и трудностью идентификации. Масса технеция, образующегося по ядерной реакции 9442Mo(d,n) 9543Tc, не превышала 10-10 г, в связи с чем обычные химические методы идентификации не могли быть использованы. Идентификация технеция была осуществлена с использованием метода специфических носителей. Выбор носителя был предопределен положением технеция в периодической системе, предсказанным Д. И. Менделеевым. Следовало ожидать, что наиболее характерной химической формой технеция является пертехнат-ион ТсО-4. Поэтому в качестве сп ецифического носителя должна быть использована идентичная химическая форма ближайшего аналога в периодической системе — рения.
Облученную молибденовую мишень растворяли в условиях, обеспечивающих переведение технеция в форму ТсО-4. После внесения носителя осуществлял лось соосаждение технеция с CsReO4. Исследование этого процесса показало, что в данном случае имело место образование истинных смешанных кристаллов, на основании чего был сделан вывод о принадлежности изучаемого радиоактивного нуклида элементу № 43.
Другая область использования специфических носителей связана с установлением химической формы существования радиоактивных. элементов в крайне разбавленных растворах.
Рассмотрим несколько примеров использования процессов изоморфной сокристаллизации для решения вопроса о валентном состоянии, составе и структуре соединений радиоактивных элементов, присутствующих в изучаемых системах в ничтожно малых количествах.
Как уже указывалось, закон распределения вещества между твердой и жидкой фазами приложим, строго говоря, лишь к истинно изоморфным веществам, что позволило В. Г. Хлопину сформулировать следующее правило:
если распределение микрокомпонента между твердой кристаллической фазой и раствором происходит строго по закону распределения вещества между двумя несмешивающимися растворителями и коэффициент кристаллизации остается постоянной величиной при изменении в широких пределах концентраций распределяющегося вещества, то это может служить доказательством того, что на данную пару веществ можно распространить закон Митчерлиха, т. е. сделать заключение о сходстве химического состава и молекулярной структуры макро- и микрокомпонента.
Это правило позволяет использовать результаты изучения распределения микрокомпонента и закон Митчерлиха в химии радиоактивных элементов, которые мы не можем получать в весомых количествах, поскольку они не имеют долгоживущих изотопов.
Впервые В Г Хлопин и А. Г. Самарцева воспользовались этим правилом для доказательства существования производных двухвалентного полония. Из металлического теллура, содержащего ничтожные по массе количества полония, был синтезирован теллурид натрия по схеме
Te + 2NaOH + H2O = Na2TeO3 + 2H2 Na2TeO3 + 3Na2S2O4 + 6NaOH = Na2Te + 6Na2SO3 + 3H2O
Аналогичные реакции должны происходить и с полонием. Чтобы установить это, теллурид натрия кристаллизовался из щелочных растворов, содержащих. микроколичества полония, в присутствии сильного восстановителя Na2S2O4. Подробное количественное изучение процесса соосаждения показало, что он происходит в полном соответствии с законом распределения вещества между твердой кристаллической фазой и раствором. Из этого вытекало, что полоний кристаллизуется изоморфно с теллуридом натрия и, следовательно, образует аналогично построенное соединение Na2Po, в котором полоний, как и теллур, является двухвалентным. Этот вывод был подтвержден прямым синтезом органических производных двухвалентного полония.
В дальнейшем А. Г. Самарцева, пользуясь тем же методом, доказала существование соединений шестивалентного полония. До этих исследований имелись лишь косвенные указания на возможность существования подобного рода соединений.
Метод изоморфной сокристаллизации с успехом использовался также для установления химической формы соединения радона с фтором и для идентификации необычных низших валентных состояний трансурановых элементов (калифорния, менделевия и др.); Третьим направлением использования процессов соосаждения со специфическими носителями является избирательное выделение и концентрирование радиоактивных элементов. Избирательное выделение радиоактивных элементов наилучшим образом решается путем подбора систем с максимальным значением коэффициента кристаллизации и минимальной растворимостью соединения-носителя. При этом для исключения адсорбционных процессов необходимо создание условий, обеспечивающих образование кристаллической фазы с малоразвитой поверхностью.
Процессы сокристаллизации находят применение не только для выделения в твердую фазу микроколичеств радиоактивных элементов (нуклидов), но и для отделения последних от вещества специфического носителя. Поскольку химические свойства соосаждающегося вещества и вещества-носителя очень близки, то разделение их обычными химическими методами не приводит к удовлетворительным результатам. Для отделения радиоактивных элементов от специфических носителей был разработан специальный метод, получивший название дробной кристаллизации. Суть дробной кристаллизации заключается в проведении большого числа стадий кристаллизации с разделением на каждой стадии жидкой и твердой фаз. Если D > 1, то осадки будут обогащаться, а растворы обедняться радиоактивным элементом.
Процесс дробной
кристаллизации характеризуется обычно
не коэффициентом кристаллизации, а
коэффициентом обогащения твердой фазы
![]() (или
коэффициентом объединения раствора
(или
коэффициентом объединения раствора
![]() ).
Коэффициент обогащения зависит от
коэффициента кристаллизации и возрастает
с увеличением D,
и осаждаемой доли носителя (рис. 5).
).
Коэффициент обогащения зависит от
коэффициента кристаллизации и возрастает
с увеличением D,
и осаждаемой доли носителя (рис. 5).
При одинаковых значениях D, и равных долях осаждаемого носителя процент осажденного радиоактивного элемента существенно
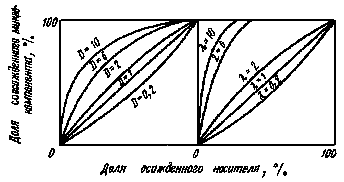 Рис.
5.Зависимость доли соосажденного
радиоактивного элемента от количества
соосажденного носителя.
Рис.
5.Зависимость доли соосажденного
радиоактивного элемента от количества
соосажденного носителя.
больше в случае логарифмического распределения. Однако в реальных условиях процесс дробной кристаллизации проводится по закону Хлопина ввиду более легкого практического осуществления.
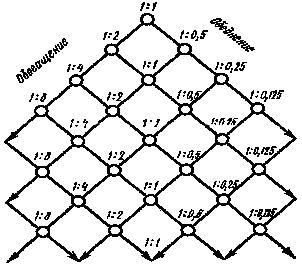
|
Рис. 6. Схема дробной кристаллизации хлоридов радия и бария. |
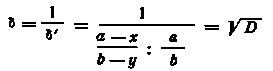 ,
а
доля осаждаемого в каждой ступени
носителя
,
а
доля осаждаемого в каждой ступени
носителя
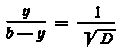 .
.
Не останавливаясь подробно на рассмотрении других важных применений процесса соосаждения со специфическими носителями отметим лишь, что с ними связано развитие многих областей современной науки и производства (получение веществ с требуемыми свойствами. катализаторов, люминофоров, полупроводниковых материалов и др.), изучение миграции микроэлементов и т.д.