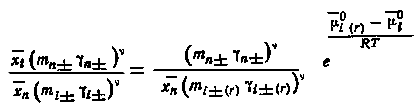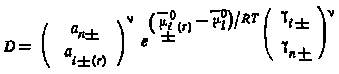- •В.Д.Нефедов е.Н.Текстер м.А.Торопова радиохимия
- •Глава 1
- •§ 1. Предмет радиохимии
- •§ 2. Краткий очерк истории развития радиохимии
- •§ 3. Особенности радиохимии
- •§ 4. Значение радиохимии
- •1 Общая радиохимия глава 2
- •§ 1. Общехимические свойства изотопных частиц
- •2. Термодинамическое поведение изотопных частиц
- •3. Кинетическое поведение изотопных частиц
- •Глава 3
- •§ 1. Классификация реакций изотопного обмена
- •§ 2. Причины протекания реакций изотопного обмена
- •3. Особенности реакций идеального изотопного обмена
- •§ 4. Основное уравнение кинетики реакций идеального изотопного обмена
- •§ 5. Основы экспериментальных методов исследования процессов изотопного обмена
- •Глава 4
- •§ 1. Состояние радиоактивных элементов [нуклидов] в жидкой фазе
- •§ 2. Процессы радиоколлоидообразования
- •§ 3. Основы экспериментальных методов исследования радиоколлоидов
- •Глава 5
- •§ 1. Закономерности процессов соосаждения с изотопными носителями
- •§ 2. Основные области применения изотопных носителей
- •§ 3. Принцип действия и закономерности процессов соосаждения со специфическими носителями
- •§ 4 Факторы, влияющие на процесс соосаждения со специфическими носителями
- •§ 5. Особенности процессов соосаждения со специфическими носителями
- •§ 6. Сокристаллизация со специфическими носителями при отсутствии изоморфизма 1 рода
- •§ 7. Основы экспериментальных методов исследования процессов соосаждения со специфическими носителями
- •§ 8. Основные области применения специфических носителей
- •Глава 6
- •§ 1. Первичная адсорбция
- •§ 2. Вторичная обменная адсорбция
- •§ 3. Закономерности процесса соосаждения с неспецифическими носителями
- •§ 4. Соосаждение с неспецифическими носителями при образовании внутренне-адсорбционных систем
- •§ 5. Основы экспериментальных методов исследования процессов соосаждения с неспецифическими носителями
- •§ 6. Основные области применения неспецифических носителей
- •§ 7. Методы разграничения различных видов соосаждения
- •Глава 7
- •§ 1. Закономерности и классификация экстракционных процессов
- •§ 3. Практическое использование процессов экстракции
- •Глава 8
- •§ 1. Основные закономерности хроматографических процессов Ионообменная хроматография.
- •Распределительная хроматография.
- •См.: Егоров е. В., Макарова с. Б. Ионный обмен в радиохимии. М., Атомиздат, 1971. § 2. Основы экспериментальных методов хроматографического исследования
- •См.: Роберте т. Радиохроматография. М., Мир, 1981. § 3. Примеры практического использования хроматографических методов в радиохимии
- •Глава 9
- •§ 1. Закономерности электрохимических процессов
- •§ 2 Особенности поведения радиоактивных элементов (нуклидов) при электрохимических процессах
- •§ 3. Основы экспериментальных методов исследования электрохимических процессов
- •§ 4. Использование электрохимических процессов в радиохимии
- •2 Химия радиоактивных элементов
- •Глава 10
- •§ 1. Технеций
- •§ 2. Прометий
- •§ 3. Полоний
- •§ 4. Астат
- •§ 5. Радон
- •§ 6. Франций
- •§ 7. Радий
- •Глава 11
- •§ 1. История открытия актиния и актиноидов
- •§ 2. Важнейшие изотопы актиния и актиноидов, методы их получения и идентификации
- •§ 3. Физические свойства актиния и актиноидов
- •§ 4. Актиний
- •§ 5. Торий
- •§ 6. Протактиний
- •§ 7. Уран, нептуний, плутоний и америций
- •§ 8. Трайсамерициевые актиноиды
- •Глава 12
- •§ 1. История открытия
- •§ 2 Методы получения и идентификации
- •3 Химические последствия радиоактивного распада
- •Глава 13
- •§ 1. История открытия ядерной изомерии
- •§ 2. Особенности явления ядерной изомерии
- •§ 3. Химические последствия изомерных переходов
- •§ 4. Практическое использование химических последствий изомерного перехода
- •Глава 14
- •§ 1. Теоретические аспекты химических последствий --распада
- •§ 2. Экспериментальные методы исследования химических последствий --распада
- •§ 3. Практическое использование химических последствий --распада
§ 4 Факторы, влияющие на процесс соосаждения со специфическими носителями
Как следует из предыдущего изложения,
значения константы распределения КN и коэффициента кристаллизации D характеризуют степень перехода радиоактивного элемента в кристаллическую. фазу специфического носителя.
Представляет интерес выяснить, какие факторы влияют на значения констант КN, и D и в какой мере можно управлять процессами соосаждения радиоактивных элементов со специфическими носителями. Ответ на эти вопросы дает теория А. П. Ратнера, которая исходит из того, что термодинамическое равновесие между кристаллической фазой и раствором может быть рассмотрено применительно как к веществу радиоактивного элемента, так и к веществу носителя.
Рассмотрим вначале два случая равновесия между кристаллической фазой и раствором в отношении радиоактивного элемента. 1) равновесие между смешанными кристаллами, содержащими радиоактивный элемент и носитель, и раствором, насыщенным в отношении вещества носителя и содержащим микроколичества радиоактивного элемента; 2) равновесие между кристаллической фазой соединения радиоактивного элемента и его насыщенным раствором.
В п е р в о м с л у ч а е, как указывалось ранее, условием термодинамического равновесия является равенство химических потенциалов радиоактивного элемента в равновесных фазах:
i = i, |
(5.12) |
Причем
i = 0i + RT lnai = 0i + RT ln (xii) |
(5.13) |
и
i = 0i + RT ln ai = 0i + RT ln (mii) |
(5.14) |
где аi и аi — термодинамические активности вещества радиоактивного элемента в твердой и жидкой фазах; хi — молярная доля вещества радиоактивного элемента в твердой фазе; mi — молярная концентрация вещества радиоактивного элемента в жидкой фазе; i и i — коэффициенты активности вещества радиоактивного элемента в твердой и жидкой фазах; i0 и i0 — стандартные химические потенциалы вещества радиоактивного элемента в соответствующих фазах.
Термодинамическая активность вещества радиоактивного элемента в жидкой фазе может быть выражена через среднеионные активности аi±:
ai = ai± = a+i+ a-i- = mi±i±, |
(5.15) |
где + и -
— числа катионов и анионов, образующихся
при диссоциации соединений радиоактивного
элемента и носителя;
= + + -
— общее число ионов , на которые
диссоциируют молекулы веществ
радиоактивного элемента и носителя;
![]() -
средняя молярная концентрация вещества
радиоактивного элемента в жидкой фазе;
-
средняя молярная концентрация вещества
радиоактивного элемента в жидкой фазе;
![]() -
среднеионный коэффициент активности
вещества радиоактивного элемента в
жидкой фазе.
-
среднеионный коэффициент активности
вещества радиоактивного элемента в
жидкой фазе.
Стандартное состояние i-го компонента в твердой фазе соответствует крайне разбавленному твердому раствору, когда xi 0 и i 1.
В жидкой фазе стандартное состояние отвечает бесконечно разбавленному раствору, ионная сила которого I 0 и i 1.
Так как нас интересует твердый раствор, крайне разбавленный в отношении радиоактивного элемента (i = 1), то из выражений (5.12) — (5.15) получаем
|
(5.16) |
Для в т о р о г о с л у ч а я условие термодинамического равновесия между кристаллической фазой вещества радиоактивного элемента и его насыщенным раствором может быть представлено следующим образом:
i(r) = i(r), |
(5.17) |
причем
i(r) = 0i(r) + RT ln xi(r) i(r) = 0i(r). |
(5.18) |
Тогда:
i(r) = 0i + RT ln ai(r) = 0i + RT ln mi(r)i(r). |
(5.19) |
где xi(r) = 1 — молярная доля вещества радиоактивного элемента в твердой фазе, образованной чистым веществом радиоактивного элемента; ai(r) и mi(r) — термодинамическая активность и молярная концентрация вещества радиоактивного элемента в его насыщенном растворе; 0i(r), и 0i(r) — стандартные химические потенциалы вещества радиоактивного элемента в соответствующих фазах.
Стандартное состояние в жидкой фазе для второго случая равновесия остается тем же, что и для первого случая. Для твердой фазы, представляющей собой кристаллы соединения радиоактивного элемента, имеем
i(r) = 0i(r),
так, как i(r) = 1 при xi(r) = 1.
Тогда из выражений (5.17) - (5.19) и (5.15) получаем
i(r) = 0i(r) = 0i + RT ln (mi±(r) i±(r)) |
(5.20) |
Подставляя 0i из равенства (5.20) в выражение (5.16), имеем
|
(5.21) |
Умножим обе части равенства (5.21) на an / xn, где an = (аn±) = (mn±n±) — термодинамическая активность вещества носителя в его насыщенном растворе, xn — молярная доля вещества носителя в твердой фазе. Тогда имеем
|
(5.22) |
Учитывая, что xn = 1 и m-n- = m-i- (для систем с общим анионом*), левая часть уравнения (5.22) может быть представлена следующим образом:
|
(5.23) |
Величина D0 была названа А. П. Ратнером истинной константой фракционирования, так как она в отличие от экспериментально определяемого коэффициента кристаллизации D не зависит от состава жидкой фазы.
С другой стороны, как видно из уравнения (5.23), значение коэффициента кристаллизации зависит от свойств чистых компонентов (носителя и радиоактивного элемента), а также свойств бесконечно разбавленного твердого раствора. Действительно, так как
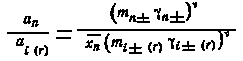 то
то
|
(5.24) |
Коэффициент кристаллизации D с учетом выражений (5.23) и (5.24) может быть представлен следующим образом:
|
(5.25) |
Рассмотрим влияние различных факторов на процесс соосаждения радиоактивных элементов со специфическими носителями с позиций теории Ратнера. Уравнение (5.25) является собственно уравнением Ратнера. Из этого уравнения видно, что значение коэффициента кристаллизации определяется тремя факторами: 1) отношением термодинамических активностей соединений носителя и радиоактивного элемента в их насыщенных растворах. Этот фактор зависит от характера системы и вещества носителя. Критерием оптимального выбора носителя является максимальное значение отношения термодинамических активностей веществ в их насыщенных растворах**;
e(0i(r) - 0i)/RT,
2) экспоненциальным множителем учитывающим отклонение свойств образующихся смешанных кристаллов oт идеальных. При этом разность 0i(r) — 0i представляет собой работу, необходимую для переноса 1 моль радиоактивного элемента из его чистых кристаллов в бесконечно разбавленный твердый раствор. Этот фактор также зависит от характера системы, особенно от степени близости кристаллохимических характеристик соединений носителя и радиоактивного элемента, а также от концентрации радиоактивного элемента в твердой фазе и от температуры; 3) отношением среднеионных коэффициентов активности соединений радиоактивного элемента и элемента носителя в их общем растворе (i± / n±). Этот фактор определяется как природой сокристаллизующихся соединений, так и составом жидкой фазы, от которого зависит значение ионной силы раствора.
Таким образом, теория Ратнера позволяет обосновать оптимальный выбор специфического носителя для определенного радиоактивного элемента или нуклида. Однако практически из-за отсутствия значений коэффициентов активности и химических потенциалов компонентов в твердых растворах в настоящее время на основании теории выбор носителя неосуществим и в подавляющем большинстве случаев носитель подбирается экспериментально.
Для выбранной системы носитель — радиоактивный элемент (радиоактивный нуклид) эффективностью соосаждения можно управлять, используя зависимость коэффициентов активности от состава жидкой фазы и температуры.
Состав жидкой фазы влияет на значение коэффициента кристаллизации через отношение термодинамических активностей ионов радиоактивного элемента и носителя аi/аn. Это отношение можно регулировать за счет неодинакового изменения коэффициентов активности при добавлении посторонних электролитов, а также за счет избирательного связывания одного из компонентов системы в соединения, не участвующие в изоморфном замещении (малодиссоциированные, комплексные). Преимущественное связывание радиоактивного элемента приводит к уменьшению коэффициента кристаллизации, в то время как связывание элемента-носителя — к его возрастанию.
Влияние температуры на коэффициент кристаллизации индивидуально и определяется характером системы.
Процесс изоморфной сокристаллизации можно рассматривать как распределение радиоактивного элемента между двумя несмешивающимися растворителями или как ионообменную гетерогенную реакцию. Рассмотрим гетерогенную реакцию
ВаСl2 + RaCl2 ВаСl2 + RaCl2;
Константа равновесия этой реакции может быть представлена выражением Kр = aian/(aian), где индексы n и i относятся соответственно к барию и радию. Учитывая, что
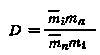 ,
имеем
,
имеем
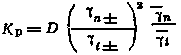 .
.
Так как для носителя в твердой фазе xn 1 и n 1, получаем
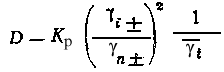 .
.
Значение константы равновесия изменяется с темпера турой в соответствии с уравнением
![]() ,
где
H0 — изменение
стандартной энтальпии.
,
где
H0 — изменение
стандартной энтальпии.
Кроме того, температура влияет на отношение i±/n±, что обусловлено неодинаковым изменением парциальных моляльных энтальпий компонентов в их общем растворе.
И, наконец, с температурой изменяется коэффициент активности радиоактивного элемента в твердой фазе, так как
i = e-0i/RT
= e-(H0i
- TS0i)/RT
и
![]() ,
где
H0i -
изменение парциальной стандартной
энтальпии.
,
где
H0i -
изменение парциальной стандартной
энтальпии.
Сложный характер зависимости коэффициента кристаллизации от температуры объясняется одновременным влиянием ее на все рассмотренные выше факторы. Как показывают экспериментальные исследования, при микроконцентрациях радиоактивного элемента влияние температуры на коэффициент кристаллизации в основном обусловлено изменением экспоненциального множителя в уравнении Ратнера. Для различных систем может наблюдаться увеличение, уменьшение или неизменность значений D с изменением температуры.
Для систем с общим катионом m+n+ = m+n+. ** Ранее при выборе носителя руководствовались отношением растворимостей соединений радиоактивного элемента и носителя (что некорректно).