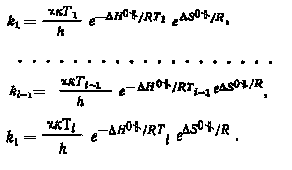- •В.Д.Нефедов е.Н.Текстер м.А.Торопова радиохимия
- •Глава 1
- •§ 1. Предмет радиохимии
- •§ 2. Краткий очерк истории развития радиохимии
- •§ 3. Особенности радиохимии
- •§ 4. Значение радиохимии
- •1 Общая радиохимия глава 2
- •§ 1. Общехимические свойства изотопных частиц
- •2. Термодинамическое поведение изотопных частиц
- •3. Кинетическое поведение изотопных частиц
- •Глава 3
- •§ 1. Классификация реакций изотопного обмена
- •§ 2. Причины протекания реакций изотопного обмена
- •3. Особенности реакций идеального изотопного обмена
- •§ 4. Основное уравнение кинетики реакций идеального изотопного обмена
- •§ 5. Основы экспериментальных методов исследования процессов изотопного обмена
- •Глава 4
- •§ 1. Состояние радиоактивных элементов [нуклидов] в жидкой фазе
- •§ 2. Процессы радиоколлоидообразования
- •§ 3. Основы экспериментальных методов исследования радиоколлоидов
- •Глава 5
- •§ 1. Закономерности процессов соосаждения с изотопными носителями
- •§ 2. Основные области применения изотопных носителей
- •§ 3. Принцип действия и закономерности процессов соосаждения со специфическими носителями
- •§ 4 Факторы, влияющие на процесс соосаждения со специфическими носителями
- •§ 5. Особенности процессов соосаждения со специфическими носителями
- •§ 6. Сокристаллизация со специфическими носителями при отсутствии изоморфизма 1 рода
- •§ 7. Основы экспериментальных методов исследования процессов соосаждения со специфическими носителями
- •§ 8. Основные области применения специфических носителей
- •Глава 6
- •§ 1. Первичная адсорбция
- •§ 2. Вторичная обменная адсорбция
- •§ 3. Закономерности процесса соосаждения с неспецифическими носителями
- •§ 4. Соосаждение с неспецифическими носителями при образовании внутренне-адсорбционных систем
- •§ 5. Основы экспериментальных методов исследования процессов соосаждения с неспецифическими носителями
- •§ 6. Основные области применения неспецифических носителей
- •§ 7. Методы разграничения различных видов соосаждения
- •Глава 7
- •§ 1. Закономерности и классификация экстракционных процессов
- •§ 3. Практическое использование процессов экстракции
- •Глава 8
- •§ 1. Основные закономерности хроматографических процессов Ионообменная хроматография.
- •Распределительная хроматография.
- •См.: Егоров е. В., Макарова с. Б. Ионный обмен в радиохимии. М., Атомиздат, 1971. § 2. Основы экспериментальных методов хроматографического исследования
- •См.: Роберте т. Радиохроматография. М., Мир, 1981. § 3. Примеры практического использования хроматографических методов в радиохимии
- •Глава 9
- •§ 1. Закономерности электрохимических процессов
- •§ 2 Особенности поведения радиоактивных элементов (нуклидов) при электрохимических процессах
- •§ 3. Основы экспериментальных методов исследования электрохимических процессов
- •§ 4. Использование электрохимических процессов в радиохимии
- •2 Химия радиоактивных элементов
- •Глава 10
- •§ 1. Технеций
- •§ 2. Прометий
- •§ 3. Полоний
- •§ 4. Астат
- •§ 5. Радон
- •§ 6. Франций
- •§ 7. Радий
- •Глава 11
- •§ 1. История открытия актиния и актиноидов
- •§ 2. Важнейшие изотопы актиния и актиноидов, методы их получения и идентификации
- •§ 3. Физические свойства актиния и актиноидов
- •§ 4. Актиний
- •§ 5. Торий
- •§ 6. Протактиний
- •§ 7. Уран, нептуний, плутоний и америций
- •§ 8. Трайсамерициевые актиноиды
- •Глава 12
- •§ 1. История открытия
- •§ 2 Методы получения и идентификации
- •3 Химические последствия радиоактивного распада
- •Глава 13
- •§ 1. История открытия ядерной изомерии
- •§ 2. Особенности явления ядерной изомерии
- •§ 3. Химические последствия изомерных переходов
- •§ 4. Практическое использование химических последствий изомерного перехода
- •Глава 14
- •§ 1. Теоретические аспекты химических последствий --распада
- •§ 2. Экспериментальные методы исследования химических последствий --распада
- •§ 3. Практическое использование химических последствий --распада
§ 5. Основы экспериментальных методов исследования процессов изотопного обмена
На первой стадии экспериментального изучения реакций изотопного обмена необходимо надежно установить факт наличия обмена. Для этого синтезируются вещества АХ и ВХ, одно из которых содержит радиоактивный изотоп X*. В соответствии со свойствами изучаемых соединений выбираются условия проведения реакции изотопного обмена и разрабатывается методика, позволяющая осуществить раздельное определение содержания изотопа X* в обеих формах. В большинстве случаев это требует разделения участвующих в обмене химических форм*. Критерием наличия изотопного обмена является обнаружение радиоактивного изотопа в химической форме, первоначально его не содержавшей.
Существенным моментом в изучении процессов изотопного обмена является доказательство отсутствия параллельно протекающих химических реакций, приводящих к усложнению реакций обмена. Основным критерием этого служит подчинение процесса изотопного обмена уравнению (3.5). Другим критерием является неизменность любых физико-химических характеристик системы (показателя преломления, электрической проводимости, молекулярных спектров и т. д.)**.
Следующим этапом исследования является определение основной экспериментальной характеристики реакций изотопного обмена — степени обмена F. Для расчета этой величины прежде всего необходимо выяснить, обеспечивает ли выбранная методика разделения обменивающихся форм отсутствие нулевого обмена. Доказательством отсутствия нулевого обмена является то, что прямые, -ln(1-F) - t, описывающие зависимость
проходят через начало координат (рис. 3,в). В этом случае расчет степени обмена чаще всего проводится по формуле
Ft = at/a, где at — измеряемая массовая активность первоначально неактивного соединения АХ в момент времени t (Бк/г элемента X); a — массовая активность этой формы, отвечающая состоянию равновесия реакции изотопного обмена.
На практике величина a рассчитывается по уравнению
![]() где сAX и сBX —
концентрации обменивающихся форм
(моль/л); V — объем системы (л); Aисх
— общая радиоактивность обменивающегося
изотопа в системе.
где сAX и сBX —
концентрации обменивающихся форм
(моль/л); V — объем системы (л); Aисх
— общая радиоактивность обменивающегося
изотопа в системе.
Массовые активности формы АХ следующим образом связаны с концентрациями [АХ*]t и [АХ*]:
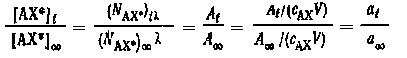 где — постоянная
радиоактивного распада изотопа X*;
(NAX*)t и (NAX*).
- общее число частиц АХ* в моменты
времени t и t = tравн; At
и A — общие
активности формы АХ* в соответствующие
моменты времени.
где — постоянная
радиоактивного распада изотопа X*;
(NAX*)t и (NAX*).
- общее число частиц АХ* в моменты
времени t и t = tравн; At
и A — общие
активности формы АХ* в соответствующие
моменты времени.
При наличии в изучаемой системе нулевого обмена степень обмена рассчитывают по формуле***:
![]() где FK—кажущаяся (экспериментально
наблюдаемая) степень обмена; F0 —
степень нулевого обмена, которая
рассчитывается из массовой активности
формы АХ, выделяемой сразу же после
смешения обменивающихся форм.
где FK—кажущаяся (экспериментально
наблюдаемая) степень обмена; F0 —
степень нулевого обмена, которая
рассчитывается из массовой активности
формы АХ, выделяемой сразу же после
смешения обменивающихся форм.
Исходя из экспериментально определенного значения степени обмена F, можно рассчитать кинетические характеристики реакций изотопного обмена (константу скорости, свободную энергию активации,энтальпию и энтропию активации).
Основной кинетической характеристикой этих реакций является константа скорости k, которая связана с концентрациями обменивающихся форм соотношением:
= kcm1 cn2 cl3 |
(3.6) |
где c1, c2, c3 — концентрация обменивающихся форм; m, n, l — порядок реакции в отношении каждого из компонентов.
Общая скорость рассчитывается из уравнения (3.5) и не зависит от времени обмена.
Порядок реакции идеального изотопного обмена в отношении отдельных компонентов определяется путем изучения зависимости общей скорости обмена от концентрации данного компонента при неизменной концентрации остальных компонентов. При этом порядок реакции в отношении первого компонента равен тангенсу угла наклона прямой, соответствующей зависимости
const = ln(kcn2 cl3) где ln = m ln c1 + const
Аналогичным образом определяется порядок реакции по отношению к другим компонентам.
Зная и порядок реакции по всем компонентам, можно из соотношения (3.6) рассчитать константу скорости реакции идеального изотопного обмена.
Определение энтальпии активации сводится к изучению зависимости константы скорости реакции изотопного обмена от температуры при постоянных значениях концентраций обменивающихся форм.
Как указывалось выше, связь между константой скорости реакции k и константой равновесия процесса образования активированного комплекса выражается соотношением
![]() где
где
![]()
К, в свою очередь, следующим образом связана с изменением стандартной свободной энергии в процессе образования активированного комплекса (соответствующей свободной энергии активации реакции изотопного обмена G0 ):
G0 = -RT ln K p
Отсюда
K p = e-G0 / RT
Тогда:

Имея в виду, что
G0 = H0 - TS0 , |
(3.7) |
значения констант скоростей можно представить следующими соотношениями:
|
(3.8) |
Отсюда
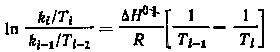
Из этого выражения можно определить энтальпию активации реакции изотопного обмена H0 .
Энтропию активации реакции изотопного обмена рассчитывают из соотношения
![]()
которое получается логарифмированием выражения (3.7). Свободная энергия активации реакции изотопного обмена может быть рассчитана из уравнения (3.8).
Такое разделение не требуется, однако, когда радиоактивный изотоп является мессбауэровским. ** При изучении реакций изотопного обмена с использованием мессбауэровских изотопов ответ на этот вопрос можно получить, наблюдая сдвиги, характерные для форм ВХ и АХ. *** Вывод этой формулы см.: Валь А., Боннер Н. Использование радиоактивности при химических исследованиях. М., ИЛ, 1954, с. 491.