
- •В.Д.Нефедов е.Н.Текстер м.А.Торопова радиохимия
- •Глава 1
- •§ 1. Предмет радиохимии
- •§ 2. Краткий очерк истории развития радиохимии
- •§ 3. Особенности радиохимии
- •§ 4. Значение радиохимии
- •1 Общая радиохимия глава 2
- •§ 1. Общехимические свойства изотопных частиц
- •2. Термодинамическое поведение изотопных частиц
- •3. Кинетическое поведение изотопных частиц
- •Глава 3
- •§ 1. Классификация реакций изотопного обмена
- •§ 2. Причины протекания реакций изотопного обмена
- •3. Особенности реакций идеального изотопного обмена
- •§ 4. Основное уравнение кинетики реакций идеального изотопного обмена
- •§ 5. Основы экспериментальных методов исследования процессов изотопного обмена
- •Глава 4
- •§ 1. Состояние радиоактивных элементов [нуклидов] в жидкой фазе
- •§ 2. Процессы радиоколлоидообразования
- •§ 3. Основы экспериментальных методов исследования радиоколлоидов
- •Глава 5
- •§ 1. Закономерности процессов соосаждения с изотопными носителями
- •§ 2. Основные области применения изотопных носителей
- •§ 3. Принцип действия и закономерности процессов соосаждения со специфическими носителями
- •§ 4 Факторы, влияющие на процесс соосаждения со специфическими носителями
- •§ 5. Особенности процессов соосаждения со специфическими носителями
- •§ 6. Сокристаллизация со специфическими носителями при отсутствии изоморфизма 1 рода
- •§ 7. Основы экспериментальных методов исследования процессов соосаждения со специфическими носителями
- •§ 8. Основные области применения специфических носителей
- •Глава 6
- •§ 1. Первичная адсорбция
- •§ 2. Вторичная обменная адсорбция
- •§ 3. Закономерности процесса соосаждения с неспецифическими носителями
- •§ 4. Соосаждение с неспецифическими носителями при образовании внутренне-адсорбционных систем
- •§ 5. Основы экспериментальных методов исследования процессов соосаждения с неспецифическими носителями
- •§ 6. Основные области применения неспецифических носителей
- •§ 7. Методы разграничения различных видов соосаждения
- •Глава 7
- •§ 1. Закономерности и классификация экстракционных процессов
- •§ 3. Практическое использование процессов экстракции
- •Глава 8
- •§ 1. Основные закономерности хроматографических процессов Ионообменная хроматография.
- •Распределительная хроматография.
- •См.: Егоров е. В., Макарова с. Б. Ионный обмен в радиохимии. М., Атомиздат, 1971. § 2. Основы экспериментальных методов хроматографического исследования
- •См.: Роберте т. Радиохроматография. М., Мир, 1981. § 3. Примеры практического использования хроматографических методов в радиохимии
- •Глава 9
- •§ 1. Закономерности электрохимических процессов
- •§ 2 Особенности поведения радиоактивных элементов (нуклидов) при электрохимических процессах
- •§ 3. Основы экспериментальных методов исследования электрохимических процессов
- •§ 4. Использование электрохимических процессов в радиохимии
- •2 Химия радиоактивных элементов
- •Глава 10
- •§ 1. Технеций
- •§ 2. Прометий
- •§ 3. Полоний
- •§ 4. Астат
- •§ 5. Радон
- •§ 6. Франций
- •§ 7. Радий
- •Глава 11
- •§ 1. История открытия актиния и актиноидов
- •§ 2. Важнейшие изотопы актиния и актиноидов, методы их получения и идентификации
- •§ 3. Физические свойства актиния и актиноидов
- •§ 4. Актиний
- •§ 5. Торий
- •§ 6. Протактиний
- •§ 7. Уран, нептуний, плутоний и америций
- •§ 8. Трайсамерициевые актиноиды
- •Глава 12
- •§ 1. История открытия
- •§ 2 Методы получения и идентификации
- •3 Химические последствия радиоактивного распада
- •Глава 13
- •§ 1. История открытия ядерной изомерии
- •§ 2. Особенности явления ядерной изомерии
- •§ 3. Химические последствия изомерных переходов
- •§ 4. Практическое использование химических последствий изомерного перехода
- •Глава 14
- •§ 1. Теоретические аспекты химических последствий --распада
- •§ 2. Экспериментальные методы исследования химических последствий --распада
- •§ 3. Практическое использование химических последствий --распада
§ 4. Основное уравнение кинетики реакций идеального изотопного обмена
Рассмотрим простую реакцию идеального изотопного обмена между молекулами АХ и ВХ* (IV), происходящую в гомогенной системе при постоянных давлении и температуре.
В начальный момент времени (t=0) в системе присутствуют три разновидности молекул: АХ, ВХ и ВХ*, различающиеся по химической природе или изотопному составу. В результате обмена в системе появляется еще одна разновидность—АХ*, после чего обмен изотопными атомами элемента Х будет происходить между всеми разновидностями молекул АХ и ВХ. Наше рассмотрение мы будем проводить применительно к обмену радиоактивного изотопа. В этом случае форма ВХ* содержит ничтожное коли чество X*. При этом можно выделить две группы процессов:* 1) обмен различными изотопами неодинаковых молекул
1. AX* + BX AX + BX* |
1 |
2. AX + BX* AX* + BX |
2 |
2) обмен одинаковыми атомами неодинаковых молекул
3. AX* + BX* AX* + BX* |
3 |
4. AX + BX AX + BX |
4 |
Как указывалось выше, одной из особенностей реакций идеального изотопного обмена является постоянство общей скорости обмена атомами элемента Х между молекулами АХ и ВХ. Это относится также к суммарной скорости интересующих нас процессов первой и второй групп, хотя вклад в нее отдельных составляющих, соответствующих различным процессам, изменяется во времени.
Введем обозначения: = 1 + 2 + 3 + 4 — суммарная скорость обмена атомами элемента Х между АХ и ВХ,
cAX = [AX] + [AX*], [AX*] = x; cBX = [BX] + [BX*], [BX*] = y,
причем х + у = с, где с — постоянная величина, равная [ВХ*]t=0. Тогда в любой момент времени обмена
= 1 + 2 + 3 + 4 = k (cAX - x)(cBX - y) + kx(cBX - y) + k(cAX - x)y + kxy = kcAX cBX = const.
Таким образом, в течение всего процесса изотопного обмена в отличие от обычных химических реакций общая скорость обмена остается постоянной.
Скорость изменения (нарастания) числа радиоактивных атомов в первоначально неактивном соединении АХ определяется разностью скоростей прямой и обратной реакций:
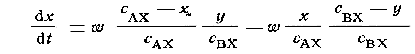
где
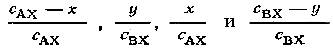 -соответственно
доли взаимодействий, в которых участвуют
молекулы АХ, ВХ*, АХ*, ВХ. В
результате простых преобразований
получаем
-соответственно
доли взаимодействий, в которых участвуют
молекулы АХ, ВХ*, АХ*, ВХ. В
результате простых преобразований
получаем
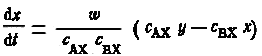
Подставляя у = с — х, получаем
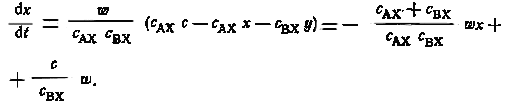
Введя обозначения
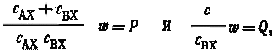 последнее
уравнение легко привести к линейному
дифференциальному уравнению первого
порядка:
последнее
уравнение легко привести к линейному
дифференциальному уравнению первого
порядка:
dx/dt + Px = Q.
Решение этого уравнения относительно x приводит к выражению
|
(3.4) |
где
![]() .
.
Таким образом, концентрация молекул АХ* экспоненциально зависит от времени обмена (рис.3,а).
Дифференцируя уравнение (3.4) по времени, получаем выражение для скорости накопления частиц АХ* в любой момент времени:
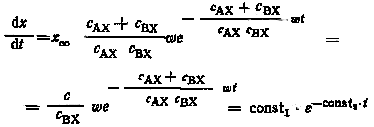 .
.
При t = 0 dx/dt = c/cBX, а при t dx/dt 0 (рис. 3,6). После преобразования и логарифмирования выражения (3.4) получим основное уравнение кинетики для простых реакций идеального изотопного обмена:
|
(3.5) |
Это уравнение приложимо ко всем без исключения случаям простых реакций идеального изотопного обмена независимо от их механизма, концентраций реагирующих веществ, содержания изотопа, участвующего в обмене, и т. д.

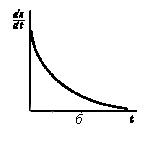
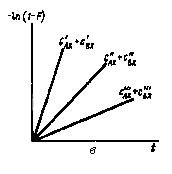 Рис.
3. Зависимость от времени обмена:
a
— концентрации молекул АХ*;
б
— скорость накопления dx/dt;
в
— E
ln (l—F) для различных суммарных концентраций
обменивающихся форм
Рис.
3. Зависимость от времени обмена:
a
— концентрации молекул АХ*;
б
— скорость накопления dx/dt;
в
— E
ln (l—F) для различных суммарных концентраций
обменивающихся форм
Величина х/x, обычно обозначаемая буквой F, называется степенью обмена и представляет собой отношение концентрации молекул АХ* в произвольный момент времени обмена к их концентрации при бесконечно большом времени обмена (после установления равновесия). Степень обмена изменяется от нуля до единицы. Она является основной экспериментально определяемой величиной в реакциях изотопного обмена.
Левая часть уравнения (3.5), которую можно записать как —ln (1—F), является линейной функцией времени. В случае протекания реакции по бимолекулярному механизму зависимость —ln(l—F) от времени для различных суммарных концентраций обменивающихся форм имеет вид, изображенный на рис. 3, в, причем c'AX + с'BX > с"AX + с"BX > с"'AX + с'"BX. Если в системе отсутствует нулевой обмен**, то независимо от механизма протекания реакции изотопного обмена эти прямые проходят через начало координат. В частных случаях, когда cBX >> cAX или cAX >> cBX в уравнении (3.5) можно сделать упрощения и оно принимает вид
![]()
Процессы обмена атомами X*, находящимися в одинаковых молекулах, не влияют на перераспределение изотопа X* между частицами АХ и ВХ и по-этому нами не рассматриваются. ** Так называемый нулевой обмен может быть связан или с неполнотой разделения обменивающихся форм или с индуцированным обменом.

